《美国医学会杂志》首次发表中国乳腺癌新药研究,复旦大学邵志敏教授领衔,卡瑞利珠单抗+化疗显著提高病理完全缓解率

撰文丨王聪
编辑丨王多鱼
排版丨水成文
早期或局部晚期的三阴性乳腺癌 (TNBC) 的首选新辅助治疗策略包括 蒽环类 、 环磷酰胺 、 紫杉烷类 和 铂类 的四药化疗方案。
阻断PD-1/PD-L1通路可能提高经典新辅助化疗的疗效。 卡瑞利珠单抗 (Camrelizumab) 是由恒瑞医药开发 的一款人源化的IgG4-κ抗PD-1单克隆抗体,已在晚期三阴性乳腺癌中显示出抗肿瘤活性。
那么,在化疗的基础上联合使用卡瑞利珠单抗作为早期或局部晚期三阴性乳腺癌患者的新辅助治疗,可否提高病理完全缓解率?
2024年12月13日,国际四大医学期刊之一的《 美国医学会杂志 》 (JAMA) 发表了题为: Camrelizumab vs Placebo in Combination With Chemotherapy as Neoadjuvant Treatment in Patients With Early or Locally Advanced Triple-Negative Breast Cancer:The CamRelief Randomized Clinical Trial 的临床研究论文。
这是首次对早期或局部晚期 三阴性乳腺癌 (TNBC) 术前 白蛋白紫杉醇 + 铂类 + 蒽环类 + 环磷酰胺 联合 中国原创免疫治疗新药 卡瑞利珠单抗 (Camrelizumab) 或者安慰剂的有效性和安全性进行双盲随机对照的临床试验。 据悉,这也是 《美国医学会杂志》创刊141年以来首次发表中国乳腺癌原创新药研究 。
在这项纳入了441例早期或局部晚期的三阴性乳腺癌患者的随机对照临床试验中,与安慰剂+化疗相比, 卡瑞利珠单抗+化疗显著提高了患者的病理完全缓解率 (56.8% vs 44.7%) 。
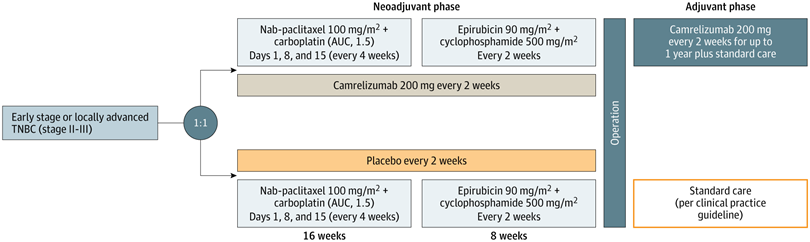
该全国多中心安慰剂双盲随机对照三期临床研究于2020年11月25日至2023年5月12日从中国40家医院入组高风险早期或局部晚期三阴性乳腺癌患者441例(中位年龄48岁)按1比1随机分为两组,
为了评估卡瑞利珠单抗联合化疗与安慰剂联合化疗作为早期或局部晚期的三阴性乳腺癌新辅助治疗的疗效和不良反应。研究团队开展了一项全国多中心、安慰剂、双盲、随机对照的三期临床试验,在 2020年11月25日至2023年5月12日从中国40家医院入组了高风险早期或局部晚期的三阴性乳腺癌患者441例 (中位年龄48岁) ,然后按1:1随机分为两组,其中222例给予卡瑞利珠单抗+化疗,其余219例给予安慰剂+化疗。
化疗包括前16周每28天的第1、8和15天给予白蛋白紫杉醇+卡铂,随后8周每2周给予表柔比星+环磷酰胺。主要研究终点为 病理完全缓解 (即术后病理检查乳腺和淋巴结都找不到浸润癌) 。
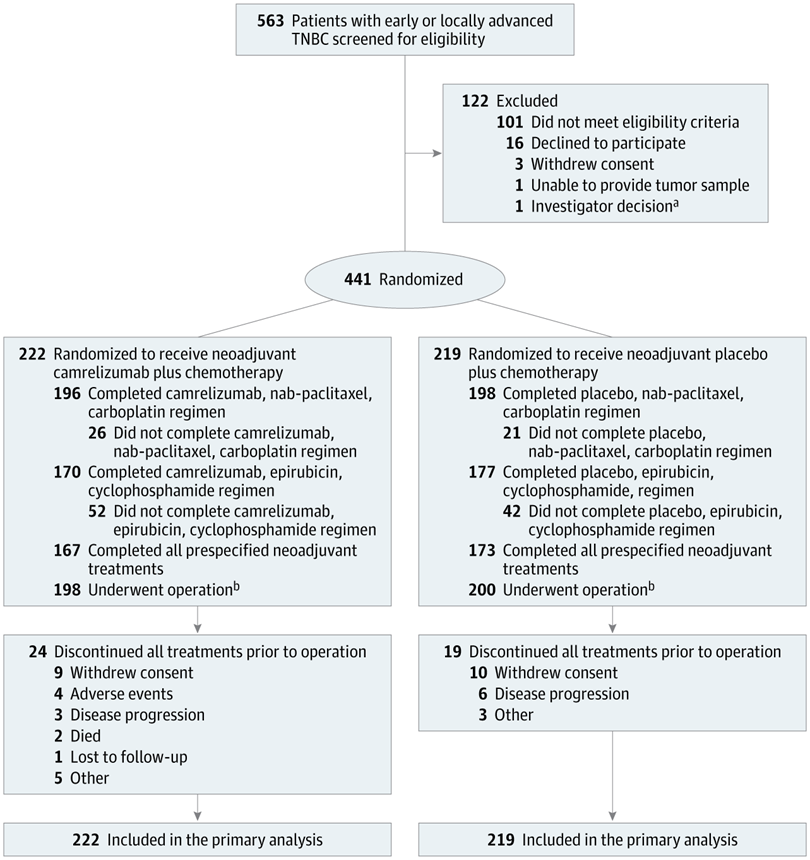
在随机分组的441名女性(中位年龄,48岁)中,从随机分组算起的中位(范围)随访时间为14.4个月。
从随机分组算起,中位随访时间为14.4个月。结果显示,卡瑞利珠单抗-化疗组的126例患者 (56.8%) 和安慰剂-化疗组98例患者 (44.7%) 达到了病理学完全缓解。在新辅助治疗阶段,卡瑞利珠单抗-化疗组198例患者 (89.2%) 和安慰剂-化疗组182例患者 (83.1%) 发生了3级或更高级别的不良事件。卡瑞利珠单抗-化疗组77例患者 (34.7%) 和安慰剂-化疗组50例患者 (22.8%) 发生了严重不良事件,其中卡瑞利珠单抗-化疗组2例患者 (0.9%) 发生了致死性不良事件。
总的来说,这项临床试验结果表明, 在早期或局部晚期的三阴性乳腺癌患者中,新辅助化疗联合卡瑞利珠单抗,显著改善了患者的病理完全缓解。
复旦大学附属肿瘤医院 邵志敏 、 范蕾 为论文共同通讯作者,复旦大学附属肿瘤医院 陈力 、四川省肿瘤医院 李卉 、南阳市中心医院 张浩 、广西医科大学附属肿瘤医院 杨华伟 、蚌埠医学院第一附属医院 钱军 、南昌市第三医院 李志华 、西安交通大学第一附属医院 任予 、 北京大学人民医院 王殊 、浙江大学医学院附属第一医院 傅佩芬 、浙江省肿瘤医院 杨红健 、河北医科大学第四医院 刘运江 、安阳市肿瘤医院 孙静 、云南省肿瘤医院 聂建云 、粤北人民医院 雷睿文 、南京鼓楼医院 姚永忠 、广东省妇幼保健院 张安秦 、中南大学湘雅医院 王守满 、安徽省立医院 马小鹏 、厦门大学附属第一医院 欧阳忠 、遂宁市中心医院 杨宏伟 、复旦大学附属肿瘤医院 吴松阳 、 曹朔文 、 王中华 、广东省人民医院 王坤 、昆明医科大学第一附属医院 蒋爱梅 、湖南省肿瘤医院 欧阳取长 、哈尔滨医科大学附属肿瘤医院 庞达 、河南科技大学第一附属医院 卫利民 、江苏省人民医院 查小明 以及江苏恒瑞医药 朱晓宇 等人。
https://jamanetwork.com/journals/jama/fullarticle/2828232
版权声明:本文为“乐问号”作者或机构在乐问医学上传并发布,仅代表该作者或机构观点,不代表乐问医学的观点或立场,不能作为个体诊疗依据,如有不适,请结合自身情况寻求医生的针对性治疗。
链接:http://www.lewenyixue.com/2024/12/17/%E3%80%8A%E7%BE%8E%E5%9B%BD%E5%8C%BB%E5%AD%A6%E4%BC%9A%E6%9D%82%E5%BF%97%E3%80%8B%E9%A6%96%E6%AC%A1%E5%8F%91%E8%A1%A8%E4%B8%AD%E5%9B%BD%E4%B9%B3%E8%85%BA%E7%99%8C%E6%96%B0%E8%8D%AF/
THE END










赶快来坐沙发