Cancer Cell重磅:针对肿瘤起始细胞增强癌症免疫治疗
肿瘤起始细胞(TIC)具有逃避抗肿瘤免疫的能力,这可能是许多癌症免疫治疗的失败的原因。因此,鉴定TIC标志物以识别TIC并进一步探究TIC和免疫抑制分子之间的关系至关重要。今天,小编要和大家分享一篇 2024年11月 发表在 Cancer Cell(IF:48.8) 上的文章,通过对肝癌(HCC)类器官和球形细胞系进行转录组和表位的细胞索引测序(CITE-seq),揭示了肿瘤免疫逃避的新机制,并进一步为HCC中CD155阻断与抗PD-1/PD-L1治疗相结合提供了理论依据。
Highlight
-
CD49f是HCC中被低估但高效的TIC标记物
-
CD49f - high TIC 与 TME 中的中性粒细胞形成互惠环
-
中性粒细胞赋予 TIC CD155 依赖的免疫特权,以逃避免疫杀伤
-
抗 PD-1/CD155 可有效消除 TIC ,并在 HCC 中显示出良好的疗效
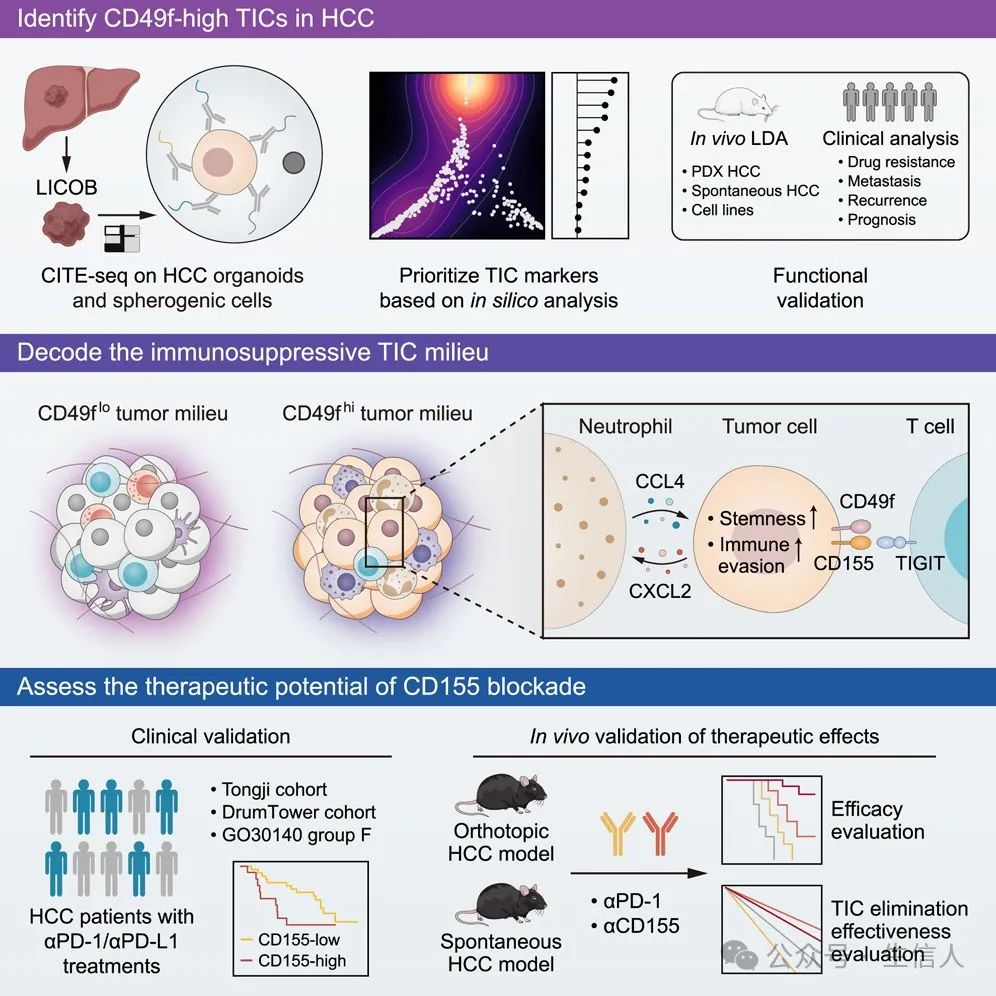 摘要图
摘要图 1.TIC标记表现出表达和功能异质性
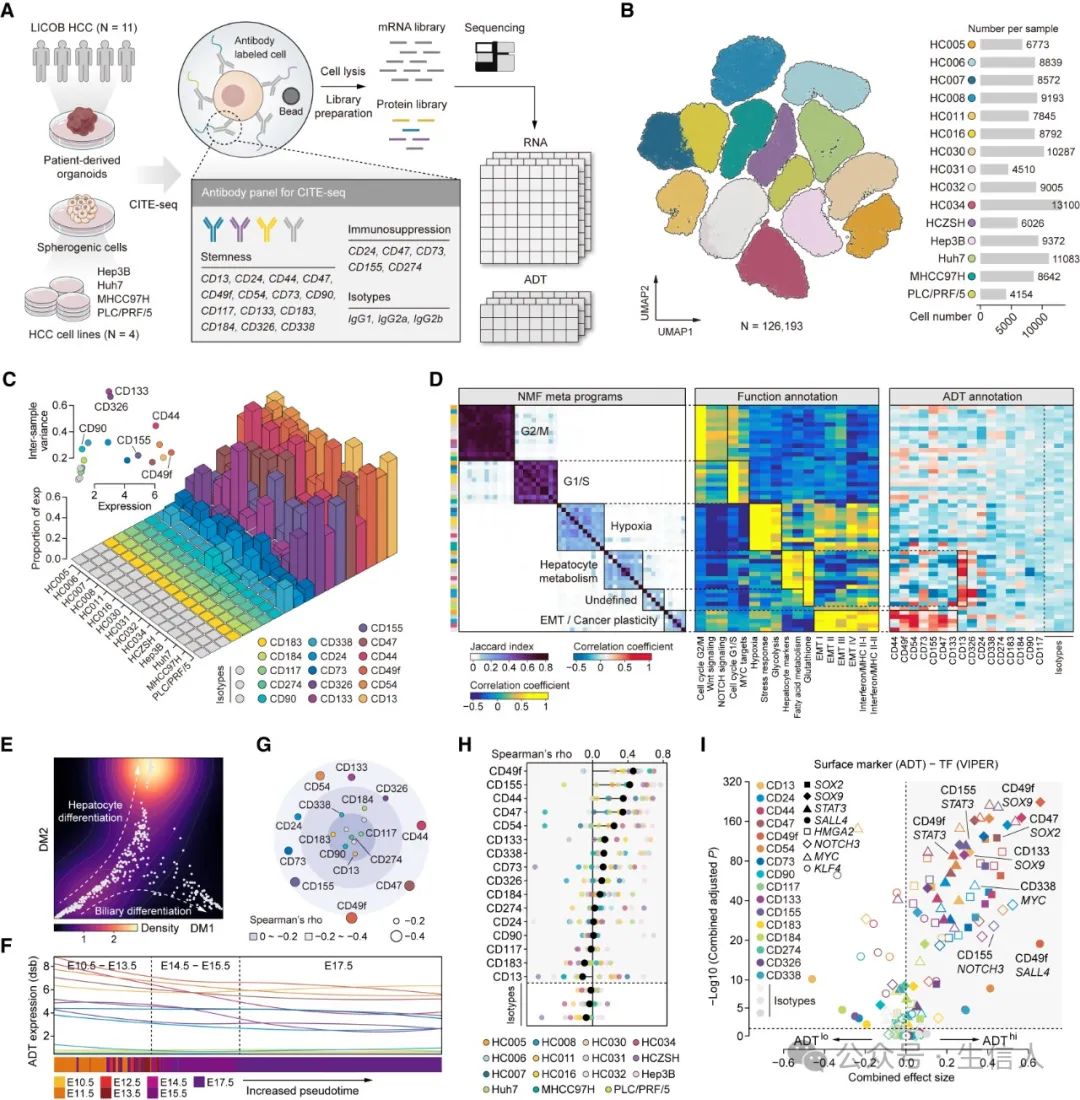
CITE-Seq(转录组和表位的细胞索引测序)是一种基于测序的方法,可在单细胞读数中同时量化细胞表面蛋白和转录组数据。
作者首先使用针对14个TIC标记物和5个免疫抑制相关表面标记物的抗体对11个 HCC类器官和4个球形HCC细胞系进行了CITE-seq,产生了包含126,193个肿瘤细胞的数据集,其中包括抗体衍生标签(ADT)和RNA表达谱。
结果发现,不同的TIC标记表现出不同的样本间表达模式,大致可分为三类:第一类包括CD90和CD184等标记,通常在大多数样本中不表达;第二个包括标记物,例如CD133和CD326,其特征是仅在样本子集中表达;第三个包括CD13、CD49f和CD54等标记物,它们在大多数样本中表现出一致的可检测表达。进一步进行mNMF分析,发现不同的TIC标记生物学功能上也存在显著差异。
2.CD49f是HCC的重要TIC指标
通过动态发育轨迹分析,发现CD49f显示出与假时间最明显的负相关性,表明其在类祖肿瘤细胞中的表达相对较高。并且进一步利用CytoTRACE和细胞熵这两个指标评估细胞干性,发现CD49f与之关联性最强。最后,通过精确细胞网络重建算法(ARACNe)和通过富集调节子分析(VIPER)算法建立每个表面标记与干性相关转录因子之间的联系,都发现CD49f与干性相关TF之间存在最显著联系。
3.CD49f 与较高的致瘤潜力和较差的临床结果密切相关
接下来,作者验证了CD49f作为HCC有效TIC标记物的潜力。通过对球形细胞系和类器官进行单细胞转座酶可及染色质测序(scATAC-seq),并与CITE-seq数据联合分析,都发现CD49f-high细胞中的开放区域富含干性相关转录因子(TF)的基序,而CD49f-low细胞中的开放区域富含与正常肝细胞分化相关的TF。
随后,按CD49f 表达进行分组,通过自发小鼠HCC模型和患者来源的异种移植(PDX)HCC小鼠模型验证了不同来源的CD49f-high HCC细胞的体内致瘤性明显高于CD49f-low HCC。此外,组织微阵列(TMA)队列的mIHC染色结果表明其高表达也预示着不良的临床结果。
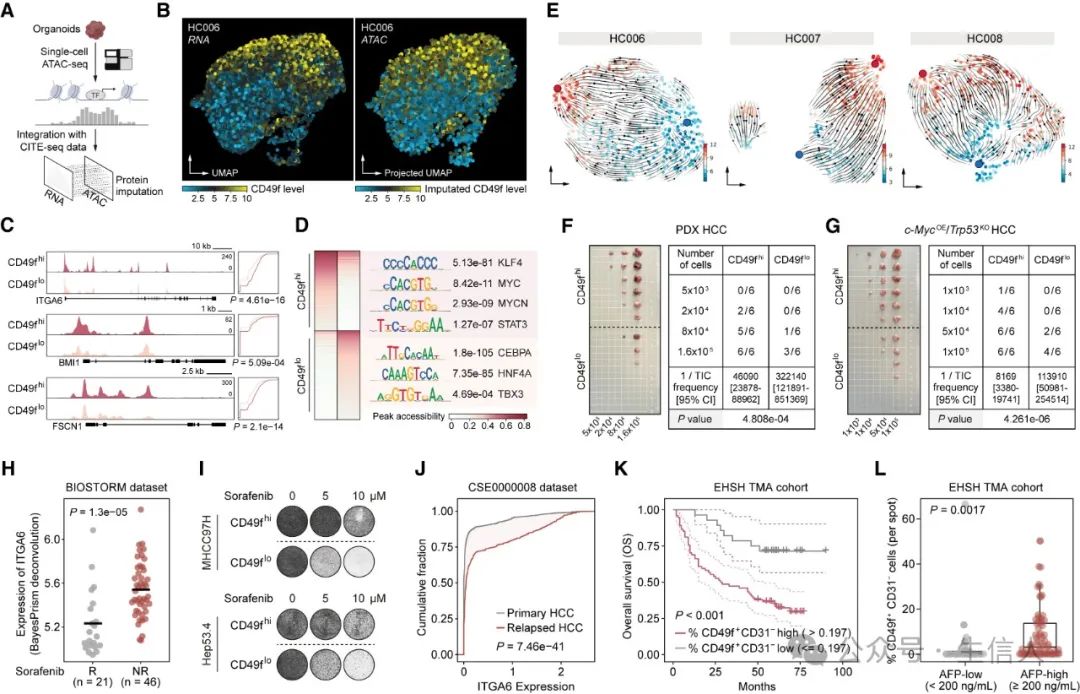 图 2. CD49f 的高表达与致瘤潜力增强和不良临床结果相关
图 2. CD49f 的高表达与致瘤潜力增强和不良临床结果相关
4.CD49f高TIC创建免疫抑制环境并通过CXCL2吸引中性粒细胞
接下来,为了探索CD49f-high 和CD49f-low细胞之间的差异生物学功能,作者对FACS分选的MHCC97H细胞进行RNA测序。结果发现,CD49f 高细胞中上调的基因在骨髓趋化因子相关途径中显着富集,表明这些细胞具有重塑周围环境的潜力。
随后对临床scPLC数据集的分析表明,在肿瘤细胞表现出较高ITGA6表达的情况下,PD-L1表达升高的中性粒细胞和巨噬细胞显着增加,同时CD8+ T细胞显着减少。于是作者使用Hep53.4细胞构建了原位HCC肿瘤,随后进行了单细胞测序。结果与临床分析高度一致,并通过流式细胞术、mIHC 染色等实验进一步证实CD49f-high肿瘤中中性粒细胞的浸润显著增强。
进一步,作者通过数据分析和实验验证证实了CXCL2-CXCR2是驱动CD49f-high肿瘤中中性粒细胞募集的关键。
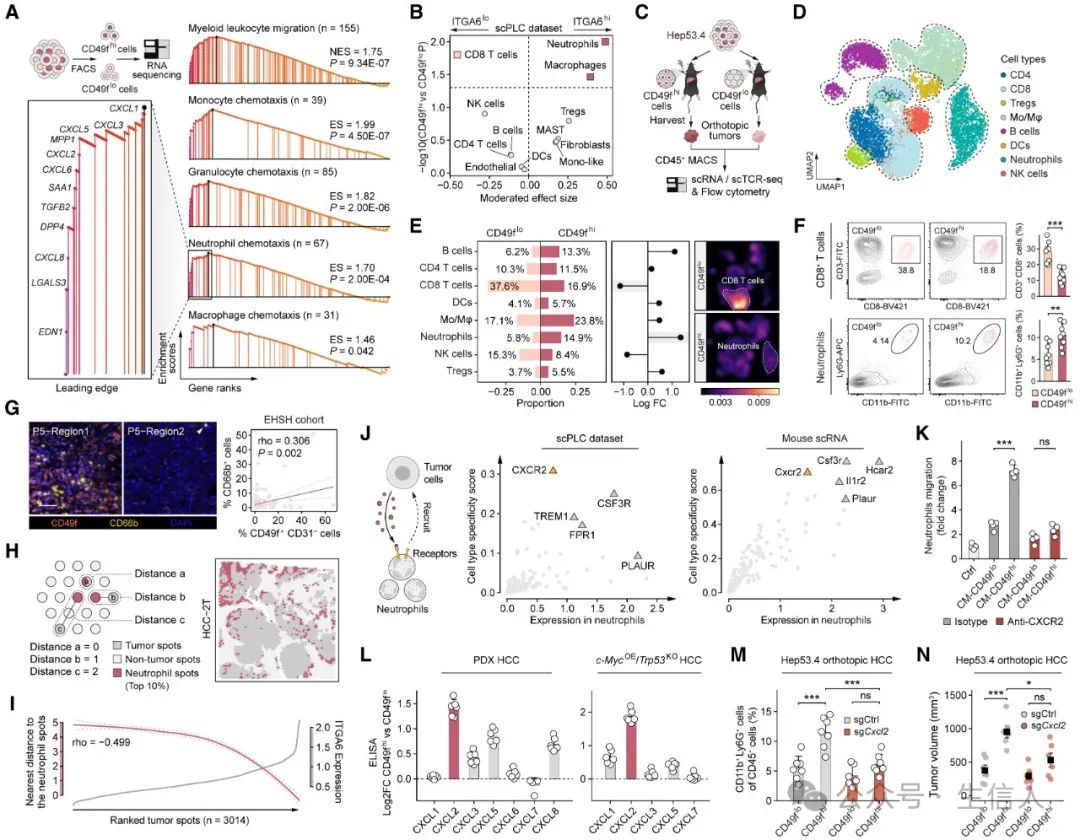 图 3 . CD49f - high TIC 重编程 TME ,通过 CXCR2/CXCL2 促进中性粒细胞浸润
图 3 . CD49f - high TIC 重编程 TME ,通过 CXCR2/CXCL2 促进中性粒细胞浸润
5.中性粒细胞衍生的CCL4对于支持TIC的环境至关重要
至此,作者已经证明了TIC可以影响中性粒细胞。接下来,作者探究了中性粒细胞是否会对TIC表型有影响,从而形成双向调控环路。
通过使用Hep53.4-GFP细胞构建原位HCC肿瘤,然后用或不用Ly6G中和抗体进行治疗,发现中性粒细胞的消耗显着降低了原位肿瘤中GFP+ CD49f+肿瘤细胞的比例,且对CD49f-high细胞的致瘤性减弱效果更强。
此外,作者还根据scPLC数据集的伪大量数据鉴定出构成双向调控环路所需的中性粒细胞分泌的特定配体CCL4。邻近分析也支持了CD49f + CD31-细胞在空间上更接近 CD66b+ CCL4+中性粒细胞。随后一系列细胞共培养、转基因小鼠特异性敲除中性粒细胞中的Ccl4后观察肿瘤形成、外源添加重组人/小鼠CCL4蛋白等实验证明了中性粒细胞来源的CCL4通过激活STAT3信号转导在维持和驱动CD49f-high TIC状态中的关键作用。
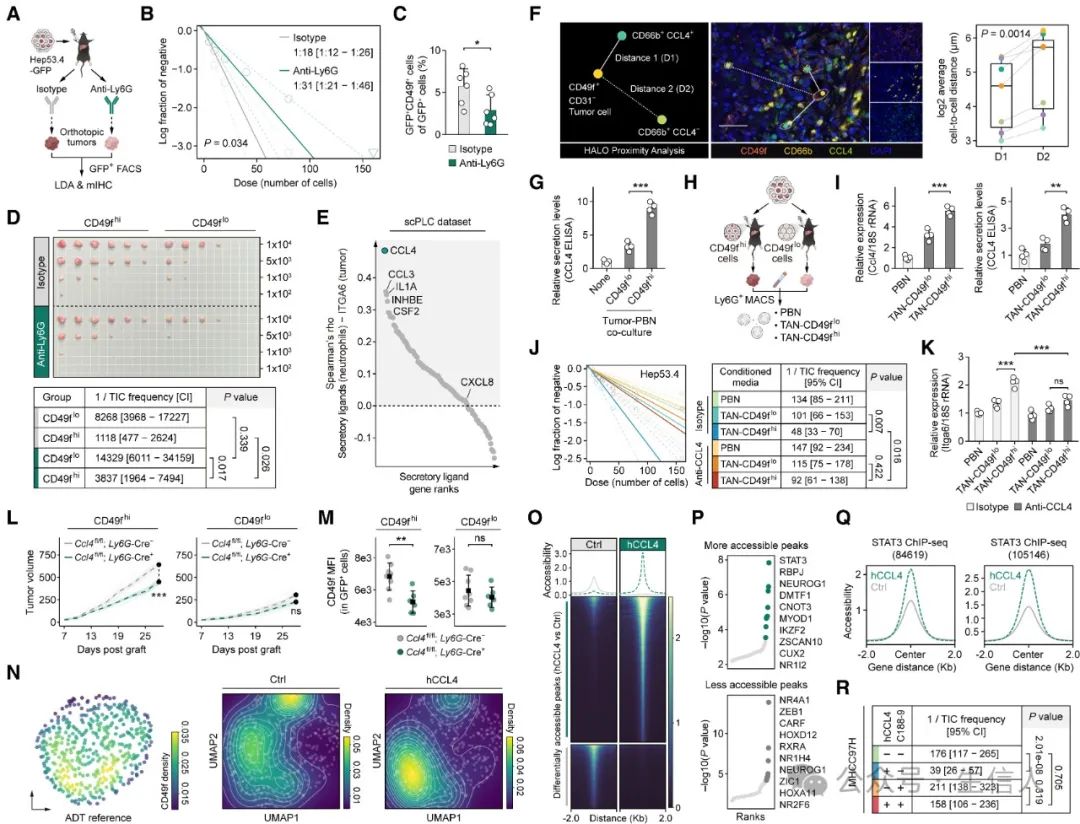 图 4 . 中性粒细胞通过分泌 CCL4 诱导附近 HCC 向 CD49f-high TIC 转变
图 4 . 中性粒细胞通过分泌 CCL4 诱导附近 HCC 向 CD49f-high TIC 转变
6.CD49f-high TIC通过CCL4/STAT3信号传导逃避CD8+ T细胞的细胞毒性
CD49f-high TIC除了影响中性粒细胞,作者还进一步探究了是否有其他免疫细胞参与了其增强的免疫逃逸能力。
通过将FACS分选的Hep53.4细胞分别皮下植入免疫缺陷的NSG小鼠和免疫功能正常的C57BL/6小鼠中,作者发现CD49f-high TIC主要逃避CD8+ T细胞介导的抗肿瘤免疫,并且来CD49-high肿瘤的中性粒细胞的条件培养基显着增强了肿瘤细胞对CD8+ T细胞杀伤的抵抗力,而这可以被中和抗体阻断CCL4和STAT抑制剂C188-9有效逆转。
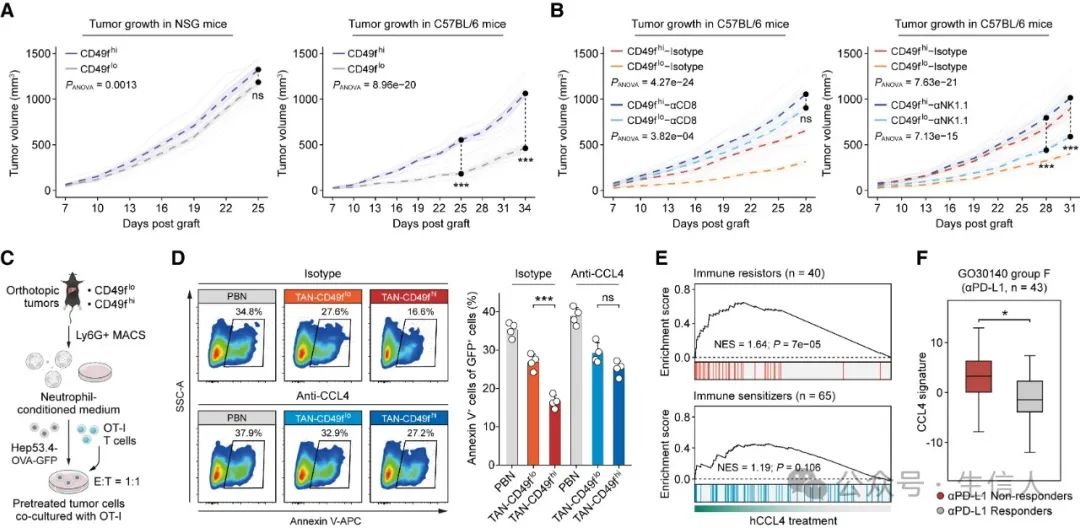 图 5 . CD49f-high TIC 对 CD8 + T 细胞介导的细胞毒性具有增强的抵抗力
图 5 . CD49f-high TIC 对 CD8 + T 细胞介导的细胞毒性具有增强的抵抗力
7.CD49f-high TIC中CCL4/STAT3诱导且CD49f稳定的CD155表达促进其免疫逃避
接下来,作者进一步探究了CD49f-high TIC逃避免疫监视的具体机制。
回到一开始的CITE-seq抗体组,包含了五种针对免疫抑制表面标记的抗体,其中CD49f 和CD155表达显著相关。进一步的细胞免疫荧光、免疫共沉淀和放线菌酮 (CHX) 检测等实验证明了二者存在结合,且CD49f 可以稳定CD155表达。
此外,CCL4对CD155表达具有直接调节作用。这一作用是通过激活STAT3与PVR(编码 CD155)启动子区域的结合促进其转录实现的。
随后的动物实验证明了CD49f高的肿瘤细胞可以通过CCL4诱导和CD49f稳定的CD155表达来逃避CD8+ T 细胞的免疫杀伤。
 图 6 . CD49f-high TIC 通过 CCL4/STAT3 诱导和 CD49f 稳定的 CD155 表达逃避免疫杀伤
图 6 . CD49f-high TIC 通过 CCL4/STAT3 诱导和 CD49f 稳定的 CD155 表达逃避免疫杀伤
8.CD155表达损害HCC中的抗PD1/PD-L1治疗反应
最后,作者探究了CD155表达对HCC免疫治疗有效性的影响。作者招募了46名 HCC患者接受根治性手术切除,然后接受辅助抗PD-1治疗。结果表明, CD155高表达的患者的无复发生存期比CD155低表达患者显着缩短。
9.抗PD-1和抗CD155疗法的组合通过破坏TIC-中性粒细胞串扰来增强治疗效果
既然CD155表达会损害HCC中的抗PD1/PD-L1治疗反应,于是作者使用Pvr-KO消除CD155,的确增强了抗PD-1治疗效果。此外,CD155阻断抗体也可以与抗PD-1疗法协同作用,降低CD49f-high比例,增加CD8+ T细胞,和减少中性粒细胞,从而增强HCC的治疗效果。
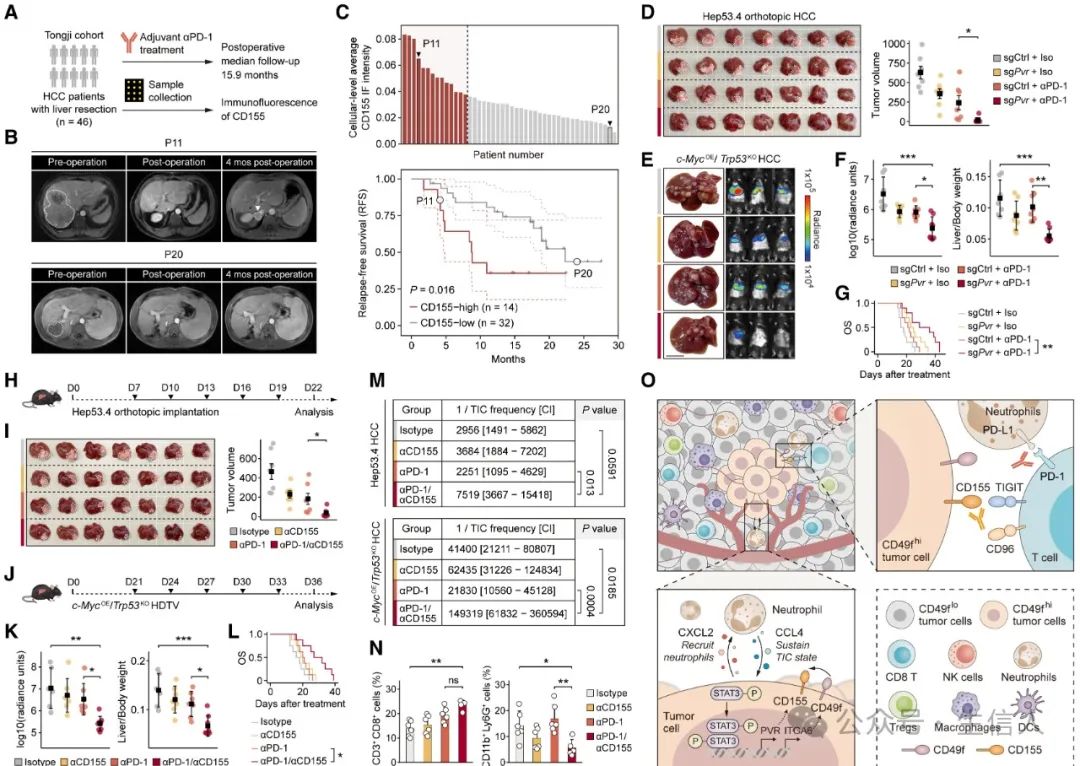 图 7 . 抗 CD155 和抗 PD-1 疗法的组合在原位和自发性 HCC 小鼠模型中表现出协同治疗作用
图 7 . 抗 CD155 和抗 PD-1 疗法的组合在原位和自发性 HCC 小鼠模型中表现出协同治疗作用
总体而言,该研究确立了CD49f在HCC中的重要作用,不仅作为突出的TIC标记物,而且作为潜在的临床指标。小编觉得,这篇文章既有自己的病人队列数据,又整合分析了已发表的多个数据集,还构建了大量的多层次实验模型,包括多种动物模型和类器官、球形细胞系模型。文章工作量巨大,数据扎实,结论可靠,既有分子机制探究,更具有临床指导意义,不愧是能发在Cancer Cell上的文章!
链接:http://www.lewenyixue.com/2024/12/16/Cancer%20Cell%E9%87%8D%E7%A3%85%EF%BC%9A%E9%92%88%E5%AF%B9%E8%82%BF%E7%98%A4%E8%B5%B7%E5%A7%8B/






赶快来坐沙发