CANCER CELL:多组学联合聚焦肿瘤进展
高级别胶质瘤(HGG),尤其是脑胶质母细胞瘤(GBM),是一类高度侵袭性的原发性脑肿瘤,通常具有侵袭性生长、高复发率和神经系统功能受损的临床特征。此外,HGG也表现出基因组变异和肿瘤异质性等分子特征。目前HGG仍具有手术切除难度高、放疗化疗效果有限及治疗耐药的挑战。因此,针对HGG发生发展的分子机制及治疗手段的研究仍然是目前的热点方向。小编今天和大分享一篇 今年七月 刚刚发表在 CANCER CELL(48.8/Q1) 杂志上的文章, 它整合了蛋白质组、代谢组、脂质组、翻译后修饰(PTM)、基因组和转录组等多组学数据,构建了HGG分子图谱,这篇文章也揭示了控制肿瘤发展和进化的多组学调控相互作用。

一.文章摘要
文章的主要流程如图1所示。具体来说研究收集了212个GBM和16个4级IDH突变型星形细胞瘤共计228个 HGG样本,其中包括28个复发肿瘤样本。此外,研究也收集了18个正常脑样本和14个脑转移样本作为对照(图1A)。接着研究整合了这些样本的全外显子组测序(WXS)、全基因组测序(WGS)、DNA甲基化、miRNA、mRNA、单核RNA测序(snRNA)、蛋白质组、磷酸化蛋白质组、乙酰基组、糖蛋白组、代谢组和脂质组等多组学数据(图1B)。结果研究在蛋白质组和代谢组水平上观察到不同的上游改变事件能够汇聚到相同的下游事件。此外,研究也观察到胶质瘤复发时蛋白质与蛋白质的相互作用和糖基化位点会发生变化。研究进一步也观察到PTPN11上会反复发生遗传改变和磷酸化事件,这表明PTPN11信号传导在HGG中发挥重要作用(图1C)。
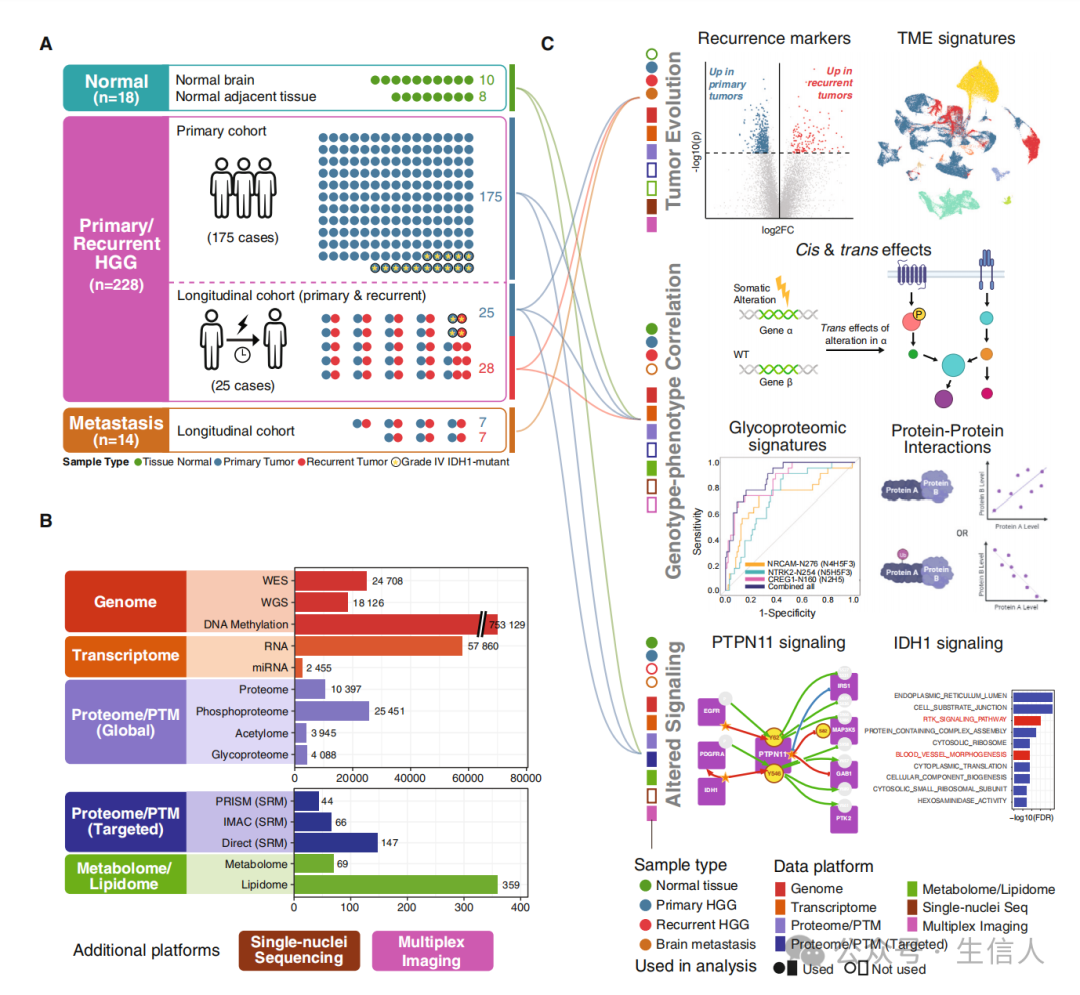 图1 研究队列、技术平台和分析的概述
图1 研究队列、技术平台和分析的概述
二.文章的主要内容及结果
1.HGG从诊断到复发的演变与基因组和蛋白质组驱动因素相关
文章第一部分基于基因组及蛋白质组数据研究了驱动高级别胶质瘤复发的因素。 研究首先分析了一个包含53个肿瘤样本的纵向队列,这些样本来自25例4级IDH野生型(IDH-WT ) GBM和IDH突变型(IDH-mutant)星形细胞瘤患者(图2A)。接着研究识别了复发肿瘤中差异表达的蛋白质,并对上调蛋白进行了功能富集分析(图2B,C)。接着使用激酶库(kinase Library)基于差异的磷酸化位点分析了复发与原发肿瘤的激酶活性(图2D),结果观察到剪接激酶在原发肿瘤中显著更活跃(图2E)。此外,研究也检测了每个原发-复发对样本的突变,并重点关注驱动基因突变随时间推移的情况,结果研究观察到四种模式,分别为驱动突变的稳定、丢失、获得和重获(图2F)。接下来研究扩大到所有体细胞突变,结果发现在疾病进展时间较短的患者中,原发和复发肿瘤间共有突变较多,且克隆相似性与进展时间呈负相关(图2G)。研究对原发和复发肿瘤进行的突变特征分析后也发现了两个主要特征SBS1和SBS11,其中SBS11在复发肿瘤中高表达(图2H)。
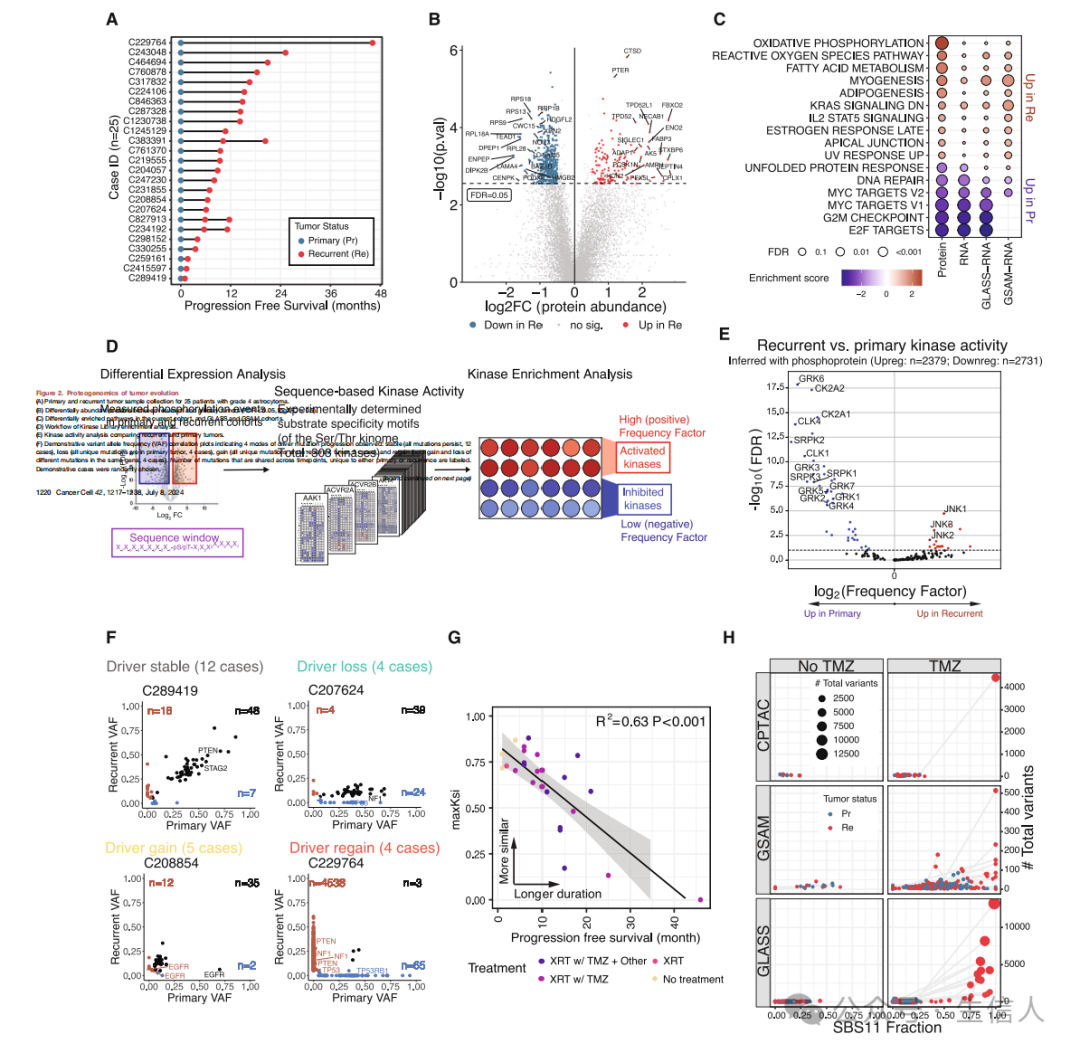 图2 HGG从确诊到复发演变的基因组和蛋白质组驱动因素
图2 HGG从确诊到复发演变的基因组和蛋白质组驱动因素
2.原发性和复发性HGG的肿瘤固有特征和肿瘤微环境(TME)相关特征
文章第二部分分析了原发及复发HGG的特征。 研究对原发和复发的HGG进行了snRNA分析,共分析了134K个细胞核,结果观察到原发和复发性HGG的snRNA差异很大,其中一个极端病例的原发和复发样本展示出不同的肿瘤细胞簇(图3A)。研究接着计算了每种细胞类型的平均转录表达(图3B),发现多种细胞类型与上调和下调蛋白有关(图3B)。研究也对原发和复发肿瘤的恶性细胞进行了队列水平和患者水平的差异表达分析,并观察到原发和复发恶性细胞间的差异表达基因(DEGs)在上皮间质转化、紫外线反应和缺氧通路中富集(图3C),DEGs也在患者间共享(图3D)。研究在NDRG1和KIF1B等基因的启动子和增强子区域也观察到原发和复发恶性细胞间的差异可及染色质区域(DACRs,图3E)。研究通过基序(Motif)富集分析也观察到复发时的差异转录因子活性(图3F)。研究进一步观察到相较复发肿瘤,原发样本的内皮细胞和1型T辅助细胞(Th1)的富集评分显著降低,而复发样本中调节性T细胞(Treg)的富集评分显著增加(图3G)。在相同的纵向肿瘤样本上进行的snRNA-seq和蛋白质去卷积分析也观察到内皮细胞减少(图3H)。接着研究在12个样本中进行多重成像观察了大脑中的主要细胞类型(图3I)。并通过全片定量观察到6例复发患者中有5例患者的内皮细胞比例低于其他非恶性细胞(图3J)。
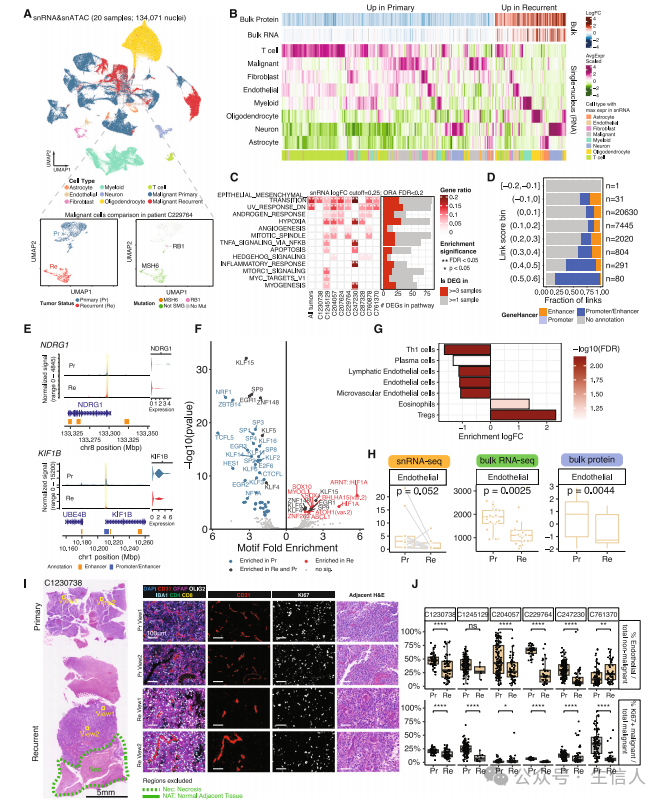 图3 单核测序揭示了复发的4级星形细胞瘤的恶性细胞内在和TME特征
图3 单核测序揭示了复发的4级星形细胞瘤的恶性细胞内在和TME特征
3.遗传改变对HGG蛋白质组学和代谢组学的影响和关联
文章接着对原发肿瘤进行了遗传改变关联分析。 研究首先在TCGA数据集中观察到EGFR和PTPN11改变存在互斥(图4A)。研究也观察到抑癌基因如ATRX和RB1的RNA和蛋白质表达相对较低,而致癌基因如EGFR和PDGFRA的RNA和蛋白质表达水平较高,此外当ATRX发生改变时,其S784位点的磷酸化水平增加,而突变体IDH1的K224位点的乙酰化水平下降(图4B)。研究接着以成对的方式对所有可能的驱动组合进行了反式分析(图4C),并在蛋白质和PTM上观察到驱动基因对在脂质和代谢物表现出同样的正相关(图4D)。其中TERTp和PTEN的改变对蛋白质和PTM的反式影响相关性最强(图4E)。
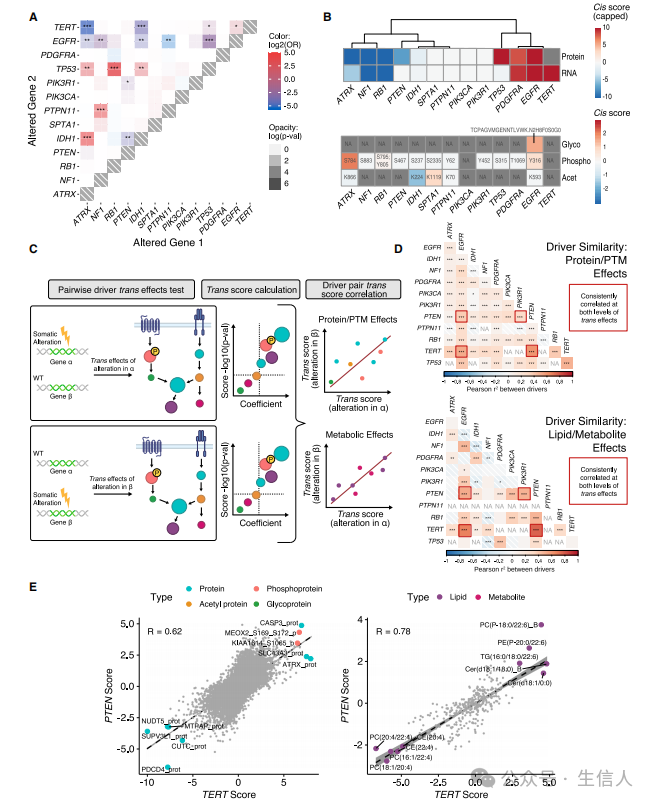 图4 顺式和反式结果强调了原发肿瘤在不同组学水平上的相似性
图4 顺式和反式结果强调了原发肿瘤在不同组学水平上的相似性
4.EGFR活性中糖基化和磷酸化与肿瘤复发的关系
研究接着分析了糖基化和磷酸化与HGG复发的关系。 研究首先对整个队列进行了定量糖蛋白组学分析,结果发现相对于正常样本,4级星形细胞瘤中有671个上调和674个下调的完整糖肽(IGPs,图5A),这些糖肽根据其单糖组成被分为仅低甘露聚糖(High-Man),仅聚焦聚糖(focus),唾液化聚糖以及不属于前三类的聚糖(Others)。研究发现大多数上调的IGPs含有High-Man聚糖(图5B)。研究也观察到与正常组织相比,STT3A、STT3B、GANAB和PRKCSH的过表达与原发性肿瘤相关(图5C)。接着研究使用糖蛋白组学数据识别可能复发的HGG相关糖蛋白,结果观察到复发肿瘤中过表达的IGPs主要是High-Man或聚焦聚糖(图5D)。研究也发现四种糖蛋白(CNTN2、NPTN、ASAH1和NFASC)的糖基化活性升高,ROC分析表明这些糖蛋白的丰度能有效区分复发和原发肿瘤(图5E)。接下来研究通过对具有三个完整糖肽簇(IPC 1-3)的肿瘤进行无偏糖蛋白组学分组,识别了三种糖蛋白组学亚型(Glyco 1-3),并观察到Glyco 1与IPC 2相关、Glyco 3与IPC 1相关(图5F)。研究也进一步分析了队列中观察到的最常见的EGFR体细胞突变(A289和G598)、顺式分析所涉及的显著上调的磷酸化事件(Y316),并使用EGFR活性二聚体结构对N352和N603进行糖基化。结果发现EGFR二聚体上的修饰后观察到Y316残基位于两个EGFR分子结构域之间,且G598突变与N603糖基化共定位(图5G)。
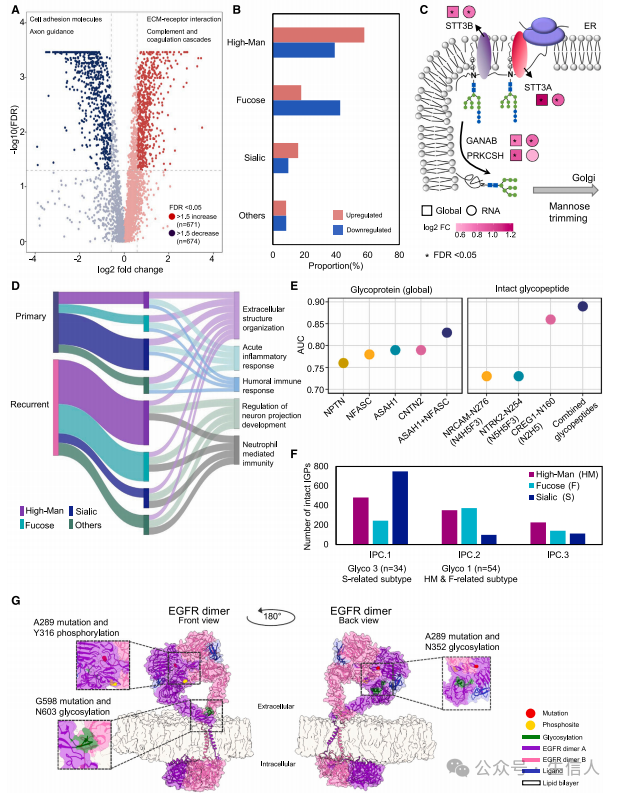 图5 星形细胞瘤中糖基化的改变及EGFR中体细胞突变、糖苷和磷酸基间的关系
图5 星形细胞瘤中糖基化的改变及EGFR中体细胞突变、糖苷和磷酸基间的关系
5.通过靶向蛋白质组学和激酶库辅助的蛋白质-蛋白质相互作用(PPI)分析确定了通路中断
接下来研究对HGG复发过程中的PPI改变进行了分析。 研究首先使用蛋白质丰度相关性评估可能的相互作用(图6A)。接着研究分析了基因改变和WT原发肿瘤编码的蛋白质间的PPI差异,结果发现EGFR和血小板衍生生长因子受体α (PDGFRA)信号通路内的相互作用物存在许多改变(图6B),这一结果表明体细胞改变,特别是突变,会中断PPI,进而导致致癌表型。研究进一步在体细胞改变的样本中观察到14种蛋白质表现出显著的相关性改变,其中一半涉及EGFR(图6C)。接着对RB1和PTPN11进一步分析发现这些蛋白的突变破坏了它们的相互作用(图6D)。接下来研究关注至少涉及一种已知癌症驱动基因的PPI,并选择了三个蛋白相互作用组分,分别为PPI与原发肿瘤相关,但与复发肿瘤无关;PPI与原发肿瘤和复发肿瘤均相关;PPI与复发样本相关,但与原发样本无关(图6E)。研究进一步分析发现RB1和CDK2蛋白丰度在原发肿瘤样本中没有显著相关性,但在复发肿瘤样本中相关性很强,同样AKT1和XIAP蛋白丰度也在复发性肿瘤中高度相关(图6F)。研究也观察到TP53突变肿瘤中细胞周期相关激酶(CDK1-6)激活,而RB1突变肿瘤与它们各自的WT肿瘤相比,这些激酶的激活较少(图6G)。同样,PI3K-AKT通路在EGFR改变的肿瘤中活性较低。
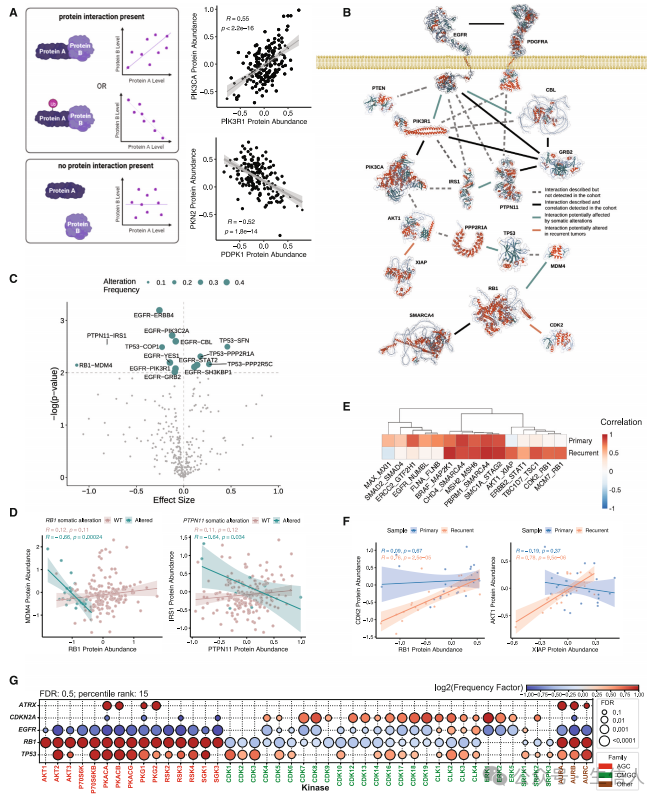 图6 PPI差异与体细胞改变和复发状态有关
图6 PPI差异与体细胞改变和复发状态有关
6.PTPN11可能作为EGFR、PDGFRA和IDH1信号网络的hub节点
文章这部分重点关注了特定驱动因素PTPN11。 研究在队列中观察到11个患者具有PTPN11突变,且该突变与EGFR互斥,一个患者具有PTPN11扩增。研究也观察到该突变位于n端src同源2 (N-SH2)和激酶磷酸酶(PTP)结构域(图7B)。此外,顺式和反式分析也观察到IDH1突变肿瘤中PTPN11- Y546的高磷酸化水平,与EGFR改变肿瘤中PTPN11- Y62的高磷酸化水平不同,且PTPN11突变不影响其Y62和Y546的磷酸化水平(图7C)。研究进一步分析也发现Y62磷酸化与PI3K/AKT通路活性降低以及由此产生的ERK激酶活性降低相关,而Y546与ERK活性强相关(图7D)。此外,AMPKA和相关激酶在肿瘤中也被观察到与Y546磷酸化相关时被抑制,且与IDH- WT肿瘤相比,IDH=突变肿瘤表现出较少的缺氧和细胞应激反应(图7C - F)。这些结果表明Y62的磷酸化是抑制性的,而Y546的磷酸化是激活性的。
 图7 PTPN11信号在4级星形细胞瘤中的作用
图7 PTPN11信号在4级星形细胞瘤中的作用
7.IDH突变HGG中与RTK激活和缺氧信号失调相关的代谢酶及途通路
文章最后对HGG发病和进化过程中GBM和IDH1突变瘤中不同的分子过程进行了分析。 研究首先在分析队列中识别了IDH中的突变事件(图8A),并通过差异甲基化和代谢物丰度分析发现IDH突变肿瘤中有三种代谢物丰度上调(图8A)。此外,在实验测量的737,419个CpG位点中,也观察到与GBM相比,IDH突变肿瘤的甲基化位点有7,914个上调,134个下调(图8A)。此外,IDH突变肿瘤也被观察到与GBM相比蛋白质差异主要涉及包括癌症相关RTK和血管形态发生(缺氧)通路在内的失调(图8A)。RTK信号蛋白也在IDH突变样本中被观察到显著上调(图8B)。蛋白质基因组整合也表明与GBM相比,IDH突变肿瘤的缺氧特征更低(图8C)。接着研究使用STRING数据库进行的蛋白质相互作用分析,观察到HIF1A通路成员之间的正相关性(图8D)。接着为了进一步证实IDH-WT肿瘤具有更强的HIF1A通路激活,研究对IDH-WT和IDH突变星形细胞瘤进行分析,并发现SERPINE1在IDH-WT中高表达,但在IDH-WT突变肿瘤中没有表达(图8E)。最后研究利用激酶文库探索了IDH突变通过磷酸化和激酶活性对细胞内信号传导的影响,结果观察到IDH突变肿瘤中AMPKA和相关激酶的活性明显降低(图8F)。
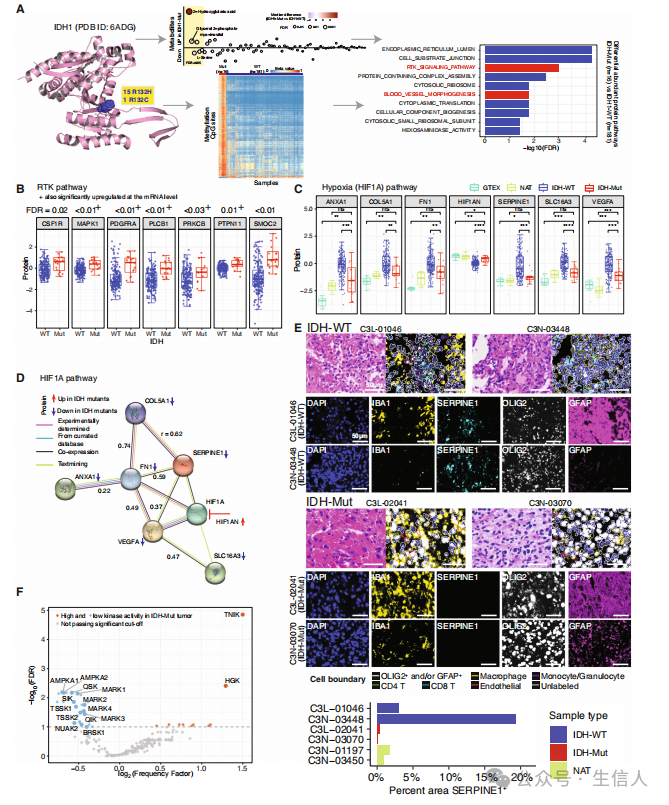 图8 4级IDH突变星形细胞瘤中的异常通路
图8 4级IDH突变星形细胞瘤中的异常通路
到这里文章的主要内容就介绍完了,总结一下, 文章基于多组学数据详细分析了高级别胶质瘤发展过程中的多尺度信号传导网络。该网络展现HGG从分子层面到细胞层面,再到整体组织层面的复杂信号交互,揭示了信号传导如何调控HGG肿瘤的生长和扩散。 文章不仅研究内容丰富,且结果展示条理清晰,是一篇十分值得小伙伴们参考学习的多组学数据整合分析的文章。
链接:http://www.lewenyixue.com/2024/12/16/CANCER%20CELL%EF%BC%9A%E5%A4%9A%E7%BB%84%E5%AD%A6%E8%81%94%E5%90%88%E8%81%9A%E7%84%A6%E8%82%BF/