【CACA周刊】84期 被“绑架”的核糖体——肿瘤的“偷渡”工具
本期看点
序言
前两篇文章中我们已将核糖体的不凡履历以及被肿瘤“劫持”的故事讲了个大概,今天我们继续谈最后一个话题——肿瘤如何利用核糖体“偷渡逃逸”。
近年来免疫疗法在多种肿瘤内取得了耀眼的成绩,但强如免疫检查点抑制剂也有耐药的困扰。
究其原因,免疫检查点抑制剂不过是解除了肿瘤免疫逃逸的一部分“武装”,肿瘤细胞可以通过下调表面呈递的抗原等途径再次逃逸。
一般来说,浸润到肿瘤中的T细胞在攻击肿瘤细胞的同时还会分泌大量细胞因子,就像村委会的大喇叭,督促各家各户提交“犯罪分子”的信息。一方面,细胞因子激活了大部分肿瘤细胞的IFNγ细胞通路,促进了肿瘤特异性抗原的呈递。但另一方面,部分“狡猾”的肿瘤细胞反而因此“打草惊蛇”,将抗原标志藏得更深了。
阐明肿瘤细胞表面抗原下调的具体机制就是解密肿瘤“免疫逃逸”的关键一步。
近年来,特化核糖体的概念逐渐为人们所接受,但仍存在较大争议。既然转录和翻译机制的多样性深入人心,核糖体理论上也应该具有一定的组成复杂性。
核糖体蛋白质的化学计量学变化一直是特化核糖体领域的关注焦点,多项研究已经证明核糖体蛋白质对T细胞的存活和发育、DC细胞的激活和B细胞的激活具有重要作用,表明其在免疫反应的过程中的意义非同小可。免疫核糖体就是一类选择性产生抗原肽段的“假说”核糖体亚群。
在接收到炎性细胞因子如IFNγ/TNFα、IFNα/β、IL-1β、IL-6和IL-17A等的信号后,一种特殊的核糖体蛋白P-stalk就被招募到核糖体中,使得这个核糖体更倾向于翻译与细胞因子反应相关的mRNA例如HLA Ⅰ类和TAP等,加速特定分子向细胞表面的呈递。这种情况下细胞就表现得更“外向”,积极向免疫细胞“展示自我”。而抑炎性细胞因子如IGFβ则会导致P-stalk快速从核糖体上脱落,进而减少抗原在肿瘤表面的呈递,细胞就表现得“内敛”,更容易在免疫细胞的检查下“蒙混过关”。
细胞因子调控只是P-stalk核糖体调控的一种形式,而P-stalk核糖体的减少也只是免疫逃逸的一种方式。关于核糖体如何“被劫持”,我想未来还有更精彩的故事等待被发现。
将肿瘤免疫微环境由“冷”转“热”是当下的科研热点,也是推动免疫疗法更上一层楼的可行策略。肿瘤疫苗、工程细菌、生物材料与纳米递送等策略都在尝试复刻免疫检查点抑制剂的华丽登场。与此同时,针对细胞器如核糖体、线粒体等新兴靶点的抗肿瘤策略亦已整装待发,预示着一场激动人心的科研竞赛即将引领肿瘤免疫治疗新时代。
医术观澜
……
11月18日, Advanced Science :河北医科大学附属第四医院赵群教授、孟令娇教授开发了一种基于转录组学的用于局晚期胃癌早期复发检测的液体活检方法 [1]。
研究者通过转录组学数据分析确定了与局晚期胃癌早期复发相关的四种mRNA生物标志物,分别为AGTR1、DNER、EPHA7和SUSD5。将四种生物标志物与临床特征相结合后的风险分层评估(RSA)有着更高的术后复发预测准确性,在手术和液体活检验证队列中的AUC分别为0.919和0.935。
上述四个生物标志物对应基因的沉默在体外实验中抑制了肿瘤的细胞迁移、侵袭和增殖,在体内实验中抑制了小鼠的肿瘤生长、转移和淋巴管生成,研究者认为可能和cAMP信号通路相关。
该研究为改善复发检测和个性化治疗提供了策略,有助于改善局晚期胃癌患者预后。
药事纵横
……
11月12日, Gut :中山大学肿瘤防治中心团队发现肿瘤微环境中的CAF串扰调控胃癌腹膜转移对免疫检查点抑制剂的响应 [2]。
腹膜转移是胃癌常见的转移形式,胃癌腹膜转移后患者预后差且对常规治疗响应差。近年来免疫检查点抑制剂在胃癌腹膜转移患者中显示出较好的疗效,但仍需要建立明确的患者响应分层策略并阐明耐药机制。
研究者开展了一项Ⅱ期临床研究,纳入胃癌腹膜转移患者,给予信迪利单抗联合化疗治疗。收集患者初始肿瘤、腹膜转移瘤和外周血样本用于单细胞测序来解读肿瘤微环境状态及其对免疫疗法的影响。
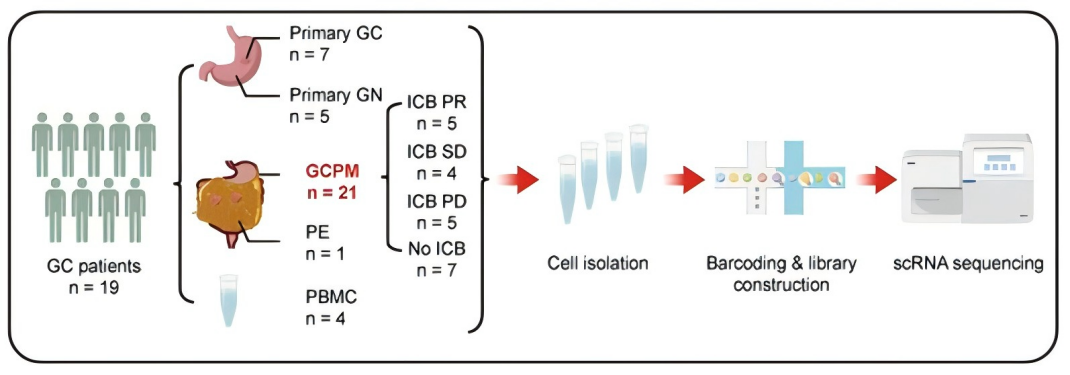
胃癌腹膜转移的微环境与初始胃癌微环境不同,具有特殊免疫抑制特征,由SPP1 +肿瘤相关巨噬细胞和THBS2 +基质CAF组成的基质-髓系龛主导。THBS2 +基质CAF通过补体C3和其受体C3AR1协助招募腹膜特异性组织驻留巨噬细胞,并促进其转化为SPP1 +肿瘤相关巨噬细胞,构成基质-髓系龛。
阻断C3-C3AR1轴则可以破坏基质-髓系串扰,显著促进免疫检查点抑制在体内模型的疗效。
该研究为免疫耐药的胃癌腹膜转移患者提供了全新的细胞组成的分子画像,为克服免疫耐药提供了候选靶点。
高峰科讯
……
1-
11月5日, Advanced Science :中日友好医院冯定庆教授、凌斌教授、梁静教授等指出PIWIL2/PDK1轴通过代谢重编程促进宫颈上皮病变进展以维持肿瘤起始细胞干性 [3]。
当PIWIL2因人乳头瘤病毒感染整合而失去沉默后,细胞将重编程并开始形成肿瘤起始细胞,从而触发宫颈鳞状上皮内病变。肿瘤起始细胞的干性维持和致癌机制目前仍不清楚。
该研究解释了异常的PDK1表达与宫颈鳞状上皮内病变之间的关联。HaCaT细胞系中,PIWIL2或HPV16通过稳定转染宫颈基底上皮细胞和角质细胞诱导PIWIL2表达,进而通过LIN28/let-7轴上调PDK1表达,从而完成代谢重编程并激活糖酵解形成肿瘤起始细胞。
该研究进一步证明了PDK1通过PI3K/AKT/mTOR通路对肿瘤起始细胞的干性维持和肿瘤起始能力的重要性,并揭示了宫颈鳞状上皮内病变进展、消退或复发的机制,为临床治疗提供靶点。
2-
11月6日, Nature :阐明大肠杆菌素驱动的结肠癌需要黏附素介导的上皮结合 [4]。
pks大肠杆菌可以通过大肠杆菌素在宿主上皮细胞中诱导特定的突变特征,但目前尚不清楚高度不稳定的大肠杆菌素分子如何诱导该特征。
该研究使用微生物群依赖性的侵袭性结直肠癌的ZEB2小鼠模型,证明了pks大肠杆菌的致癌能力依赖于菌毛黏附素FimH和FmlH介导的细菌对宿主上皮细胞的黏附。若使用抑制剂阻断细菌黏附可减轻大肠杆菌素介导的致癌效果和结直肠癌进展。FimH的等位基因转换严重影响着pks大肠杆菌的致癌能力,且可以诱导益生菌菌株Nissle1917获得致癌能力。
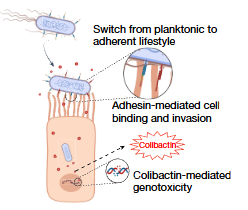
黏附素介导上皮结合后,pks大肠杆菌可在宿主上皮细胞附近产生大肠杆菌素,促进DNA损伤并驱动结直肠癌发育。
该研究为开发抗黏附疗法提供了可靠的靶点,可用于结直肠癌高风险人群的预防以及患者治疗。
3-
11月12日, Cell Death&Disease :上海市第一妇婴保健院康九红教授、郭旭东教授和上海长海医院陈洁教授发现LncRNA MALAT1促进Erastin在HBV感染的弥漫大B细胞淋巴瘤中介导的铁死亡 [5]。
在一项纳入587例中国弥漫大B细胞淋巴瘤(DLBCL)患者的回顾性分析中,13.8%的病例和HBV感染相关,这些病例具有特殊的临床特征和更差的预后。并且,HBV感染对生发中心B细胞(GCB)样DLBCL的生存影响更显著。
该研究发现LncRNA MALAT1在HBV感染的GCB-DLBCL中表达下调,HBV核心蛋白HBX直接抑制了DLBCL细胞的MALAT1表达。在GCB-DLBCL中,HBX过表达削弱了Erastin介导的铁死亡,而MALAT1表达水平恢复重新赋予了HBX过表达DLBCL对铁死亡的敏感性。
通过共同的模体,MALAT1与SFPQ竞争,抑制SLC7A11前体mRNA的有效剪切,阻碍其成熟并因此解除SLC7A11对铁死亡的抑制。
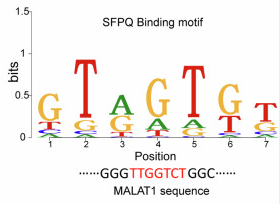
该研究阐明了HBV核心蛋白HBX在减弱GCB-DLBCL对Erastin介导的铁死亡的敏感性中的作用。结合最新研究发现的铁死亡在DLBCL发生和发展中的作用,这些结果解释了MALAT1低表达DLBCL患者预后差的原因,为HBV感染的GCB-DLBCL患者提供了新的靶向位点。
4-
11月15日, Journal of Experimental Medicine :复旦大学生命科学学院于肖飞教授指出,MCRS1增加胰腺癌MHC-Ⅰ的表达,增加T细胞依赖性免疫治疗敏感度 [6]。
抗原呈递减弱使胰腺癌逃逸T细胞介导的抗肿瘤免疫,导致免疫疗法对胰腺癌效果较差。
研究团队通过高通量CRISPR激活扰动,发现转录调节因子MCRS1在体外和体内显著增强了小鼠胰腺癌细胞对T细胞免疫的敏感性。MCRS1与转录因子和基因组织者YY1相互作用,协调增加MHC-Ⅰ基因的染色质可及性和表达水平,进而打破MHC-Ⅰ抑制并激活抗肿瘤T细胞,使得小鼠对抗PD-1疗法敏感。
高MCRS1表达与胰腺癌患者T细胞浸润增加和生存期延长相关,也是预测肺癌患者对抗PD-1疗法疗效的预测因子。
5-
11月20日, Science Translational Medicine :中山大学第一附属医院何伟玲教授、广州大学王雄军教授、中山大学肿瘤防治中心张蔚菁教授、辽宁师范大学李国辉教授合作发文指出NIT2抑制BRD1相分离并抑制氧化磷酸化以增强胃癌的化疗敏感性 [7]。
5-氟尿嘧啶(5-FU)化疗耐药性是胃癌治疗中反应不佳和预后不良的一个重要原因,而目前有效克服这一耐药性的策略相对有限。在此背景下,研究者利用CRISPR-Cas9系统展开研究,并发现腈水解酶家族成员2(NIT2)具有逆转化疗耐药性的能力,且这一过程与其代谢功能无直接关联。
具体而言,研究者观察到,当NIT2被耗竭或表达水平降低时,胃癌细胞系、患者来源的类器官以及异种移植肿瘤中会出现5-FU耐药现象。从机制层面分析,NIT2能够与含溴结构域的蛋白1(BRD1)相互作用,进而抑制HBO1介导的组蛋白H3K14ac位点的乙酰化和影响RELA靶向的氧化磷酸化基因的表达。
在5-FU刺激后,Src激酶会在Y49位点磷酸化NIT2,这一过程促进了NIT2与BRD1的解离,随后NIT2与E3连接酶CCNB1IP1结合,导致NIT2的自噬降解。因此,随着NIT2蛋白的减少,BRD1会形成相分离并与组蛋白H3结合,同时,由于抑制了ING4介导的RELA泛素化,RELA的稳定性得以增强。
此外,研究还发现,NIT2的表达水平与H3K14ac和氧化磷酸化水平呈负相关,而与胃癌患者的化疗反应和预后呈正相关。这些研究结果不仅揭示了NIT2在化疗耐药中的关键作用,还强调了二甲双胍在阻断氧化磷酸化过程中的作用,即当NIT2丢失时,二甲双胍能够增强5-FU的化疗敏感性。
刊后语
大风泱泱,大潮滂滂;大道如砥,医者无疆。
积跬步以至千里,每一期周刊都是恶性肿瘤学科发展的剪影;积小流以成江海,一年周刊浓缩肿瘤领域各科前沿进展的精华!关注CACA周刊,带你领略恶性肿瘤学科发展的四季花开。
CACA周刊,我们下周不见不散!
编辑 | 李瑞源
排版 | 晓晓
审核 | 李瑞源
链接:http://www.lewenyixue.com/2024/12/13/%E3%80%90CACA%E5%91%A8%E5%88%8A%E3%80%9184%E6%9C%9F%20%E8%A2%AB%E2%80%9C%E7%BB%91%E6%9E%B6%E2%80%9D%E7%9A%84%E6%A0%B8%E7%B3%96/






 未来|指南共识|广东省药学会发布《医疗机构药品费用科学管理(DES)专家共识》
未来|指南共识|广东省药学会发布《医疗机构药品费用科学管理(DES)专家共识》
赶快来坐沙发