【论著】外科治疗贲门周围胃肠间质瘤的远期预后分析
引用本文 : 况田, 杨琳希, 汪明, 等. 外科治疗贲门周围胃肠间质瘤的远期预后分析[J]. 中华胃肠外科杂志, 2024, 27(11): 1141-1147. DOI: 10.3760/cma.j.cn441530-20240812-00281.
作者: 况田 杨琳希 汪明 曹晖
作者单位:上海交通大学医学院附属仁济医院普通外科
摘要
目的 探讨外科手术治疗贲门周围胃肠间质瘤( GIST )的远期预后。
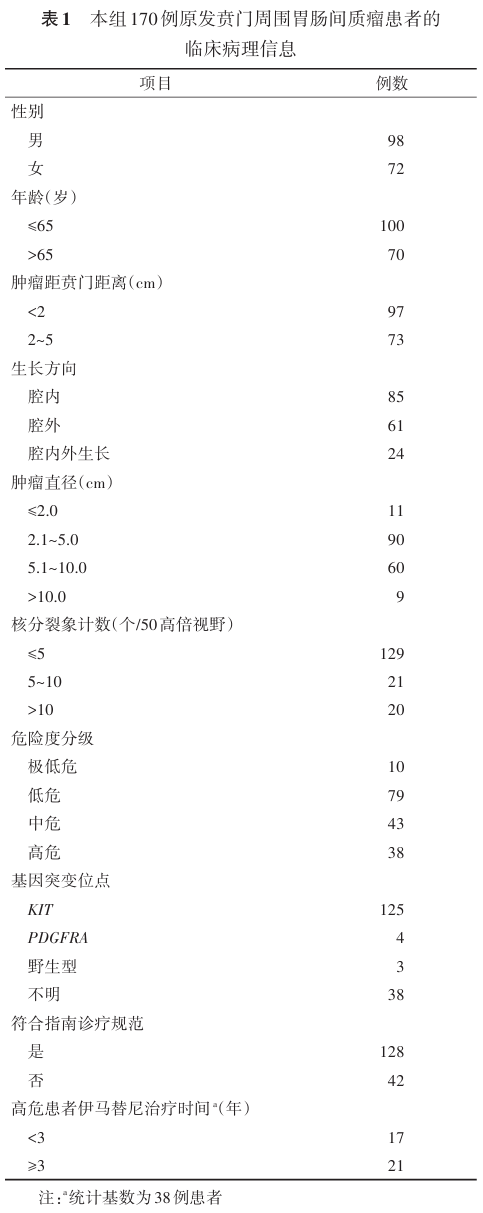
方法 采用回顾性队列研究的方法。总结分析 1998 年 5 月至 2020 年 12 月期间,上海交通大学医学院附属仁济医院接受根治性手术治疗的贲门周围 GIST 的病例资料。入组标准为行根治性手术治疗且病理学证实为原发性胃 GIST 、肿瘤累及贲门或肿瘤边缘至贲门齿状线最小距离 <5 cm 和具有相对完整的临床资料、辅助治疗情况以及随访信息;排除多发 GIST 或其他恶性肿瘤史以及术前或术中发现远处转移或局部侵犯。共计 170 例患者入组。其中男性 98 例( 57.6% ),中位年龄 62 ( 30~85 )岁。肿瘤距贲门距离 <2 cm 者 97 例, 2~5 cm 者 73 例;腔内生长 85 例,腔外生长 61 例,腔内外生长 24 例;肿瘤直径 ≤2.0 cm 、 2.1~5.0 cm 、 5.1~10.0 cm 和 >10.0 cm 者分别为 11 、 90 、 60 和 9 例;核分裂象计数( /50 高倍视野) ≤5 个、 5~10 个和 >10 个者分别为 129 、 21 和 20 例;危险度分级为极低危、低危、中危和高危者分别为 10 、 79 、 43 和 38 例; 128 例符合 “指南”诊疗规范; 38 例高危患者有 21 例伊马替尼治疗时间 ≥3 年。主要观察指标为手术方式及总体生存率( OS )和无病生存率( DFS )。运用 SPSS 28.0 及 R studio 对数据进行整理分析。
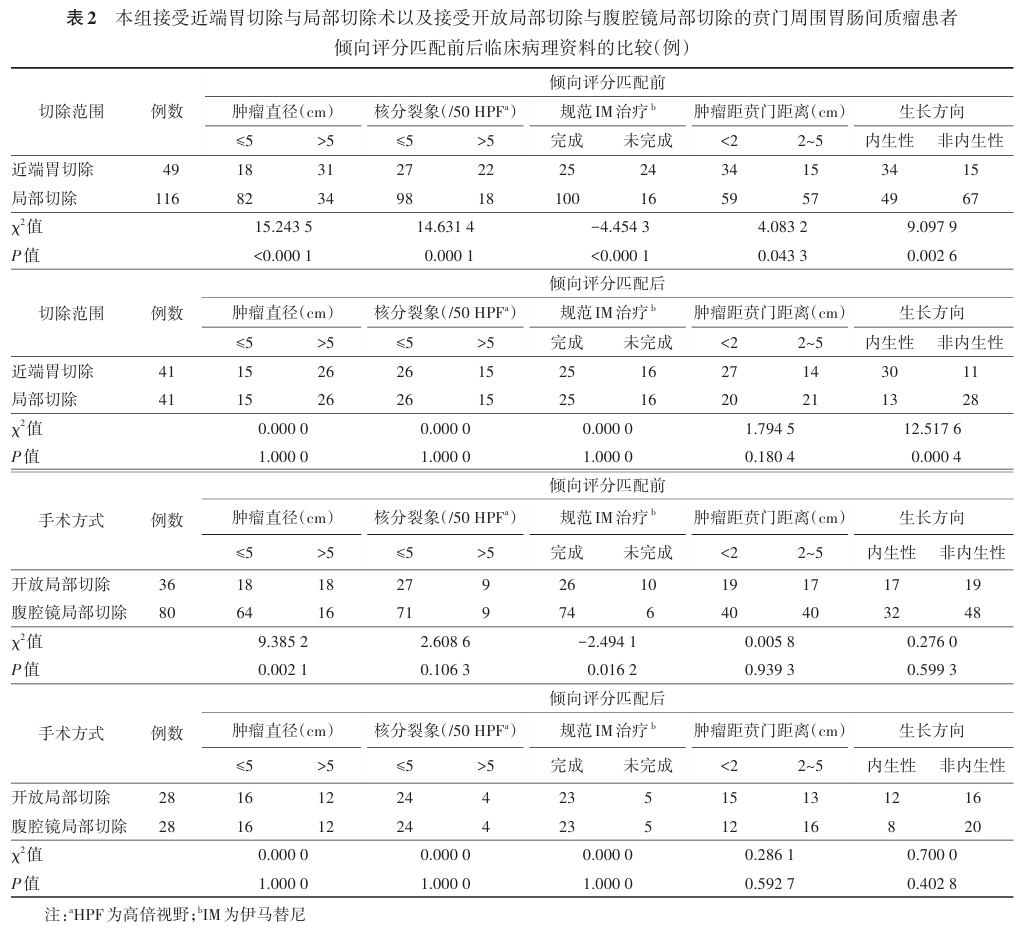
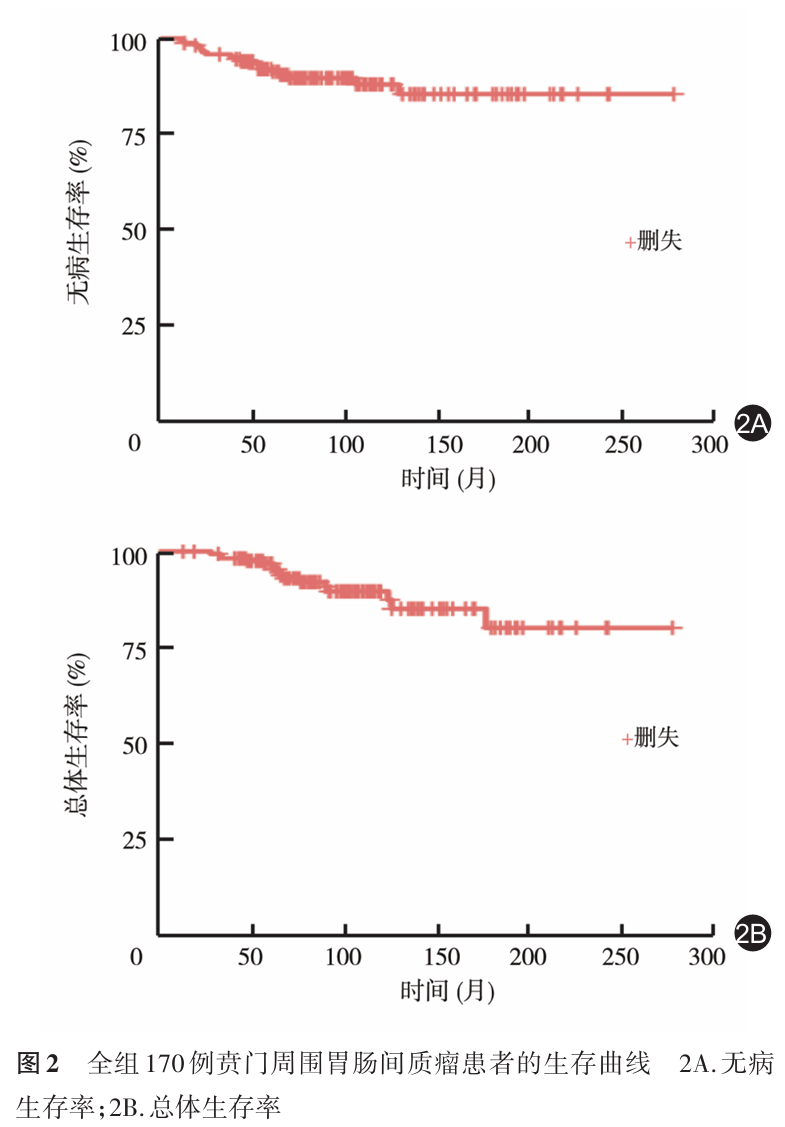
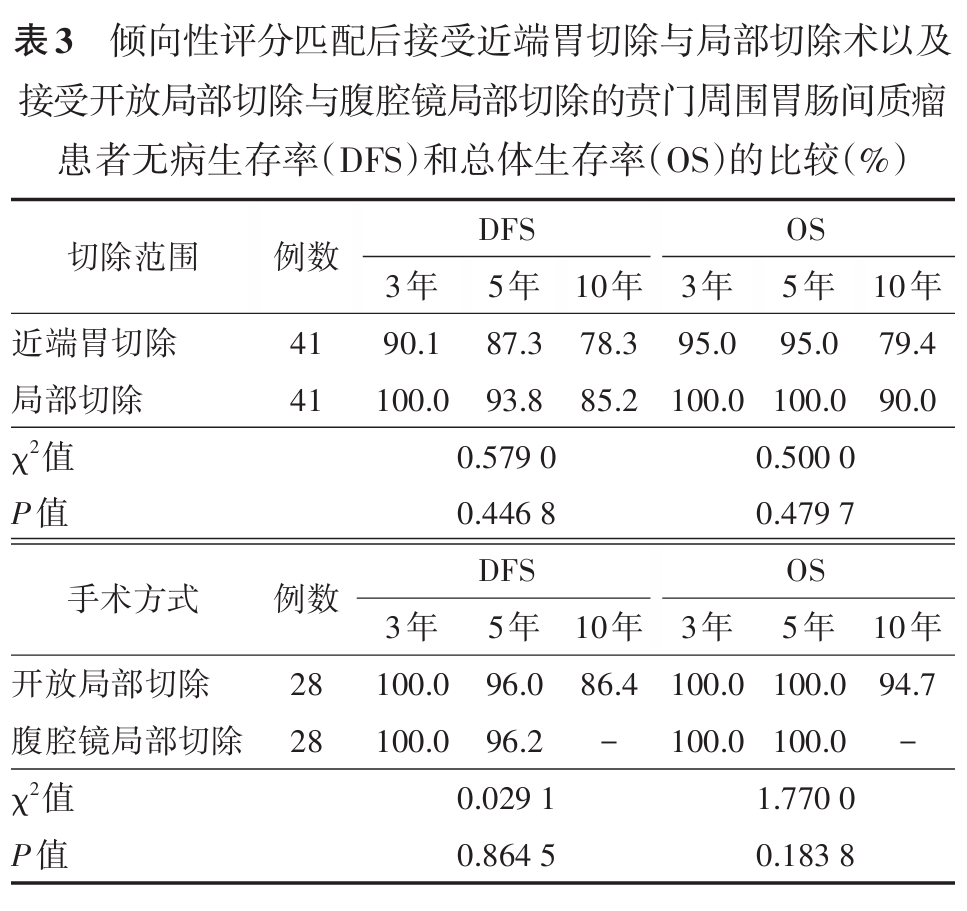
结果 全组开放手术 90 例,其中全胃切除术 5 例,近端胃切除术 49 例,局部切除术 36 例;腹腔镜局部切除术 80 例。中位随访时间 82.5 ( 13~278 )个月。全组 1 、 3 、 5 和 10 年 OS 分别为 100.0% 、 98.2% 、 96.9% 和 89.6% , 1 年、 3 年、 5 年、 10 年 DFS 分别为 99.4% 、 95.9% 、 92.0% 和 88.0% 。在对肿瘤直径、核分裂象、辅助治疗情况、肿瘤距贲门距离和生长方向等因素行倾向性评分匹配后, DFS 和 OS 在接受近端胃切除与局部切除术患者、以及接受开放局部切除与腹腔镜局部切除患者的比较中,其 DFS 和 OS 的差异均无统计学意义(均 P >0.05 )。
结论 外科手术治疗贲门周围 GIST 远期预后较好。贲门周围 GIST 行近端胃切除术和局部切除术,采用腹腔镜或是开放手术,在肿瘤学疗效上相当。
胃肠间质瘤( gastrointestinal stromal tumor , GIST )起源于卡哈尔细胞,是消化道最常见的间叶源性肿瘤,年发病率在 1.2/10 万人 [1] 。约 80% 的 GIST 存在 KIT 或 PDGFRA 激活突变,甲磺酸伊马替尼( imatinib mesylate , IM )等靶向药物的出现极大地改善了 GIST 患者的临床预后,但不同时间段、不同地区 GIST 患者辅助治疗的可及性不一致,一定程度影响了患者的远期预后。对于原发可切除 GIST ,外科治疗仍是治疗方案的首选 [2-3] 。随着外科医生对 GIST 认知的逐步深入,治疗理念的逐步更新,治疗手段的逐步丰富, GIST 已由开放扩大切除转向腹腔镜局部切除,由单纯外科治疗转向多学科协同诊疗。贲门周围 GIST 由于其特殊的解剖位置,在进行外科治疗时,手术方式的选择尤为重要。近端胃切除不可避免地可能在术后出现胃食管反流,而局部切除又可能出现贲门狭窄,因此,外科医生需要结合肿瘤的位置、大小和局部侵犯情况等因素综合考虑手术方式的选择 [4-5] 。但是迄今为止,贲门 GIST 的合理外科治疗策略尚未达成共识。由于贲门周围 GIST 只占全部 GIST 的 8.7%~17.0% ,相关临床研究报道不多 [6-8] 。本研究通过回顾性收集上海交通大学医学院附属仁济医院单中心贲门周围 GIST 的病例数据,对贲门周围 GIST 的外科术式选择及远期预后进行分析,以期为临床外科决策提供参考。
一、研究对象
本研究采用回顾性队列研究方法。
病例纳入标准:( 1 )行根治性手术治疗且病理学证实为原发性胃 GIST ;( 2 )根据手术记录中描述,肿瘤累及贲门或肿瘤边缘至贲门齿状线最小距离 <5 cm ;( 3 )具有相对完整的临床资料、辅助治疗情况以及随访信息。病例排除标准:( 1 )多发 GIST 或其他恶性肿瘤史;( 2 )术前或术中发现远处转移或局部侵犯。
按照上述标准,收集上海交通大学医学院附属仁济医院自 1998 年 5 月至 2020 年 12 月期间 GIST 患者临床病理资料及预后信息。本研究共入组 170 例行根治性切除的原发性贲门周围 GIST 患者,其中男性 98 例( 57.6% ),中位年龄 62 ( 30~85 )岁。患者的临床病理特征见表 1 。本研究通过医院医学伦理委员会审批(批号: LY2024 - 220 - B )。
二、观察指标和评价标准
1. 观察指标:( 1 )肿瘤情况:肿瘤部位、肿瘤距离齿状线最小距离、肿瘤大体生长方式、肿瘤直径、核分裂象、改良美国国立卫生研究院( National Institutes of Health , NIH )危险度分级( 2008 版) [9] 、免疫组织化学检测特征和基因检测情况;( 2 )治疗情况:辅助治疗方案是否符合完成指南推荐(伊马替尼)规范治疗情况和手术治疗方式;( 3 )随访及其预后情况:电话或门诊随访;随访截止时间为 2024 年 6 月 15 日。预后主要了解总体生存率( overall survival , OS )和无病生存率( disease - free survival , DFS )。
2. 评价标准:辅助治疗符合指南规范定义为:依据改良 NIH 分级,低危患者随访或辅助治疗,中危患者辅助治疗满 1 年,高危患者辅助治疗满 3 年 [10] 。 OS 定义为自初次诊断为 GIST 至末次随访日或死亡的时间; DFS 定义为原发 GIST 患者自手术治疗日为起点,至临床诊断复发转移或末次随访日为终点的时间。
三、统计学方法
应用 SPSS 28.0 软件和 R studio 进行数据分析。计数资料以例( % )表示,组间比较 χ 2 检验。计量资料以中位数(范围)表示。 Kaplan Meier 法绘制生存曲线, Log Rank 检验进行生存分析。倾向性评分匹配采用 R 语言 MatchIt 包完成,组间差异分析采用 χ 2 检验。 P <0.05 认为差异具有统计学意义。
一、本组病例的手术方式
本组患者的手术方式包括开放全胃切除术 5 例( 2.9% ),开放近端胃切除术 49 例( 28.8% ),开放局部切除术 36 例( 21.2% ),腹腔镜局部切除术 80 例( 47.1% )。手术方式和手术例数的变化趋势见图 1A 和图 1B 。将近端胃切除术(开放) 49 例与局部切除术(开放 + 腹腔镜) 116 例患者的临床病理资料、以及 36 例开放局部切除术与 80 例腹腔镜局部切除术患者的临床病理资料作倾向评分匹配分析,详见表 2 。
二、预后情况
全组中位随访时间为 82.5 ( 13~278 )个月,随访期间有 18 例患者( 10.6% )发生远处转移(肝脏转移 10 例,腹腔播散 8 例),其中 16 例( 9.4% )患者死亡。本组患者术后 1 、 3 、 5 和 10 年 DFS 分别为 99.4% 、 95.9% 、 92.0% 和 88.0% ; OS 则分别为 100.0% 、 98.2% 、 96.9% 和 89.6% ,见图 2 。接受近端胃切除与局部切除术、以及接受开放局部切除与腹腔镜局部切除的贲门周围 GIST 患者倾向评分匹配后的 DFS 和 OS 见表 3 。
IM 等靶向药物的出现极大改善了 GIST 的生存预后,使 GIST 的治疗模式由单纯外科切除转向多学科诊疗。尽管靶向药物可以改善预后,但外科治疗仍是 GIST 治疗的基础。 GIST 局部浸润少,对于原发可切除 GIST 手术原则为局部 R 0 切除(手术切缘阴性);淋巴结转移率低,无需常规行淋巴结清扫,明确的 SDH 基因缺陷型 GIST 或易位相关 GIST 需要切除病理性肿大淋巴结 [3] 。由于贲门周围 GIST 的特殊解剖部位,手术方式选择尚没有明确结论。近端胃切除术与局部切除术相比,可以在完整切除肿瘤保证足够切缘的同时规避术后贲门狭窄的风险,但会增加术后胃食管反流的可能,对患者的生活质量有一定影响 [11] 。多项研究表明, GIST 行 R 1 切除(显微镜下切缘阳性)相对 R 0 切除,排除肿瘤破裂后,无论是否行辅助治疗,远期预后如 DFS 或 OS 均无差异,且术后辅助治疗可以基本消除 R 1 引起的 DFS 降低,无需再次手术 [12-15] 。近年来,随着国产药物上市和 IM 进入医保支付范围,辅助治疗可及性逐渐提高,为 R 1 切除的患者提供二次手术以外的治疗选择。治疗理念的转变推动贲门周围 GIST 手术方式由近端胃切除术转向局部切除术。
Lukaszczyk 和 Preletz [16] 于 1992 年完成第一例胃 GIST 的腹腔镜切除,由于术后恢复周期短、并发症少,近年来腹腔镜手术已经成为 GIST 手术的主流选择。然而,由于贲门周围 GIST 的特殊位置,在指南中腹腔镜手术仍不作为推荐方式 [2-3] 。有多中心研究表明,腹腔镜局部切除术在食管胃结合部 GIST 术后并发症的发生率较开放手术低 [17] 。但也有报道显示,腹腔镜手术在累及贲门的 GIST 中复发和吻合口漏比例升高,手术的安全性受到质疑 [18] 。在本组数据中,有 116 例贲门周围 GIST 局部切除术病例,其中腹腔镜局部切除 80 例,说明随着外科医生手术技能熟练程度的上升,贲门周围 GIST 也可以安全地进行腹腔镜手术。从本研究中的腹腔镜手术的发展趋势看,随着时间的推移,贲门周围 GIST 开展腹腔镜手术的比例在逐年提升。目前由本中心牵头开展的 CLASS - 06 是全国 10 余家 GIST 大型诊疗中心共同开展的前瞻性临床研究,探索包含贲门周围 GIST 的非适宜解剖部位胃 GIST 的腹腔镜手术安全性研究,或许能在腹腔镜用于贲门 GIST 的安全性方面给出更多证据。
日本的一项多中心研究显示,腹腔镜 - 内镜联合手术在胃 GIST 中的可及性和有效性,该队列中包含 17 例食管胃结合部 GIST ,随访期间无复发或转移 [19] 。内镜下直接切除 GIST 也是选择之一,食管胃结合部 GIST 内镜下切除的远期预后与外科手术相当 [5] 。
IM 术前治疗是提高贲门周围 GIST 保功能手术率的重要研究方向。本研究收集数据过程中,发现部分来源于贲门周围的 GIST 在本身肿瘤较大的前提下,接受了术前的 IM 治疗。对于局部进展或直径 >10 cm 的胃 GIST ,行 IM 术前治疗有助于缩小肿瘤,减少手术范围,促进胃功能的保留 [20-21] 。但需要注意的是,由于 GIST 对 IM 治疗反应的差异,仍有部分贲门周围 GIST ,即便是接受了术前足量、足疗程的 IM 治疗,肿瘤退缩达到平台期,仍无法避免近端胃、或者是联合脏器的切除。
综上,本文通过回顾性分析数十年来本中心就诊并行根治性手术的贲门周围 GIST 患者临床资料和随访信息,发现贲门周围 GIST 行近端胃切除术或局部切除术在术后 DFS 和 OS 方面差异无统计学意义(均 P >0.05 ),我们认为,对于贲门周围 GIST ,在有经验的中心行腹腔镜下部分切除术是安全有效的。但本研究仍存在一些局限性:首先,本研究为回顾性研究,数据偏倚在所难免;其次,本研究未涉及不同手术方式的术后短期并发症,而这些并发症对远期预后也有一定的影响;再次,由于本研究为单中心研究,样本量较少,辅助治疗的可及性以及手术方式选择具有一定的地域性,这也影响了结论的可推广性。未来有必要建立全国性的单病种数据库,为研究者提供更全面的数据支持,并为临床医生提供更有力的循证医学证据。
利益冲突 所有作者均声明不存在利益冲突
作者贡献声明 况田负责实施研究、采集数据、分析解释数据、起草文章;杨琳希负责酝酿和设计实验、对文章的知识性内容作批评性审阅、统计分析;汪明负责酝酿和设计实验、对文章的知识性内容作批评性审阅、指导;曹晖负责酝酿和设计实验、对文章的知识性内容作批评性审阅、获取研究经费、指导、支持性贡献
滑动阅读参考文献
链接:http://www.lewenyixue.com/2024/12/11/%E3%80%90%E8%AE%BA%E8%91%97%E3%80%91%E5%A4%96%E7%A7%91%E6%B2%BB%E7%96%97%E8%B4%B2%E9%97%A8%E5%91%A8%E5%9B%B4%E8%83%83%E8%82%A0%E9%97%B4%E8%B4%A8%E7%98%A4%E7%9A%84%E8%BF%9C%E6%9C%9F/






赶快来坐沙发