CAR-T治疗T细胞血液肿瘤的挑战和解决策略
T细胞急性淋巴细胞白血病和外周T细胞淋巴瘤是常见的T细胞血液肿瘤, 复发/难治性T细胞恶性肿瘤具有高异质性和不良预后。CAR-T细胞疗法在治疗B细胞源性恶性肿瘤中显示出显著的安全性和有效性,但在治疗T细胞恶性肿瘤有局限性较大,如自相残杀、T细胞发育不全、肿瘤污染等,主要是因为正常T细胞与恶性T细胞的相似性而缺乏明确的恶性T抗原。CAR靶向抗原可分为泛T抗原和限制性T抗原,两者各有优缺点;泛T抗原CAR-T细胞(如CD5和CD7靶点)是临床试验中应用最广泛的CAR-T细胞,几乎可以覆盖所有T细胞来源的恶性细胞,但也可以诱导CAR-T细胞和正常T细胞的严重杀伤。与自体来源的CAR-T细胞相比,异体CAR-T细胞可以防止肿瘤污染,并通过基因编辑成为通用产品,然而这些CAR-T细胞都不能完全预防靶向T细胞CAR-T细胞治疗后的免疫缺陷和疾病复发。
浙江大学医学院附属第一医院学者近日于《Experimental Hematology & Oncology》综述,总结了目前CAR-T细胞治疗T细胞恶性肿瘤的挑战以及解决这些局限性的潜在策略,通讯作者为黄河教授和胡永仙教授。现整理主要内容供参考。
CAR-T细胞治疗T细胞恶性肿瘤的当前挑战
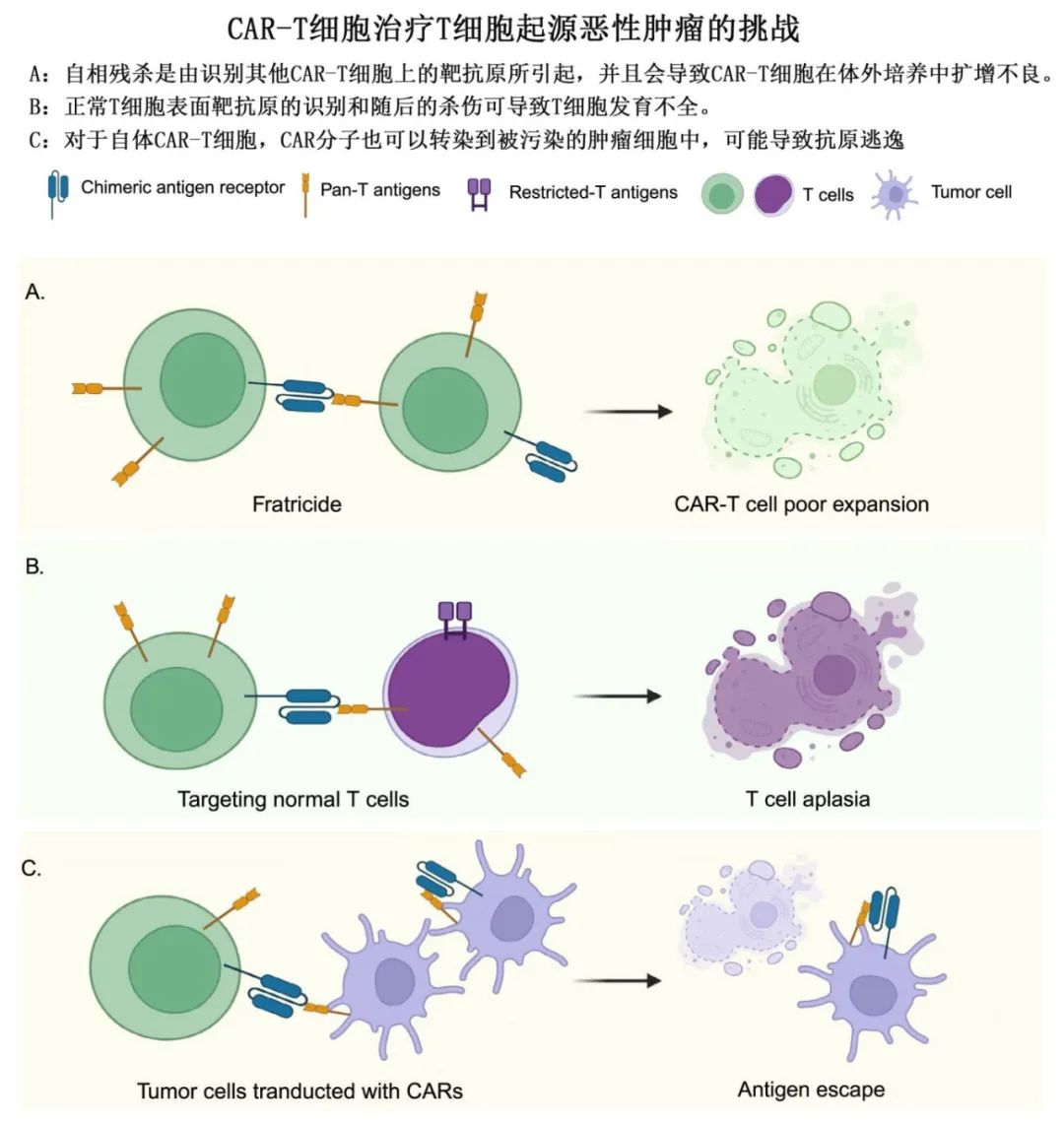
针对T细胞源性恶性肿瘤的理想CAR-T细胞靶抗原应在所有恶性T细胞表面高度表达,但在正常组织上不表达。然而T细胞恶性肿瘤通常异质性较强,所有肿瘤细胞中都存在最佳抗原的情况极为罕见。此外,如果CAR-T细胞与正常T细胞具有相同的抗原,就会识别并消灭所有三种类型的细胞:恶性T细胞、其他CAR-T细胞和正常T细胞。
CAR-T细胞之间的杀伤也被称为自相残杀,可能导致CAR-T细胞在体内扩增、持续和抗肿瘤效果差。CAR-T细胞输注引起的T细胞发育不全目前尚无有效的治疗方法,并可能增加患者生命危险的机会性感染。由于恶性T细胞通常存在于T-ALL患者和部分T细胞淋巴瘤(TCL)患者的外周血中,并且与正常T细胞具有相同的表面抗原,因此完全有可能收集恶性T细胞进行CAR转导。因此CAR-T细胞可能被恶性T细胞污染,导致CAR-T细胞治疗过程中的抗原逃逸。
T细胞恶性肿瘤的潜在靶抗原
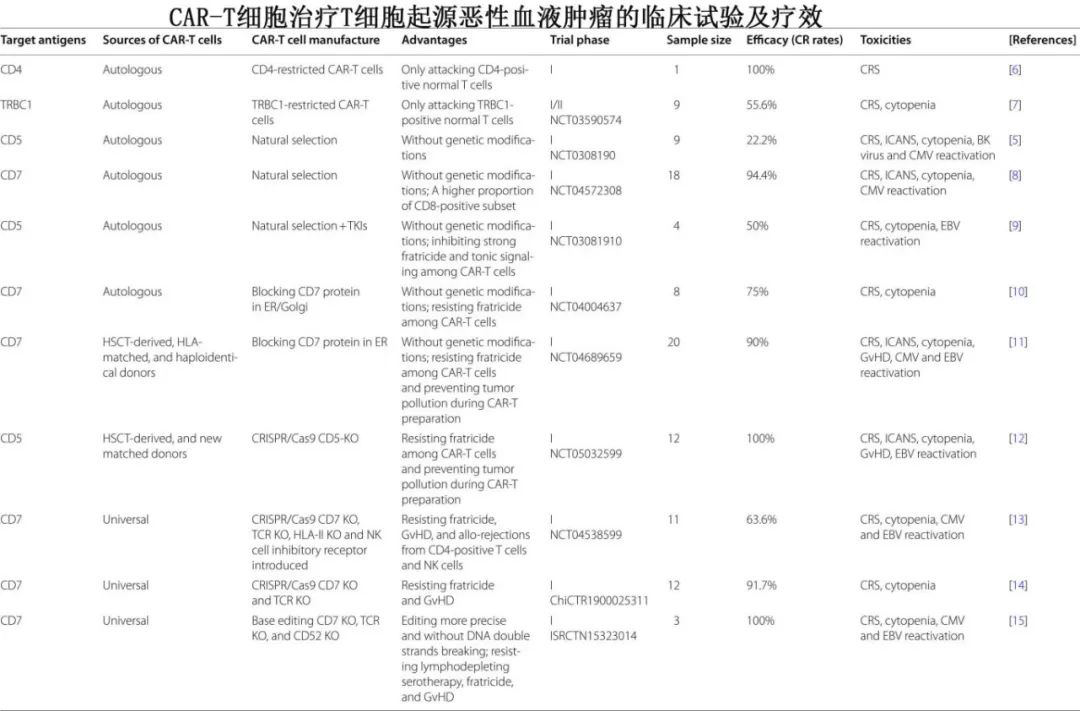
T细胞恶性肿瘤的靶抗原可分为覆盖所有T细胞的抗原和局限于T细胞亚群的抗原。
泛T抗原CAR-T细胞(如CD5和CD7靶点)是临床试验中应用最广泛的CAR-T细胞,几乎可以覆盖所有T细胞来源的恶性细胞,但也可以诱导CAR-T细胞和正常T细胞的严重杀伤。CAR-T细胞的自相残杀作用和on-target off-tumor作用可导致CAR-T细胞在治疗过程中持续时间有限和重度T细胞发育不全,最终影响CAR-T细胞的疗效。有多种新兴技术可以避免自相残杀和T细胞发育不全,例如基因编辑、蛋白保留、瞬时CAR表达技术和安全开关,但需要全面的临床试验来评估每种技术的可行性和安全性。
局限于特定T细胞亚群的抗原(例如CD4、TRBC1、TRBC2、CD1a、CD30、CD37、CD21、CCR4和CCR9,正处于临床前和临床研究阶段)可以部分避免严重的自相残杀和T细胞发育不全,但目前关于限制性抗原CAR-T细胞的研究很少,此外必须谨慎筛选合适的肿瘤类型。此外,对每例打算接受CAR-T细胞治疗的患者进行抗原筛查有助于识别最佳抗原。
自体和异基因CAR-T用于T细胞肿瘤
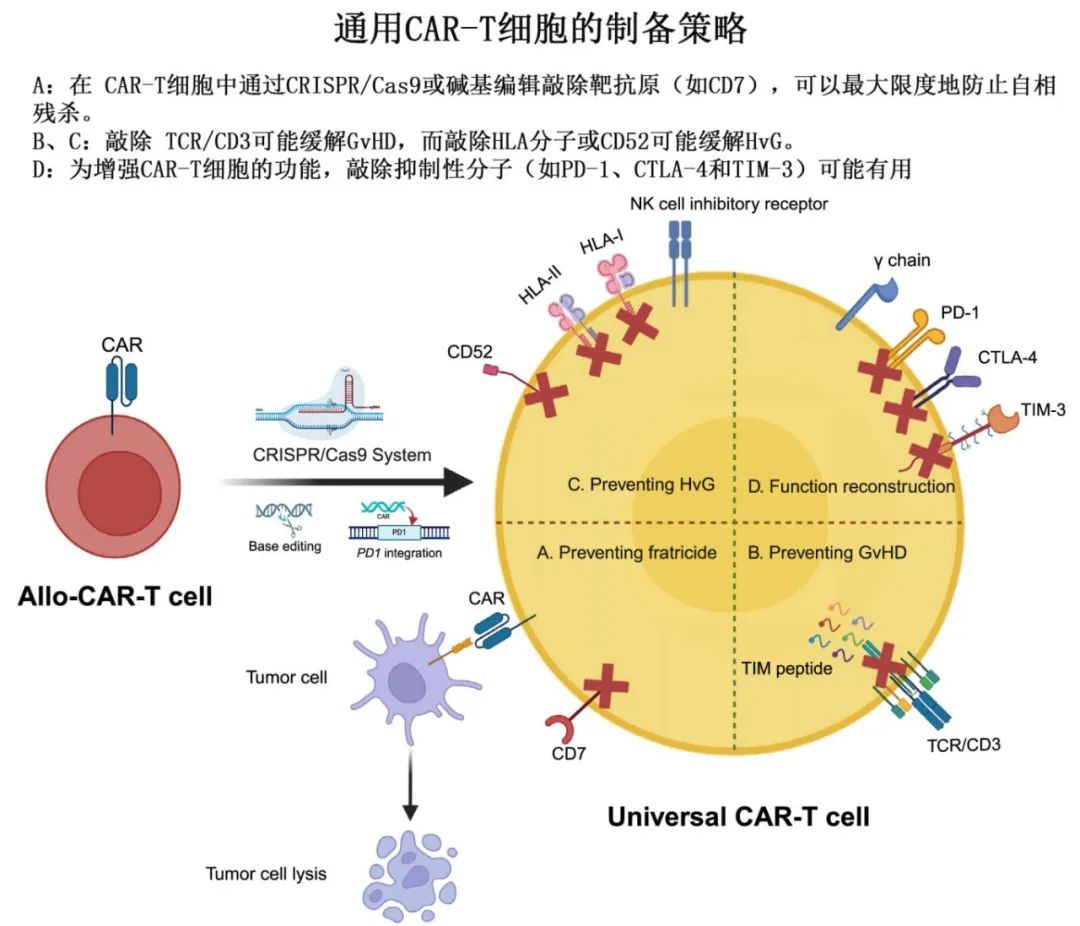
CAR-T细胞的另一种分类包括自体和异基因CAR-T细胞。自体T细胞没有GvHD或排斥反应,但肿瘤污染是主要问题。相比之下,异基因CAR-T细胞具有高纯度、高质量和无肿瘤污染,但异基因过继输注存在局限性包括GvHD和异基因排斥反应。一般来说,异基因CAR-T细胞可以分为四种类型:HSCT供者细胞(来自以前的HSCT供者的细胞)、人类白细胞抗原(HLA)全相合供者细胞(来自HLA全相合供者的细胞)、单倍体相合供者细胞(来自单倍相合供者的细胞)和通用细胞(来自非亲缘、健康供者的细胞)。鉴于无GvHD和毒性较小,自体CAR-T细胞可能更推荐用于低肿瘤负荷患者。需要更多的临床研究来分析自体和异异基因CAR-T细胞的优缺点,以帮助临床医生在未来不同的临床情况下进行选择。
尽管基因编辑的通用CAR-T细胞可以解决肿瘤污染、GvHD和异基因移植排斥等问题,但与CRISPR/Cas9系统相关的遗传毒性风险也不应被忽视。碱基编辑是一种更安全的编辑工具,因为它不依赖于双链DNA断裂,可以成为逃避遗传毒性的理想基因编辑手段。对于通用CAR-T细胞来说,体内持久性仍存在挑战。通用CD7 CAR-T细胞治疗后恢复的CD7阴性T细胞可以抵抗CAR-T细胞的杀伤,并在CAR-T细胞的异异基因排斥中发挥作用,可能是通用CD7 CAR-T细胞在体内存活时间短的原因。期望将来有更多的方法来延长通用CAR-T细胞在T细胞来源的恶性肿瘤中的体内持久性,以获得更好的临床结局。
CAR-T治疗T细胞肿瘤的并发症
CAR-T治疗T细胞肿瘤后的主要并发症包括CRS、ICANS、移植物抗宿主病、插入突变、第二肿瘤,部分并发症是靶向T 细胞CAR-T细胞治疗所特有的,如T细胞发育不全(aplasia)引起的机会性感染(如EBV和CMV再激活)、骨髓抑制引起的持续性血细胞减少、靶抗原阴性复发(如CD7阴性复发)。
T细胞发育不全是治疗T细胞源性恶性肿瘤的主要挑战,可导致不受控制的机会性感染并威胁到患者生命。CD7阴性T细胞的起源和功能尚不清楚,应进一步探索CD7缺失的T细胞(特别是CD7 CAR-T细胞治疗后新出现的CD7阴性T细胞)是否仍然对机会性感染具有抵抗力,或者如何提高这类T细胞的功能,以提高患者生存。
治疗抗原阴性复发的策略包括改变CAR-T抗原、双靶点CAR-T、桥接移植巩固;桥接移植方面,作者团队开发了一种新的策略,将CD7 CAR-T治疗序贯单倍体HSCT,不进行GvHD预防,为不适合异基因移植的CD7阳性恶性肿瘤患者提供了一种替代方法。整体而言,还没有有效的策略来预防或治疗疾病复发,特别是抗原阴性复发,对靶向T细胞CAR-T治疗后复发机制的深入探索可能有助于解决该问题。
参考文献
Zheng, H., Zhao, H., Han, S. et al. Chimeric antigen receptor-T cell therapy for T cell-derived hematological malignancies. Exp Hematol Oncol 13, 117 (2024). https://doi.org/10.1186/s40164-024-00584-6
链接:http://www.lewenyixue.com/2024/12/10/CAR-T%E6%B2%BB%E7%96%97T%E7%BB%86%E8%83%9E%E8%A1%80%E6%B6%B2%E8%82%BF%E7%98%A4%E7%9A%84%E6%8C%91%E6%88%98%E5%92%8C%E8%A7%A3%E5%86%B3/







 知道|国家药品不良反应监测年度报告(2024年)
知道|国家药品不良反应监测年度报告(2024年)
赶快来坐沙发