J Hepatol | 空军军医大学研究揭示:肝细胞癌TME中肿瘤相关内皮细胞的免疫抵抗机制
【CMT&CHTV 医学前沿·临床经典】
导语: 近期,一项发表在 Journal of Hepatology 上的研究揭示了CXCL12阳性肿瘤相关内皮细胞(TECs)在肝细胞癌(HCC)免疫逃逸中的关键作用,为肝癌的免疫治疗提供了新的视角。
肝细胞癌(HCC)作为全球范围内致死率较高的恶性肿瘤之一,其治疗手段有限,尤其是对于晚期HCC患者,免疫检查点抑制剂(ICIs)的单药应答率仅为15%至20%。低响应率可能与肿瘤微环境(TME)的异质性、病理生理和分子机制有关。既往研究表明,PD-L1表达或肿瘤突变负荷与PD1/PD-L1阻断疗法的响应相关,但这些指标并不足以预测晚期HCC的疗效。肿瘤相关内皮细胞(TECs)作为TME的关键组成部分,通过多种机制调节免疫细胞活性和分布,而影响肿瘤的免疫反应。
2024年9月,空军军医大学高源、张英起、张红梅及张存等在 Journal of Hepatology 发表了题为“CXCL12+ Tumor-associated Endothelial Cells Promote Immune Resistance in Hepatocellular Carcinoma”的研究文章,深入探究了HCC中TME的新机制,其中CXCL12阳性TECs在免疫逃逸和免疫治疗抵抗中扮演了关键角色。
01
▼
研究设计
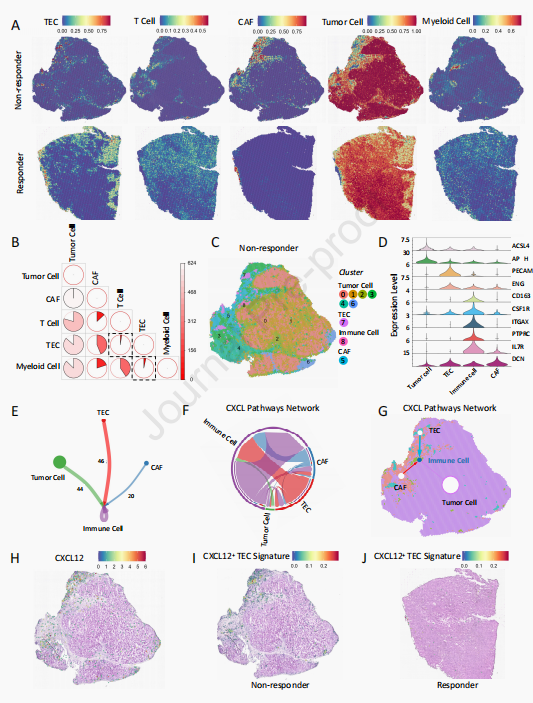
本研究采用多组学分析策略,通过单细胞和时空转录组分析,探索HCC肿瘤微环境中TECs的异质性及其在不同治疗响应程度下的单细胞和时空分布模式。研究纳入了一组接受抗PD-1治疗的HCC患者队列,通过分析临床队列探索TEC亚群与免疫治疗结果之间的相关性。通过体外和体内研究综合验证TEC亚群对免疫微环境的影响,并利用TEC亚群特异性敲除小鼠模型以及人源化小鼠模型进一步探索不同TEC亚群在微环境调节中的机制及其对免疫疗法的影响。
02
▼
研究结果
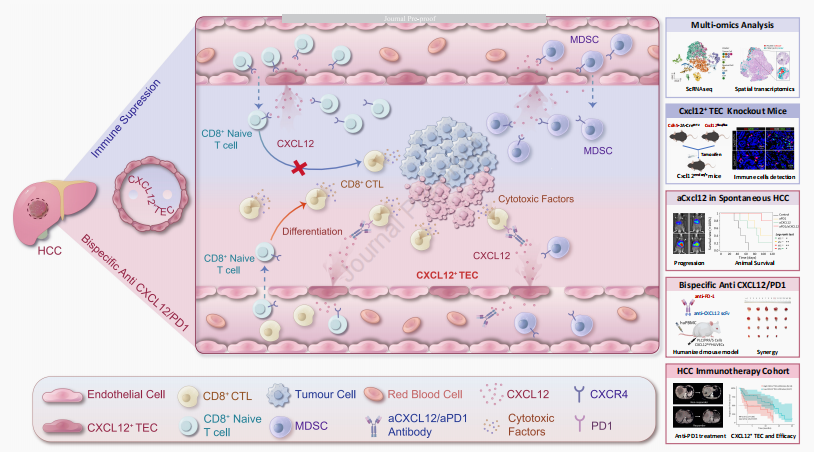
研究中发现CXCL12+ TECs这一新的TEC亚群在HCC TME中的免疫抑制中起着关键作用。功能上,CXCL12+ TECs通过分泌CXCL12阻碍CD8 + naïve T细胞向CD8 + cytotoxic T细胞的分化,并吸引骨髓源抑制细胞(MDSCs)。研究还验证了一种针对CXCL12和PD1的双特异性抗体,显示出了增强抗肿瘤免疫反应和推进HCC治疗的显著潜力。研究结果表明,CXCL12+ TECs在HCC微环境中介导免疫抑制,针对CXCL12 + TECs的治疗有望增强HCC患者的免疫疗法效果。
CXCL12 +TECs的免疫抑制作用
本研究发现,在HCC的肿瘤微环境中存在一个新的TEC亚群——CXCL12 + TECs,它们在免疫抑制中扮演着重要角色。具体来说,CXCL12 + TECs通过分泌CXCL12干扰CD8 + naïve T细胞向CD8 + cytotoxic T细胞的分化过程(图1K-L)。这一发现揭示了CXCL12 + TECs在HCC免疫逃逸中的潜在机制,为后续的免疫治疗提供了新的靶点。
图1 TECsp亚群通过CXCL12-CXCR4信号通路影响HCC免疫微环境
图2 CXCL12 + TECs阻碍CD8 + 幼稚T细胞分化进程,使HCC内CD8 + 细胞毒性T细胞浸润显著减少
CXCL12 +TECs对MDSCs的吸引作用
研究进一步发现,CXCL12 + TECs能够吸引MDSCs,这是一种在肿瘤微环境中起到免疫抑制作用的细胞群体。通过分析CXCL12 + TECs与免疫细胞之间的相互作用,研究团队发现CXCL12-CXCR4信号通路在这一过程中起到了关键作用,这为未来的治疗策略提供了新的思路。
双特异性抗体的治疗效果
研究中开发的针对CXCL12和PD1的双特异性抗体,在增强抗肿瘤免疫反应方面显示出显著的潜力。在人源化小鼠HCC模型中,这种双特异性抗体能够有效抑制肿瘤生长,并且相比于单一疗法,联合疗法能够更有效地提高生存率(图6)。这一结果表明,双特异性抗体可能成为一种新的有效的HCC治疗手段。
临床队列中CXCL12+ TECs的相关性分析
在对接受抗PD-1治疗的HCC患者进行的临床队列研究中,发现CXCL12 + TECs的高浸润与治疗的不良预后相关(图8)。具体来说,CXCL12 + TECs高表达的患者组中,疾病进展的比例更高,而部分缓解的比例更低。此外,Kaplan-Meier生存分析显示,CXCL12 + TECs高表达的患者组进展自由生存期更短(图8G),这强调了CXCL12 + TECs作为预后生物标志物的潜力。
03
▼
总结讨论
研究揭示了HCC TME中CXCL12 + TECs作为免疫抑制的关键调节,这一发现推进了我们对HCC与免疫调节之间相互作用的理解。此外,针对CXCL12和PD1的双特异性抗体的开发和应用,已在人源化小鼠HCC模型中证明能够增强免疫反应。研究还指出,CXCL12 + TECs的高浸润与抗PD-1治疗的不良结果相关,为未来的临床治疗提供了重要的生物标志物。
参考文献
LU Y, LIU Y, ZUO X, et al. CXCL12+ Tumor-associated Endothelial Cells Promote Immune Resistance in Hepatocellular Carcinoma. J Hepatol. Published online October 9, 2024. DOI:10.1016/j.jhep.2024.09.044.
编辑:耳东
二审:且行
三审:清扬
排版:半夏
封面图源:Pexels
链接:http://www.lewenyixue.com/2024/12/09/J%20Hepatol%20%7C%20%E7%A9%BA%E5%86%9B%E5%86%9B%E5%8C%BB%E5%A4%A7%E5%AD%A6%E7%A0%94%E7%A9%B6/






 知道|国家药品不良反应监测年度报告(2024年)
知道|国家药品不良反应监测年度报告(2024年)
赶快来坐沙发