ecDNA驱动肿瘤进展—Nature热点又来炸火花啦!

研究结果:
这篇文章分析了来自4,170份晚期癌症样本的WGS数据集,确定了ecDNA在进展性肿瘤中的发生率。
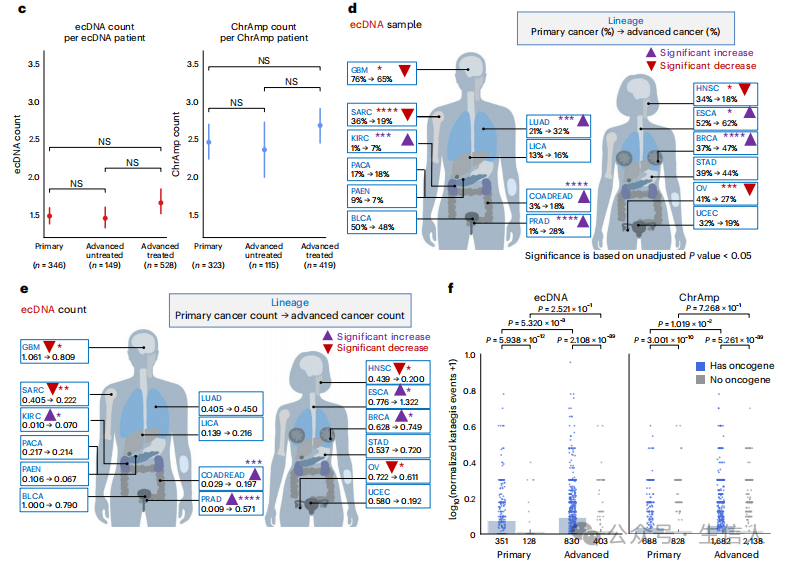
研究人员对8000多例新诊断的原发性癌症、未经治疗的转移性肿瘤以及经过大量预处理的肿瘤样本进行了检测。 与新诊断的癌症相比,未经治疗的转移性和预处理肿瘤中ecDNA的检出频率竟然显著升高! 并通过AmpliconSuite成功检测到了局部扩增的基因组位点,并重建了扩增子的结构。结果显示,在8060个肿瘤样本中,他们找到了2602个ecDNA扩增子和8594个染色体扩增(ChrAmp)扩增子。作者证实,在原发癌症队列中,胶质母细胞瘤、食管癌和膀胱癌中含有ecDNA扩增子的样本频率很高。在晚期癌症队列透明细胞肾癌、食管癌、结直肠癌、前列腺癌和乳腺癌中,ecDNA样本的比例和每个样本的平均ecDNA数量显著增加。结果表明,ecDNA和染色体扩增子的驱动作用可能因肿瘤谱系而异。同时作者证实,在原发性癌症肿瘤中, 局部高突变(kataegis)经常同时出现在ecDNA和ChrAmp扩增子上。
ecDNA在癌症中的临床关联
在最新诊断的肿瘤病例中,ecDNA扩增子的存在,往往预示着患者的预后可能不甚乐观。且研究过程中充分考虑了肿瘤部位、性别、年龄、全基因组加倍状态、微卫星不稳定状态等多种变量因素。结果显示,ecDNA的存在确实显著增加了癌症风险!
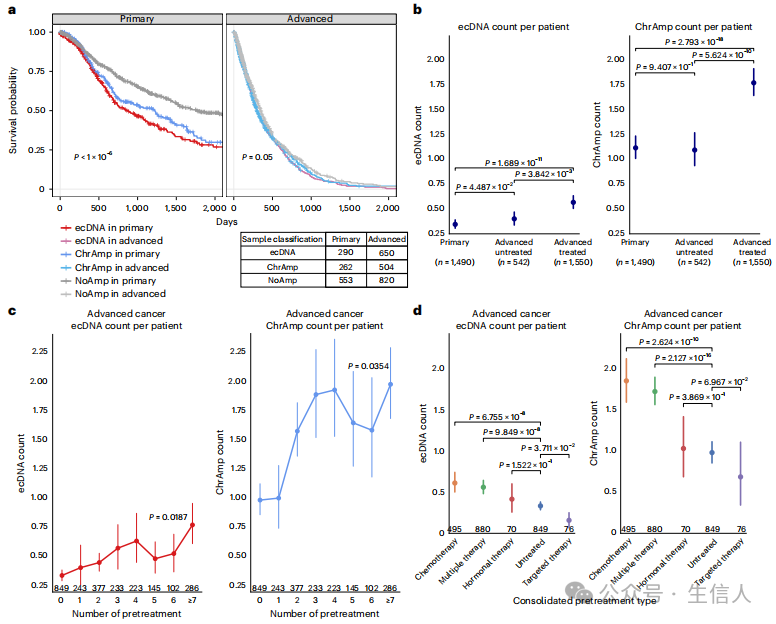 图 2
图 2 此外如果 按 治疗类别分组表明, 化疗与ecDNA频率的相关性最强 ,特别是对于那些历经多次治疗或化疗的患者而言,ecDNA的数量更是急剧上升。然而, 接受靶向治疗的患者的肿瘤含有更少的ecDNA ,这或许是因为靶向治疗能够精准地“瞄准”并“打击”ecDNA上携带的致癌基因,从而有效降低了ecDNA的负荷。那么,不同类型的化疗药物对于ecDNA数量的影响又是如何呢?将化疗药物分为三种抗代谢物、DNA损伤剂和微管蛋白抑制剂。进一步的研究发现, 使用微管蛋白抑制剂的患者,其体内ecDNA的数量显著增多。 这可能暗示着,这种化疗药物在一定程度上加剧了基因组的不稳定性,从而促使更多的扩增子“涌现”出来。
更神奇的是,ecDNA在肿瘤进展过程中似乎更容易被保留下来,而且不同时间点的ecDNA还存在共享现象。 晚期癌症中的ecDNA更易发生局部高突变事件 ,这些高度突变的ecDNA往往定位于变异等位基因比例相对较高的区域。

第二篇文章是 2024年10月 发表在 《Nature》(IF:50.5) 名为:“ 突变和ecDNA的相互作用塑造了尿路上皮癌的进化,The interplay of mutagenesis and ecDNA shapes urothelial cancer evolution ”的研究文章。
这项研究整合了尿路上皮癌患者连续肿瘤样本的突变特征和系统发育分析,以明确这些演变过程的动态特征。深入探讨了尿路上皮癌(UC)的进化过程中, 基因突变和外源性突变因素之间的相互作用 ,以及这些过程与复杂结构变异(SV),特别是染色体外DNA(ecDNA)的关系。有望为未来的研究和拦截尿路上皮发生和治疗耐药性的创新治疗策略的开发带来了希望。
研究表明,APOBEC3诱导的突变主要呈克隆性和早期性, 而化疗则会导致晚期亚克隆突变的显著爆发 。借助先进的基因组图计算工具,发现形成染色体外DNA(ecDNA)的SV通常具有高频的高拷贝数环状扩增子特征。进一步地,我们分析了ecDNA形成SV中APOBEC3诱导和化疗诱导突变的不同时间模式,从而对这些诱变过程与ecDNA生物发生的时间关系有了更深入的理解。
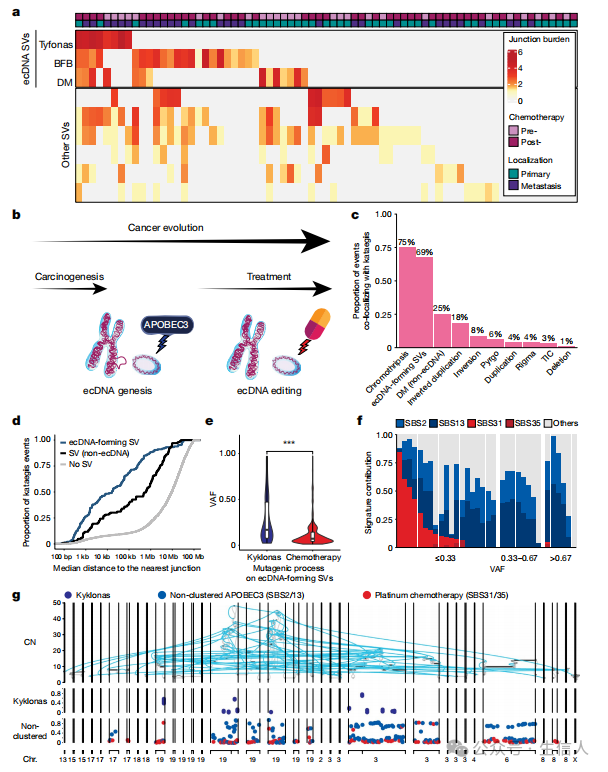 图 3
图 3 ecDNA驱动的尿路上皮癌(UC)癌基因扩增
作者使用FishHook工具来搜索具有反复结构变异的区域。FishHook确定了31个位点,其中17个(55%)位于与 癌症相关基因 (如CCND1、AXIN2、CHEK2、ERBB2、FHIT、KRAS、MDM2或NUMA1)500kb的范围内。值得注意的是,包含CCND1的11q13.3位点参与了大多数SVs(13个样本),其中92%为形成ecDNA的SVs。
CCND1 ecDNA形成结构变异(SVs)在治疗下的动态变化
尿路上皮癌(UC)患者在接受系统治疗后,CCND1外染色体DNA(ecDNA)形成结构变异(SVs)的复杂性和数量显著增加的现象。具体而言,治疗后的肿瘤样本中,CCND1 ecDNA扩增事件变得更加复杂多样,这些事件整合了额外的DNA片段,并且拷贝数也有所增加。这一现象表明,在治疗选择压力的作用下, ecDNA形成SVs成为了驱动适应性肿瘤细胞进化的重要因素 。这些研究结果 强调了CCND1 ecDNA在化疗抗性形成中的关键作用 ,而且为开发针对CCND1 ecDNA的潜在治疗策略提供了新的思路。
 图 4
图 4 CCND1 ecDNA驱动化疗耐药
最终,通过实验有力地验证了CCND1外染色体DNA(ecDNA)在驱动尿路上皮癌细胞对顺铂化疗产生的适应性机制。实验中采用了非整合慢病毒载体技术,将含有CCND1-mCherry或对照GFP载体的基因片段导入UMUC3膀胱癌细胞系。通过Incucyte活细胞成像系统,对细胞进行了连续的实时监测,并设计了与顺铂处理的竞争实验。实验结果显示,在顺铂的暴露下,携带mCherry标记的CCND1 ecDNA的UMUC3细胞相较于对照组,展现出了显著的选择性生长优势。为了更深入地探究这些细胞在顺铂处理下的转录组变化, 作者进一步采用单细胞RNA测序技术。分析结果显示,含有CCND1 ecDNA的细胞显著地激活了下游的E2F信号通路。这一重要发现表明,CCND1 ecDNA通过加速细胞周期进程,从而显著增强了细胞对化疗药物的适应性。
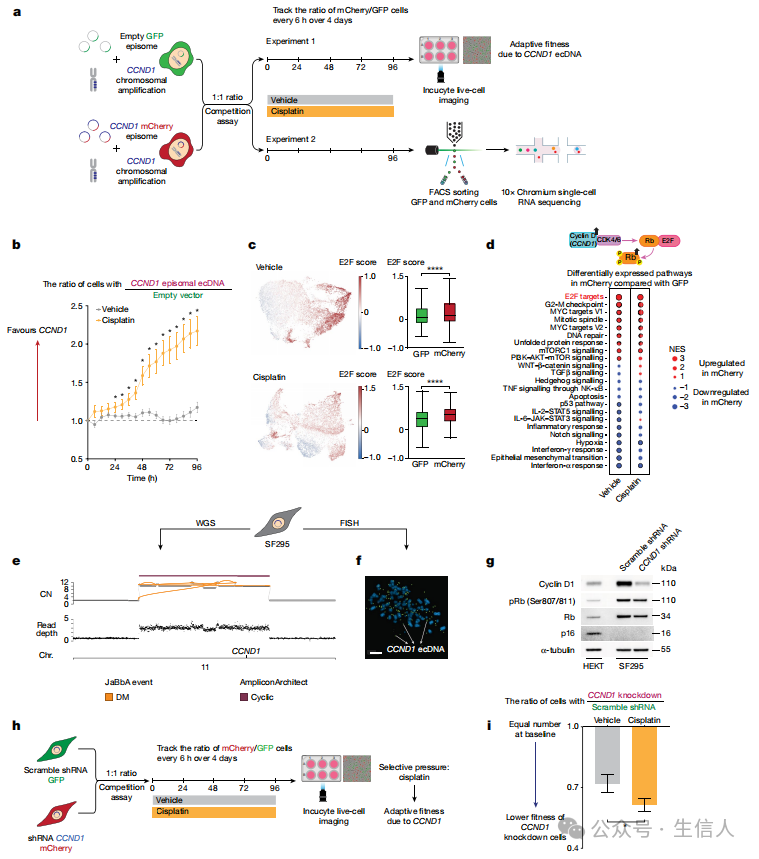 图5
图5 这两篇文章都揭示了染色体外DNA(ecDNA)在癌症进展的化疗耐药中的作用, ecDNA作为癌症发病机制的关键参与者,已在众多癌症类型中被广泛识别。随着癌症病情的持续加剧,基因组完整性的监管机制逐渐失效,这一变化可能加剧了基因组的不稳定性,从而为ecDNA的形成创造了有利条件。 在癌细胞为了争夺稀缺资源如氧气和营养而进行的激烈竞争中,或是在面对抗癌治疗所带来的巨大压力,以及在癌症转移这一复杂过程中,局部扩增现象,尤其是ecDNA的扩增,可能为癌细胞赋予了显著的适应性优势。这种优势使得癌细胞能够维持更高的增殖速率,进而在恶劣环境中生存并扩散。
这些突破性研究文章,不仅加深了我们对癌症基因组演变的理解,而且为未来治疗耐药性的创新治疗策略的开发带来了希望。研究者们正在探索如何通过靶向ecDNA来克服癌症的耐药性,这些新见解和策略有望在未来的研究中得到进一步的发展和应用,为治疗肿瘤进展和耐药性提供了新的方向。
链接:http://www.lewenyixue.com/2024/12/05/ecDNA%E9%A9%B1%E5%8A%A8%E8%82%BF%E7%98%A4%E8%BF%9B%E5%B1%95%E2%80%94Nature%E7%83%AD%E7%82%B9/





赶快来坐沙发