近年来,通过化疗、手术、放射治疗、自体干细胞移植和免疫治疗等多学科联合治疗,神经母细胞瘤的治疗效果取得了显著提高,5 年总生存率由 54% 提高到 79%。但高危神经母细胞瘤(HR-NB)的治疗仍存在挑战,其初始反应率较低,预后较差,5年OS率仍低于50%。为了解决这个问题,国际上普遍倾向于在诱导期采用高强度化疗方案,以控制肿瘤生长、提高初始反应率并为手术干预做好准备,这些都对 HR-NB患儿的预后产生了重大影响。
在我国,目前NB(神经母细胞瘤)的化疗方案多源自欧美,但由于种族差异,患者对化疗的反应和耐受性存在差异。化疗药物在杀死肿瘤细胞的同时,也会对健康细胞造成损害,影响患者对化疗的耐受性和依从性,部分患者甚至会因化疗副作用而拒绝治疗。因此,HR-NB患儿化疗后感染、出血、 化疗相关不良反应(chemotherapy-related adverse reactions, CRAR) 等并发症的发生率较高,是导致患者预后不良甚至死亡的重要因素。
近日, 上海交通大学医学院附属新华医院儿童血液肿瘤科 的 袁晓军 等在 European Journal of Pediatrics 上发表了名为“ Analysis of the incidence, characteristics, and risk factors of complications during induction chemotherapy in children with high-risk neuroblastoma ”的文章, 根据2007年1月至2019年12月在本院收治的108名HR-NB患儿的临床资料, 探讨了高危神经母细胞瘤患儿诱导化疗期间需住院治疗的并发症发生率、特点及危险因素 。

https://doi.org/10.1007/s00431-023-05273-w
1 患者特征
自2007年1月至2019年12月在新华医院确诊NB患者共287例,其中55.7%(160/287例)属于高危人群。排除14例(8.8%)因各种原因降低诱导化疗强度的患者、15例(9.4%)转入前已在其他医院接受化疗的患者、23例(14.4%)未完成诱导化疗疗程的患者后,最终共纳入HR-NB患者108例。所有患者均未接受免疫治疗,4例患者接受了移植手术。
治疗方案 :所有 HR-NB 病例均根据中国儿童肿瘤学组(CCCG)制定的神经母细胞瘤多学科治疗指南进行评估和治疗。一般来说,患者完成4个周期的诱导化疗后接受手术和外周血干细胞采集,然后进行4个周期的巩固化疗和放射治疗,最后采用顺式维甲酸 (13-cis-RA) 进行维持治疗。当中性粒细胞计数降至 1×10 9 /L 以下时,开始使用粒细胞集落刺激因子 (G-CSF) 治疗。诱导期间的详细化疗方案如表1所示。

CTX:环磷酰胺;TOPO:拓扑替康;D:天;CDDP:顺铂;Vp-16:依托泊苷;DOXO:阿霉素;VCR 长春新碱
发病年龄中位数为37.2个月(7.36~183个月),以1~5岁儿童为主(79例,73.1%)。男性(76例,70.4%)多于女性(32例,29.6%)。原发部位以肾上腺及腹膜后最多见(95例,88.0%),转移部位以骨骼(71例,65.7%)及骨髓(74例,68.5%)最多见。值得注意的是,所有患者(100%)血清NSE均高于正常;98.1%的病例(106例)血清LDH升高,61.1%(66例)的患儿尿VMA升高。INSS 4期病例占多数(89例,82.4%),最常见的病理亚型为神经母细胞瘤(85例,78.7%),尤其是低分化神经母细胞瘤(55例,50.9%)。
HR-NB患者中,70.4%(76/108)的病例在诱导化疗期间发生了两种不同类型的并发症,较少比例(23.1%,25/108)发生了三种类型的并发症。只有少数患者(6.5%,7/108)仅出现一种并发症。共有100例患儿发生感染(92.6%);26例(24.1%)发生出血,所有患者(100.0%)均出现CRAR。各周期诱导化疗期间感染、出血和CRAR的发生率见图 1。
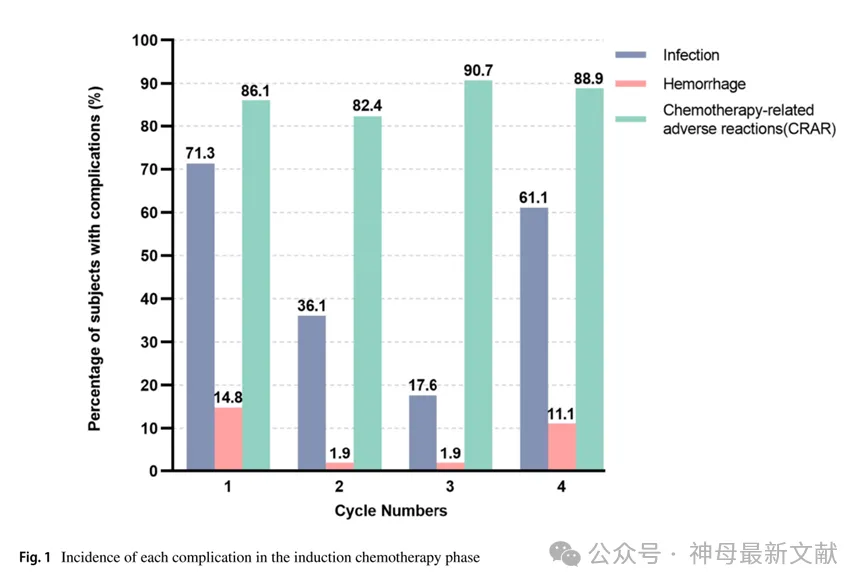
图1. 诱导化疗期各并发症的发生率
Infection:感染;Hemorrhage:出血;Chemotherapy-related adverse reactions(CRAR):化疗相关不良反应
2 感染的发生率和特征
100例HR-NB患儿在诱导化疗期因感染入院,感染率为92.6%。不同化疗周期感染的发生率及严重程度不同,第1和第4周期感染发生率较高,尤其第1周期感染率高达71.3%(77例)。32例(32/100,32.0%)感染一次,43例(43/100,43.0%)感染两次,25例(25/100,25.0%)感染多次。三级感染最为常见,此时除常规退热措施外,常需静脉注射高级抗生素或抗真菌药物。发生 FN(Febrile Neutropenia, 中性粒细胞减少性发热) 的HR-NB患儿还应注射G-CSF以促进血液学恢复。研究者统计了每个化疗周期的感染严重程度,并根据 CTCAE (Common Terminology Criteria for Adverse Events, 常见不良事件通用术语标准) 进行分级,详见图 2。
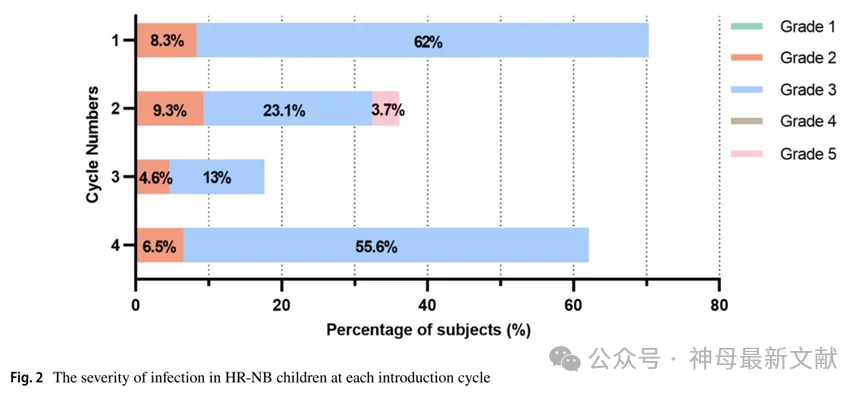
图2. HR-NB儿童在各诱导周期感染严重程度
-
各化疗周期HR-NB患儿因感染入院的原因,包括细菌、真菌或其他病原体感染以及FN。
-
因发热性中性粒细胞减少症(FN)住院的比例最高,48名(48/100,48.0%)仅住院一次,42名(42/100,42.0%)住院两次或更多。
-
其次是细菌感染37例(37/100,37%),最有可能发生在第一个化疗周期(共18例,18/100,18.0%)。在引起细菌感染的病原体中,革兰氏阳性菌(25/37例,67.6%)比革兰氏阴性菌(12/37例,32.4%)更为普遍。最常见的革兰氏阳性菌为金黄色葡萄球菌(12例)、肠球菌属(5例)、表皮葡萄球菌(4例)。最常见的革兰氏阴性菌为大肠埃希菌(9例)。
-
真菌感染共12例(12/100,12.0%),以第4周期多见(共5例,5/12,41.7%)。真菌感染中最常见的病原菌为白色念珠菌(7例)和新型隐球菌(5例),其他病原菌感染较少,仅8例(8/100,8%)。
-
值得注意的是,支原体感染最为常见,共6例(6/100,6.0%),且多发生在第4周期。
-
1例(1/100,1.0%)疱疹病毒感染患者,表现为唇周疱疹,瘙痒、疼痛,1例因微病毒B19感染导致严重贫血。
各周期感染原因见图 3。
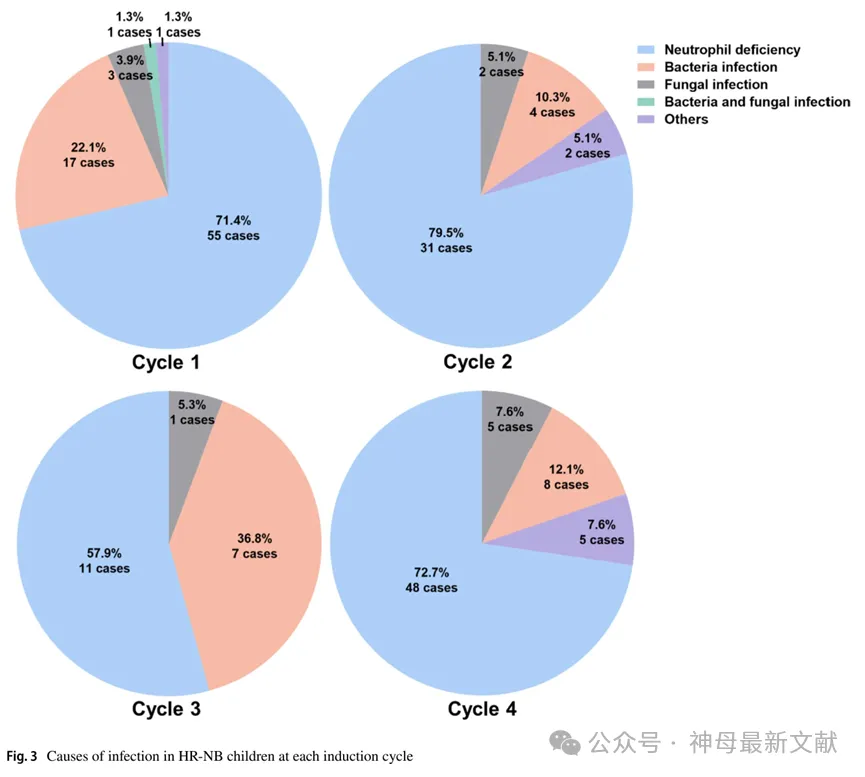
图3. HR-NB 儿童各诱导周期感染原因
Neutrophil deficiency:中性粒细胞缺乏症
Bacteria and fungal infection:细菌和真菌感染
Others:其他
3 出血发生率和特征
HR-NB患儿诱导化疗期发生出血26例,总出血发生率为24.1%。不同化疗周期出血发生率及表现不同,第1、4个化疗周期出血发生率较高,尤以第1个化疗周期出血发生率最高,达14.8%(16例)。22例(22/108,20.4%)患者发生过1次出血,4例(3.7%)患者发生过2次以上出血。
本研究将出血分为黏膜出血/鼻出血、血尿、血便、肺出血、自发性肿瘤出血等不同类型,其中黏膜出血/鼻出血最常见(20例)。大部分出血表现不严重,不需要治疗或仅需局部治疗即可止血。其中自发性肿瘤出血3例,环磷酰胺诱发的出血性膀胱炎2例,肺出血1例,均有生命危险,需及时发现止血,必要时输血制品。
各周期出血表现及分级见图4、图5。
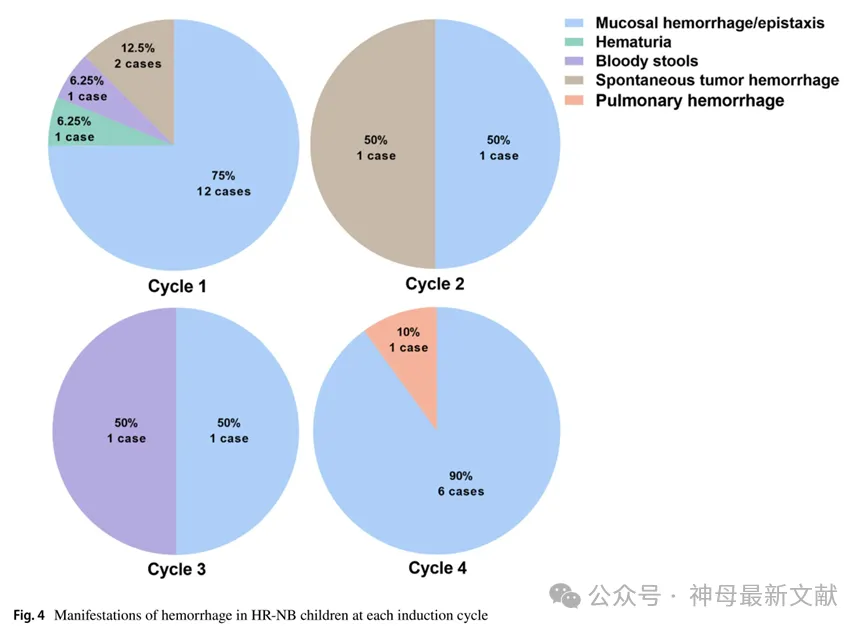
图4 . HR-NB 儿童各诱导周期出血表现
Mucosal hemorrhage/epistaxis:粘膜出血/鼻出血
Spontaneous tumor hemorrhage:自发性肿瘤出血
Pulmonary hemorrhage:肺出血
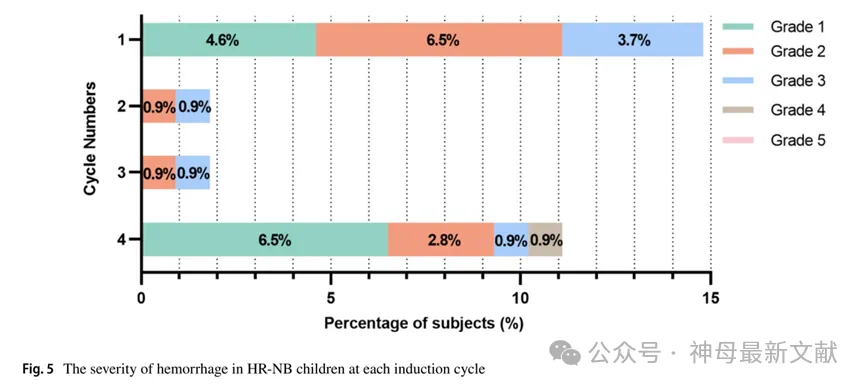
图5. HR-NB 儿童各诱导周期出血严重程度
4 化疗相关不良反应(CRAR)的发生率和特征
研究者将CRAR分为骨髓抑制和非骨髓抑制不良反应两大类。HR-NB患儿均有CRAR,99.1%的患者在化疗后出现骨髓抑制,75.9%的患儿还出现非骨髓抑制不良反应。由于对化疗的耐受性和反应性不同,以及化疗药物的毒性不同,不同化疗周期CRAR的发生率和表现也不同。具体数据见图 6。
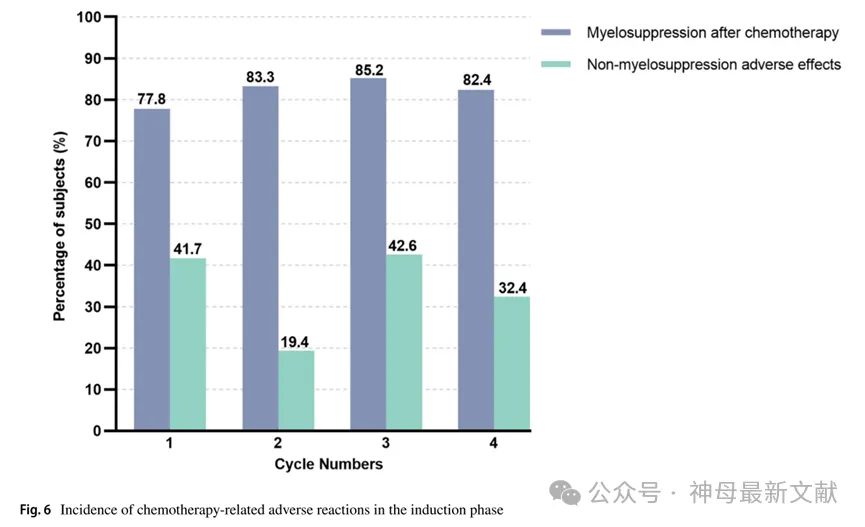
图6. 诱导期化疗相关不良反应发生率
Myelosuppression after chemotherapy:化疗后骨髓抑制
Non-myelosuppression adverse effects:非骨髓抑制不良反应
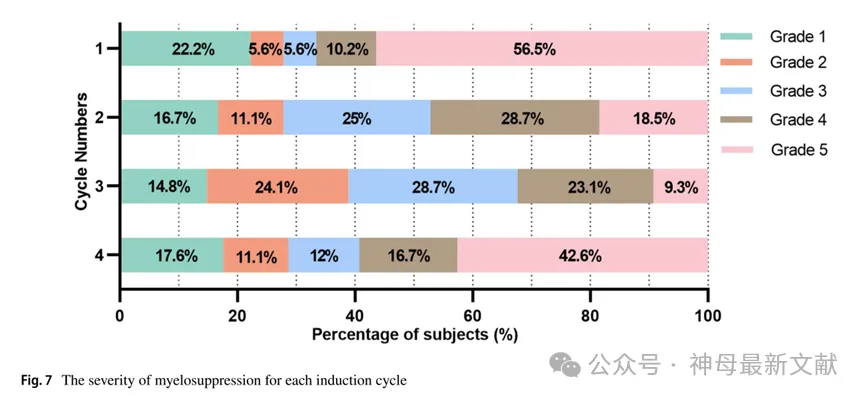
各诱导化疗周期骨髓抑制发生率均在70%以上,尤其在第3周期高达85.2%。各化疗周期后骨髓抑制程度见图7,仅1例患者(1/108,0.9%)整个诱导化疗过程中未出现骨髓抑制,但74.1%(80/108)的患者出现5级重度骨髓抑制。第1和第4周期化疗后骨髓抑制程度均较重,以5级最多见,尤其在第1周期(56.5%)。第2周期以4级多见(28.7%)。第3周期化疗后骨髓抑制相对较轻,以3级多见(28.7%)。
图7. 各诱导周期的骨髓抑制严重程度
非骨髓抑制性不良反应在第1和第3周期发生率较高,尤其在第3周期高达42.6%,非骨髓抑制性不良反应共发生147次,其中最常见的是急性并发症(141次)。
急性并发症中,呕吐、腹痛等胃肠道症状最常见,发生107次(75.9%),其次是仅发生在化疗期的咳嗽或一过性呼吸困难等呼吸道症状(13次,9.2%)和心肌损害、一过性心律失常等循环系统症状(12次,8.5%)。
HR-NB患儿每周期各系统急性并发症表现如图 8所示。这些急性并发症中,2级最多见(109次,77.3%),其次是3级(20次,14.2%)。无患者因急性并发症死亡。2例患儿(2/108,1.9%)使用铂类药物后出现严重呕吐,1例患儿(1/108,0.9%)使用阿霉素(DOXO)过程中出现呕吐、面部红肿、四肢颤抖。值得注意的是,共有8例患儿(8/108,7.4%)因生命体征不稳定转入儿科重症监护病房(PICU),其中2例接受气管插管。HR-NB患儿各诱导周期急性并发症严重程度系统性分布见图 9。晚期并发症中,诱导化疗期间出现铂类药物引起不同程度听力损害3例(按CTCAE分级,1例为1级,2例为2级),儿童患者出现 长春新碱引起的周围神经毒性(vincristine-induced peripheral neurotoxicity, VIPN) 3例(按CTCAE分级,均为2级),值得注意的是,该现象随化疗周期数增加而愈加严重。
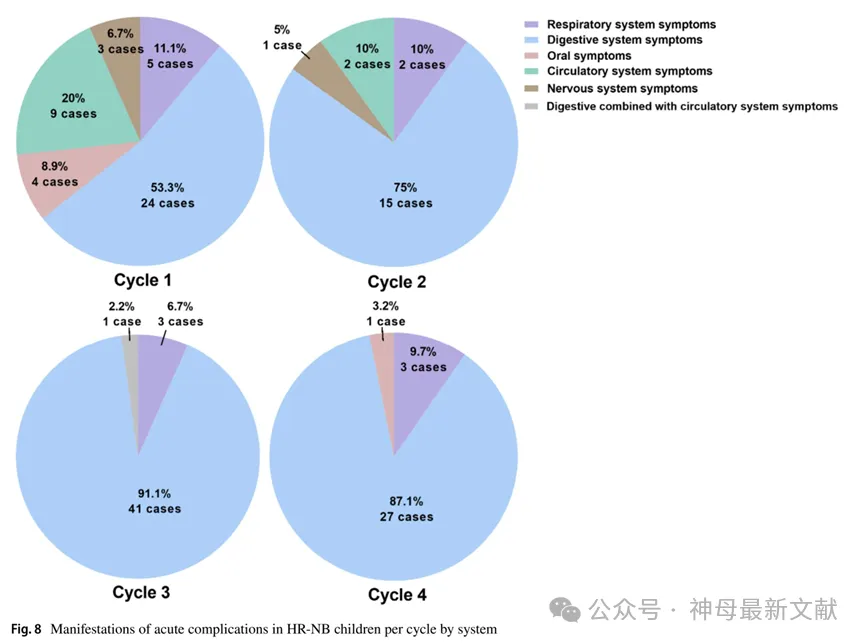
图8. HR-NB 儿童各周期的急性并发症表现
Respiratory system symptoms:呼吸系统症状
Digestive system symptoms:消化系统症状
Circulatory system symptoms:循环系统症状
Nervous system symptoms:神经系统症状
Digestive combined with circulatory system symptoms:消化系统与循环系统合并症状
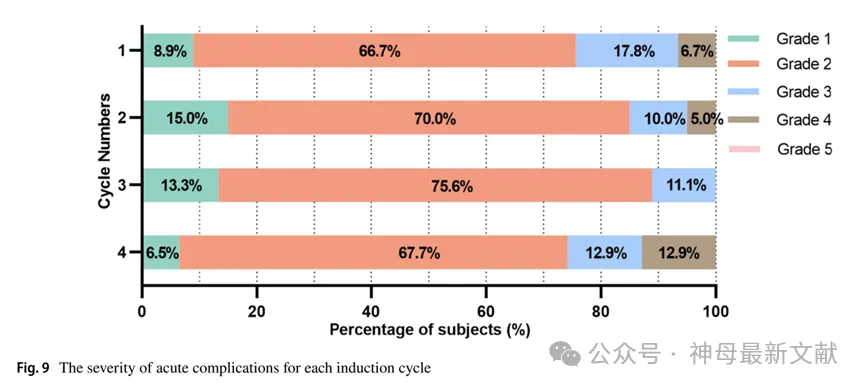
图9. 各诱导周期的急性并发症的严重程度
5 各种并发症的危险因素
6 预后
对上述HR-NB患儿完成所有治疗(包括诱导、巩固、维持治疗)后进行随访,截至2022年10月31日,中位随访时间为57.7个月(范围4.8~136.9个月)。
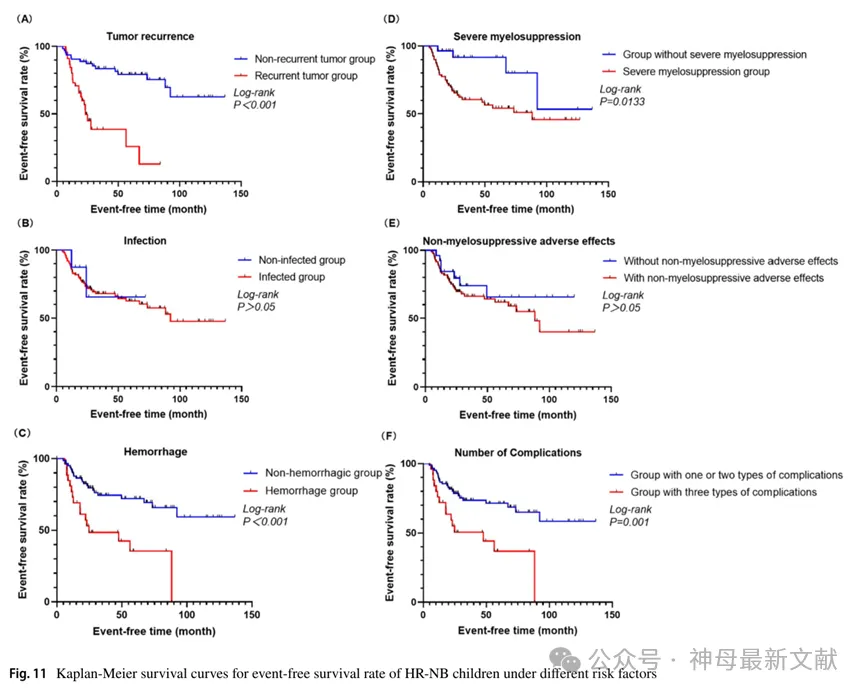
108例中复发45例(45/108,41.7%),其中死亡24例(24/45,53.3%)。复发组患儿3年OS为(81.9±5.8)%,显著低于未复发组(83.6±4.7%)(X 2 = 9.027,P=0.003),3年EFS为(38.7±9.6)%,显著低于未复发组(83.6±4.7%)(X 2 = 24.5,P<0.001),说明复发患儿的预后较差。
非复发组患儿死亡率为23.8%(15/63),其中4例死于诱导化疗期,远低于复发组。
感染组100例,37.0%患儿在随访期间死亡,其中4例死于诱导化疗期间;未感染组8例,其中2例(2/8,25.0%)最终死亡(P=0.50)。
感染组3年OS为(83.4±3.8)%,未感染组为(75.0±15.3)%。统计学分析显示,感染组与未感染组患者的远期预后差异无统计学意义(X 2 = 0.099,P>0.05)。
感染组3年EFS为(68.0±4.9)%,未感染组3年EFS为(65.6±20.9)%(X 2 =0.089,P>0.05)。
因此,诱导化疗期间是否发生感染并不影响患儿最终的生存结局。
108例儿科患者中,26例(24.1%)在诱导化疗期间发生出血事件,根据发生情况分为出血组及无出血组。
出血组病死亡率(61.5%,16/26)显著高于无出血组(28.0%,23/82)(P=0.002)。
出血组的中位生存期为51.9个月,3年EFS为(42.5±10.5)%,3年OS为(68.8±9.2)%。而无出血组中位生存期为59.7个月,3年EFS为(74.4±5.2)%(X 2 = 12.68,P<0.001),3年OS为(85.9±4.0)%(X 2 = 12.933,P<0.001)。
诱导化疗期发生出血事件的儿童患者远期预后较差。
HR-NB组患者均出现CRAR,74.1%出现5级重度骨髓抑制,75.9%病例还出现非骨髓抑制性不良反应。
随访时诱导化疗中出现重度骨髓抑制的患儿中位生存期为55.7个月,43.8%(35/80例)因各种原因死亡。3年OS为(79.3±4.6)%,3年EFS为(60.5±5.7)%。
而未发生重度骨髓抑制的患者中位生存期为59.1个月,3年OS为(92.7±5.0)%(X 2 = 5.031,P=0.02),3年EFS为(91.6±5.8)%(X 2 = 6.134,P=0.013)。
诱导化疗期间重度骨髓抑制与HR-NB患儿远期预后不良有关。
虽然非骨髓抑制不良反应组患者病死率(39.0%,32/82)稍高于无非骨髓抑制不良反应组患者(26.9%,7/26,P=0.26),但前者中位生存期(56.3个月)稍短于后者(58.5个月),前者3年EFS为(66.2±5.5)%,3年OS为(79.8±4.5)%,低于后者3年EFS(73.9±9.4)%(X 2 =1.135,P>0.05)和3年OS(86.5±7.4)%(X 2 =1.649,P>0.05)。但这些差异并不具有统计学意义。也就是说,诱导化疗期间非骨髓抑制性不良反应的发生并不影响儿童患者的预后。
但毋庸置疑,当儿童患者出现不同程度的听力障碍、VIPN(长春新碱引起的周围神经毒性)等长期并发症时,其生活质量会显著下降。值得注意的是,13名患儿(12.0%)在治疗或随访期间出现不同程度的听力障碍;3名患儿出现VIPN,1名患者(0.9%)在所有治疗结束5年5个月后出现sAML(继发性急性髓系白血病)。在HR-NB患儿中,出现三种并发症的比例较小(23.1%,25/108例)。
研究者根据诱导化疗期间上述三种并发症(感染、出血和CRAR)的有无将患者分为两组,并比较各自的预后。出现多种并发症的患者预后明显较差。并发症组中位生存期为54.4个月,3年EFS为(44.2±10.7)%,3年OS为(75.8±8.6)%,而仅有1~2个并发症组中位生存期为59.5个月,3年EFS为(73.5±5.2)%(X 2 = 10.457,P=0.001),3年OS为(84.8±4.1)%(X 2 = 10.511,P=0.001),见图10、图11。
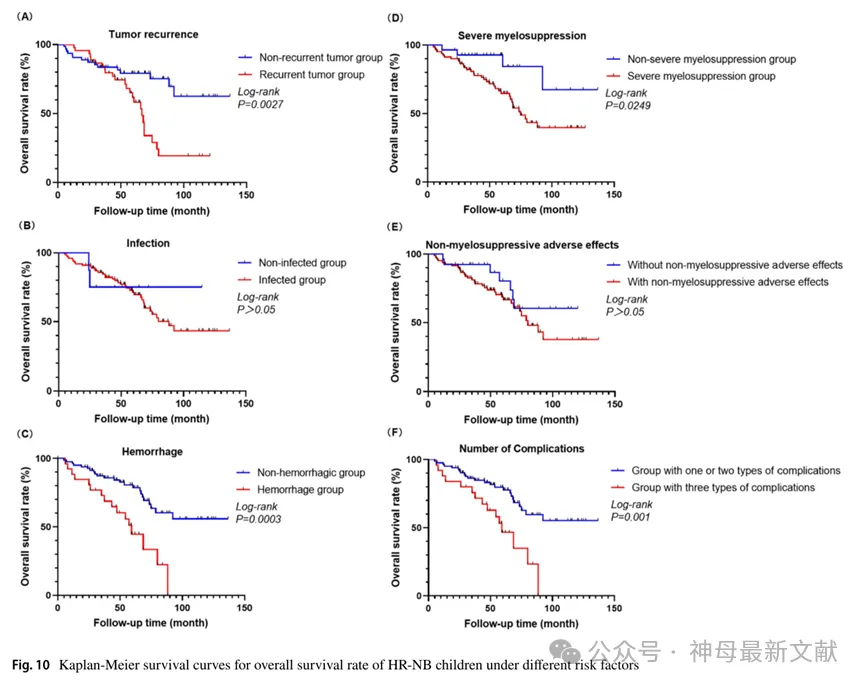
图10. 不同危险因素下HR-NB患儿总生存率(OS)的Kaplan-Meier生存曲线
(A) Tumor recurrence 肿瘤复发
Non-recurrent tumor group未复发肿瘤组
Recurrent tumor group复发肿瘤组
Non-hemorrhagic group未出血组
(D) Severe myelosuppression重度骨髓抑制
Non-severe myelosuppression group非重度骨髓抑制组
Severe myelosuppression group重度骨髓抑制组
(E) Non-myelosuppressive adverse effects非骨髓抑制不良反应
Without non-myelosuppressive adverse effects无非骨髓抑制不良反应
With non-myelosuppressive adverse effects有非骨髓抑制不良反应
(F) Number of Complications并发症数量
Group with one or two types of complications具有一或两种并发症的组
Group with three types of complications具有三种并发症的组
图11. 不同危险因素下HR-NB患儿无事件生存率(EFS)的Kaplan-Meier生存曲线
(A) Tumor recurrence 肿瘤复发
Non-recurrent tumor group未复发肿瘤组
Recurrent tumor group复发肿瘤组
Non-hemorrhagic group未出血组
(D) Severe myelosuppression重度骨髓抑制
Non-severe myelosuppression group非重度骨髓抑制组
Severe myelosuppression group重度骨髓抑制组
(E) Non-myelosuppressive adverse effects非骨髓抑制不良反应
Without non-myelosuppressive adverse effects无非骨髓抑制不良反应
With non-myelosuppressive adverse effects有非骨髓抑制不良反应
(F) Number of Complications并发症数量
Group with one or two types of complications具有一或两种并发症的组
Group with three types of complications具有三种并发症的组
7 讨论
108例HR-NB患者中,男性患者占多数(70.4%),患者年龄以1~5岁为主(73.1%),INSS分期多为4期(82.4%),NSE≥200µg/L(100%),LDH≥1000U/L(98.1%),VMA高于正常(61.1%)。原发部位以肾上腺及腹膜后最多(88.0%),转移部位以骨骼(65.7%)和骨髓(68.5%)最多。最常见的病理类型为神经母细胞瘤(78.7%),尤其是低分化神经母细胞瘤(50.9%)。108例患者中,41.7%的患者出现肿瘤复发,其中53.3%(24/45例)的患者最终死于该病。一旦发生复发,该类患者预后不良。诱导化疗期间并发症发生率较高,92.6%的病例发生感染,24.1%的病例发生出血。值得注意的是,所有患者均出现CRAR。
本研究的EFS和OS明显高于其他作者发表的生存数据,这可能归因于与研究人群有关的以下几个因素。一些难治性病例或受某些客观因素影响的病例,例如一些患者在其他医院接受治疗后转诊至新华或从新华转至其他机构,或接受个性化治疗(如调整治疗方案)的病例,考虑到不同方案的差异,所有这些病例均未纳入该研究。此外,有些对化疗不耐受的儿科患者减少了剂量,这些病例也不在本研究中。重要的是要认识到,各种因素,包括种族差异、地理因素和医疗技术的进步,都可能在这种差异中发挥作用。
FN(中性粒细胞减少性发热)是最常见的感染相关并发症,细菌感染和真菌感染也是HR-NB患儿诱导化疗期间常见的感染并发症。90%的患者因FN入院,高于美国研究(78%,美国德州儿童医院研究报告,doi:10.1080/08880018.2017.1396386,后文中提及的美国数据均源于该研究),但由于使用G-CSF以及部分患者在门诊得到及时正确的处理,实际比例可能更高。
感染发生率最高的是在第1个周期。这可能与我国儿童对初始化疗的不耐受、种族差异、人口密度高有关。初期感染以细菌感染为主,以革兰氏阳性菌感染最常见,与美国的研究结果一致,后期感染中真菌和病毒感染逐渐增多,这可能与化疗引起免疫功能紊乱有关。
本研究发现,革兰氏阳性菌中以金黄色葡萄球菌、肠球菌和表皮葡萄球菌最多见,革兰氏阴性菌中以大肠杆菌最多见。真菌感染以白色念珠菌和新型隐球菌为主,其他病原菌如支原体等也较常见。这种趋势可能与人口密度高、种族多样性、部分患者口腔及肛周卫生重视不够、化疗后患者免疫功能下降、血培养取样前消毒不充分等因素有关。
美国研究发现,3岁以下患有HR-NB且MYCN扩增的儿童更容易被感染,女性患泌尿道感染的风险更高。但本研究发现,感染组与非感染组在年龄、性别和MYCN扩增方面均无显著差异。这种差异可能与患者以男性为主、年龄在1-5岁之间且MYCN基因扩增数量相对较少有关。需要进一步的数据来确定这种关系。
本研究证明骨髓转移和VMA异常是诱导化疗期间感染的高危因素。这可能归因于这些儿科患者的肿瘤负担高和免疫系统较弱。
美国研究也显示感染患者的寿命较短。虽然本研究发现感染组的3年EFS和3年OS低于非感染组,但两组预后差异无统计学意义。这可能与本研究感染发生率较高、随访时间不足、缺乏多中心数据有关,也可能与新华大多数儿科患者没有发生重症感染,并及时采取G-CSF和抗感染治疗等措施有关。值得一提的是,当这些患儿发生重症感染时,新华团队能够及时识别和实施专家治疗策略。例如,在8例转入PICU的病例中,仅4例死于重症感染,其余病例均在治疗后好转出院。
但需要注意的是,三级感染是最常见的。此时,除常规退热措施外,往往需静脉注射高级抗生素或抗真菌药物等药物,这不仅增加了HR-NB患儿的住院次数和治疗费用,甚至推迟了后续化疗,还增加了抗生素暴露量,改变了个体菌群,导致抗生素耐药性的产生,这无疑给患儿的身体健康、家庭经济和医疗体系带来了沉重的负担,因此,预防诱导化疗后的感染,适当减少抗生素的使用,应是今后医生关注的重要问题。
本研究出血发生率为24.1%,显著高于其他研究结果。某些疾病引起出血的患儿多数临床症状不严重,以鼻出血和全身散在出血为主,通常可自行痊愈或通过局部干预治疗可控制。神经母细胞瘤破裂出血与原发肿瘤最大直径有相关性。本研究发现NSE和LDH值升高是出血的高危因素,与其他研究结果一致。这种关系可能与肿瘤负荷高、化疗耐受性差有关。化疗诱导的肿瘤溶解(TLS)可导致LDH水平急剧升高。本研究组中无患者发生TLS,这可能归因于在化疗期间采取的预防措施,例如确保充分补水和密切监测患者的代谢标志物,包括钙、磷酸盐、尿酸、LDH和尿量。尽管这种出血事件看似良性,但本研究中出血组的死亡率却高达61.5%。此外,与其他研究结果一致,出血组的长期预后明显更差。应特别注意初次诊断时肿瘤最大直径较大、NSE和LDH水平高或LDH水平突然急剧升高的儿童。任何肿瘤内或肺出血如果发生都可能危及生命。在这种情况下,主要是控制出血并维持基本生命功能,包括输血、盐水和胶体液。
第1和4疗程化疗后骨髓抑制程度较重,尤其以第1个疗程为重,这与患儿早期肿瘤负荷大、化疗剂量较大、既往无化疗史等因素有关。第3个疗程化疗后骨髓抑制发生率较低,可能与这一轮化疗药物性质较温和、患儿对化疗耐受性形成及家属做好预防措施有关。值得注意的是,当骨髓抑制达到4级以上时,易发生并发症,需及时干预,如输血制品、G-CSF等。此外,对于骨髓抑制严重的患儿,存在骨髓转移、VMA异常、LDH≥1000U/L是其危险因素,可能与肿瘤负荷大、骨髓造血功能受损有关。还发现,患有严重骨髓抑制的HR-NB儿童长期预后较差。4名患者在第4个诱导周期后因骨髓抑制死亡,这可能是由于免疫力低下、抗生素疗效不佳以及化疗药物毒副作用的累积。
由于对化疗的耐受性和反应性以及化疗药物的毒性不同,不同化疗周期的非骨髓抑制不良反应表现各异。有骨骼受累的患儿更容易出现非骨髓抑制不良反应。即使在化疗前30分钟预防性使用盐酸帕洛诺司琼注射液,恶心、呕吐等胃肠道症状仍然是本研究中最常见的急性并发症。但令人欣慰的是,2级急性并发症最为常见,无一例患者因急性并发症而死亡。这可能归功于在化疗期间采取的措施,包括止吐、补液和密切监测。
虽然非骨髓抑制不良反应的发生并未显著影响本研究患儿的生存结果,但它确实增加了患儿的经济负担。但毫无疑问,当儿科患者出现长期并发症时,他们的生活质量会大大下降。本研究中13名儿童(12.0%)在治疗或随访期间出现不同程度的听力障碍。值得注意的是,3例发生在诱导化疗期间,10例发生在诱导化疗完成后或随访期间。这种听力障碍主要归因于铂类药物的耳毒性作用,这种作用会导致不可逆的、延迟的和进行性的听力损害,并且即使在完成癌症治疗后也会持续存在。顺铂的累积剂量和最大单次剂量与重度听力损失风险的增加密切相关。耳毒性的发生影响儿童的语言学习和行为发育。为了降低这种风险,建议使用耳毒性较小的铂类药物(如卡铂)或预防性使用听力保护药物(如硫代硫酸钠),且不影响化疗药物的抗肿瘤活性,并在治疗后定期监测听力。
还发现有三名儿童患上了与VCR(长春新碱)相关的VIPN(长春新碱引起的周围神经毒性)。毒性是外周性、渐进性(从远端到近端)和对称性的。它限制了化疗中VCR的剂量,导致治疗延迟或中断,并增加了医疗费用。今后在多药联合化疗中应更加注重不同种族药物代谢的差异,优化VCR的剂量,在保证疗效的同时减少周围神经病变。随着化疗的广泛使用,HR-NB患儿发生继发性恶性肿瘤的风险显著增加,sAML(继发性急性髓系白血病)排名靠前。本研究中1例患者(0.9%)在完成所有治疗后发生sAML。已知增加治疗相关AML(急性髓系白血病)风险的化疗药物包括大剂量烷化剂[如环磷酰胺(CTX)]、拓扑异构酶抑制剂[如拓扑替康(TOPO)]和铂类药物[如顺铂(CDDP)] 。需要对患儿进行长期随访和监测。
8 结论
骨髓受累、VMA增高是感染的高危因素,NSE≥200µg/L、LDH≥1000U/L是出血的高危因素。对于出现重度骨髓抑制的患儿,骨髓转移、VMA增高、LDH≥1000U/L是其危险因素。骨受累是患儿发生非骨髓抑制不良反应的高危因素。诱导化疗期间出现的并发症可能对患儿的预后和整体生活质量产生负面影响。临床医生在预测和处理并发症时考虑这些因素至关重要。
责编

制作
排版 | 车洁 校对 | uu
▼滑动查看更多▼
Patients with high-risk neuroblastoma (HR-NB) exhibit suboptimal 5-year survival rates, leading to a widespread international preference for high-intensity chemotherapeutic regimens in these children. We analyzed the incidence and risk factors for complications during induction chemotherapy in children with HR-NB and tried to assist clinicians in predicting such complications and optimizing therapeutic strategy. The clinical data of children with HR-NB admitted to our hospital from January 2007 to December 2019 were retrospectively analyzed. The incidence, characteristics, and risk factors of complications (infection, hemorrhage, and chemotherapy-related adverse reactions (CRAR)) requiring hospitalization during induction chemotherapy in these children were explored. (1) A total of 108 patients with HR-NB were included in the final analysis. The overall infection rate was 92.6% (100/108), with the highest incidence of 71.3% observed during the first cycle. FN, bacterial infection, as well as fungal infection were common infectious complications in children with HR-NB during induction chemotherapy. (2) The overall hemorrhage rate was 24.1% (26/108), with the highest incidence of 14.8% also observed in the first cycle. Among the children with hemorrhage, there were 72% with bone marrow involved, while 65.0% of them had a high vanillylmandelic acid (VMA) value. And children with hemorrhage also exhibited neuron-specific enolase (NSE) ≥ 200 µg/L in 88.5% of cases and lactic dehydrogenase (LDH) ≥ 1000U/L in 73.1% of cases. (3) The incidence of CRAR rate was 100%, and 99.1% (107/108) patients experienced myelosuppression. The incidence of myelosuppression peaked in the third cycle, reaching up to 85.2%. Most children suffered severe myelosuppression existed with bone marrow metastases (76.3%), abnormal VMA (67.5%), and LDH ≥ 1000 U/L (60%). (4) Non-myelosuppressive adverse effects were observed in 75.9% children (82/108), with the highest incidence occurring in the third cycle at 42.6%. (5) Patients who experienced three types of complications had a lower median survival time (MST) of 54.4 months, a 3-year event-free survival (EFS) rate of (44.2 ± 10.7)%, and a 3-year overall survival (OS) rate of (75.8 ± 8.6)%, in comparison to those with only one or two complications, who had a higher MST of 59.5 months, a 3-year EFS rate of (73.5 ± 5.2)% (X2 = 10.457, P = 0.001), and a 3-year OS rate of (84.8 ± 4.1)% (X2 = 10.511, P = 0.001).
DOI: 10.1007/s00431-023-05273-w
版权声明:本文为“乐问号”作者或机构在乐问医学上传并发布,仅代表该作者或机构观点,不代表乐问医学的观点或立场,不能作为个体诊疗依据,如有不适,请结合自身情况寻求医生的针对性治疗。
链接:http://www.lewenyixue.com/2024/12/05/EJP%20%7C%20%E9%AB%98%E5%8D%B1%E7%A5%9E%E7%BB%8F%E6%AF%8D%E7%BB%86%E8%83%9E%E7%98%A4%E6%82%A3%E5%84%BF%E8%AF%B1%E5%AF%BC%E5%8C%96%E7%96%97/

















赶快来坐沙发