最全综述:乳腺涎腺型肿瘤的组织病理和分子特征
乳腺涎腺型肿瘤是一类罕见的肿瘤,与对应的涎腺肿瘤在形态学、免疫表型和/或分子特征方面存在共性,凸显了多数情况下共同的潜在组织发病机制。WHO乳腺肿瘤分类中的涎腺型肿瘤包括腺样囊性癌(AdCC)、分泌性癌(SC)、黏液表皮样癌(MEC)、腺泡细胞癌(AciCC)和极为罕见的多形性腺癌(PAC)。这些肿瘤通常为三阴性[雌激素受体(ER)、孕激素受体(PR)和人表皮生长因子受体2(HER2)表达均为阴性],但总体预后良好,这与非特殊类型(NST)的高级别三阴性癌形成对比。另一方面,一小部分肿瘤,如实性-基底样型腺样囊性癌(SB-AdCC)、罕见的高级别癌以及与其他组织学类型的高级别浸润性癌转化相关的肿瘤,可能具有更强的侵袭性。其他乳腺涎腺型肿瘤,如多形性腺瘤(PA)和腺肌上皮瘤(AME),通常为良性,少数情况下可能发生恶性转化。乳腺涎腺型肿瘤的临床经验总体有限,其识别及准确分类对于预后和临床管理有着重要意义,特别是有助于避免过度治疗。在许多此类肿瘤中识别特征性的基因变异和/或免疫组化替代标志物,对于准确诊断及指导临床管理有着实际应用价值。本综述着重阐述乳腺涎腺型肿瘤的组织病理学和分子特征,以及诊断对于当前临床管理的意义。
研究背景
乳腺涎腺型肿瘤是一类罕见的肿瘤,与对应的涎腺肿瘤在形态学、免疫表型和/或分子特征方面具有共性。世界卫生组织(WHO)乳腺肿瘤分类将腺样囊性癌(AdCC)、分泌性癌(SC)、黏液表皮样癌(MEC)、腺泡细胞癌(AciCC)和极为罕见的多形性腺癌(PAC)列为涎腺型肿瘤。多数乳腺涎腺型肿瘤为三阴性[雌激素受体(ER)、孕激素受体(PR)和人表皮生长因子受体2(HER2)表达均为阴性],但总体预后良好,这与非特殊类型(NST)的三阴性乳腺癌(TNBC)形成鲜明对比,后者通常侵袭性强,临床预后差。另一方面,一小部分涎腺型肿瘤,如实性-基底样型AdCC(SB-AdCC)、罕见的高级别癌以及与转化为其他组织学类型的高级别浸润性癌相关的肿瘤,与更强的侵袭性有关。其他具有涎腺对应肿瘤的乳腺肿瘤包括上皮-肌上皮肿瘤多形性腺瘤(PA)和腺肌上皮瘤(AME),分别类似涎腺PA和上皮-肌上皮癌(EMC)。尽管PA和AME通常为良性,但恶性潜能未定,少数情况下可能发生恶性转化。
乳腺涎腺型肿瘤的罕见性凸显了对这类肿瘤的了解及临床经验较为有限。病理学家对它们的识别和分类对患者预后和管理具有临床意义,特别是有助于避免过度治疗。美国国家综合癌症网络(NCCN)临床实践指南建议,对于低级别涎腺型肿瘤,尤其是淋巴结阴性病例,仅采用局部治疗。乳腺涎腺型肿瘤的分子发病机制研究取得了进展,提供了更多辅助工具来助力诊断。本综述着重阐述涎腺型肿瘤的组织病理学和分子特征,以及诊断对于当前临床管理的意义。
腺样囊性癌
乳腺AdCC是一种罕见的、通常为三阴性的涎腺型肿瘤,好发于绝经后年长女性。WHO认定了三种类型:经典型AdCC(C-AdCC)、实性-基底样型AdCC(SB-AdCC)和AdCC伴高级别转化。AdCC各类型之间以及与其他TNBC的鉴别诊断颇为重要,因为其临床行为存在差异。
经典型腺样囊性癌
C-AdCC是最常见的AdCC类型,总体预后良好。这些肿瘤由上皮细胞和肌上皮细胞这两类细胞群构成,呈现出多种生长模式,包括筛状、网状、实性和管状(图1)。最为常见的筛状模式的特征是两种类型的圆形至椭圆形间隙:假柱状结构,内衬肌上皮细胞,通常充满黏液样或透明的基底膜物质;以及真柱状结构,内衬极化的上皮细胞。通过免疫组化染色能够凸显不同的细胞类型,低分子量角蛋白(CK7、CK8/18)和CD117在上皮细胞中呈阳性表达,而肌上皮细胞标志物(p63、SMM和/或calponin)和高分子量角蛋白(CK5/6、CK14、CK17)在肌上皮细胞中呈阳性表达。然而,肿瘤细胞通常不真正局限于谱系,可能出现这些标志物异常表达,例如在类似肌上皮细胞中,至少有一种肌上皮细胞标志物部分或完全缺失(图1E、F)。C-AdCC的有丝分裂活性和Ki-67增殖指数通常较低。
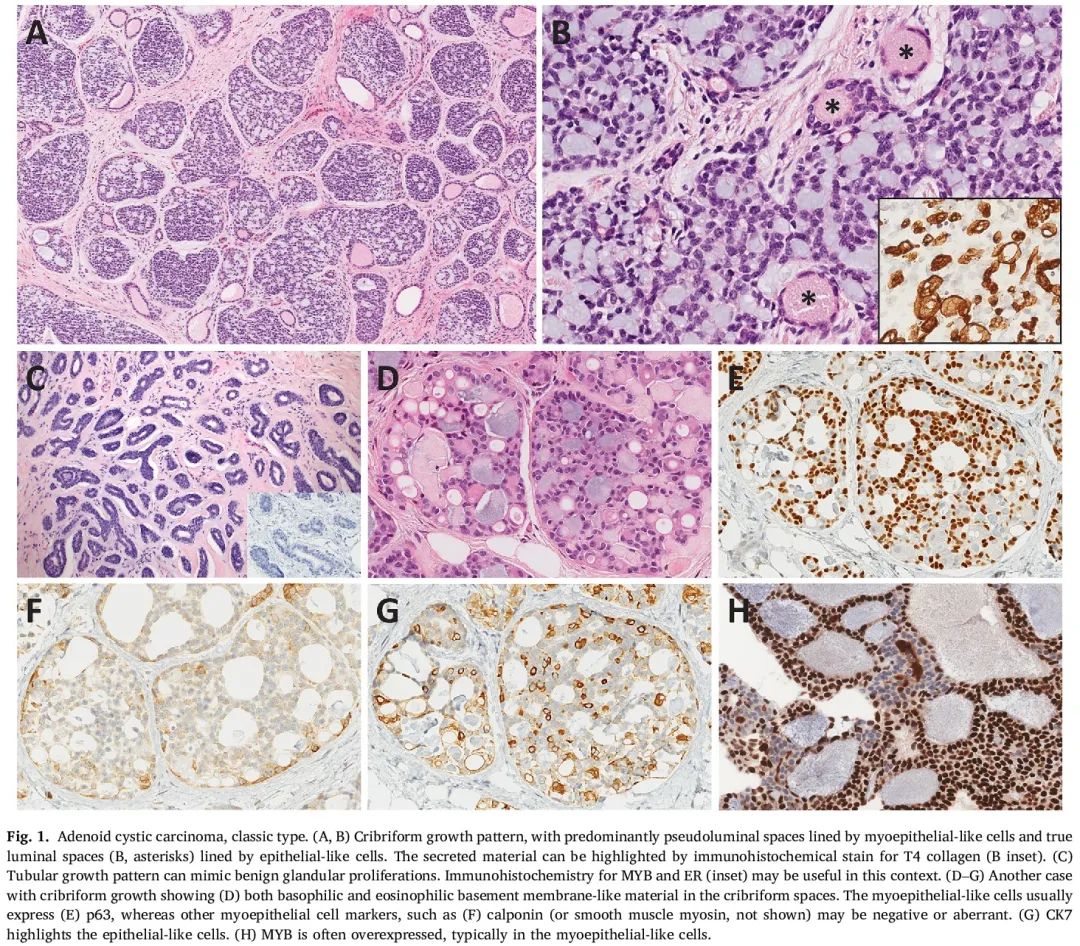
图1
与其他解剖部位的AdCC类似,大多数乳腺C-AdCC存在特征性t(6;9)(q22–23;p23–24)染色体易位,形成 MYB::NFIB融合 基因 。 该融合通过去除下游负调控元素或超级增强子易位,上调致癌MYB蛋白。在缺乏MYB::NFIB融合的AdCC中,MYB过表达可能是由于MYB扩增或者相关MYBL1基因重排所致。MYB和MYBL1重排可以使用荧光原位杂交(FISH)或基于下一代测序(NGS)的方法来检测。MYB过表达可以通过免疫组化和RNA原位杂交进行检测,MYB过表达可能是MYB基因变异的有用替代标志物,在合适的组织病理学背景下,有助于AdCC诊断(图1H)。与TNBC-NST相比,C-AdCC通常基因组较为简单,突变负荷较低,不存在TP53突变。
实性-基底样型腺样囊性癌
与C-AdCC相比,SB-AdCC更少见,更具侵袭性,尽管预后数据有限。由于与基底样TNBC的特征存在重叠,诊断通常具有挑战性。SB-AdCC的特征是特征性黏液样或透明基质背景下,基底样肿瘤细胞形成实性巢状和/或小梁状结构(图2A、B)。与C-AdCC相比,肿瘤细胞通常更大、更多形性,有丝分裂活性较高(图2C、D)。因此,这些肿瘤的分级通常比C-AdCC高(Nottingham分级为2级或3级)。可能存在具有相似特征的基底样原位成分。特征性双细胞群在SB-AdCC中不那么明显,在基底样细胞中有小的嗜酸性导管样结构(闰管)(图2D)。免疫组化染色有助于凸显导管结构,这些结构可能对CK7、CK5/6和/或CAM5.2呈阳性,但不同病例之间染色特征可能有所不同且不可预测。基底样肿瘤细胞通常表达CK7、CK5/6、SOX10、CD117和MYB,对GATA3呈阴性或弱阳性。P63通常为阴性,但可能呈局灶性阳性,分布于肿瘤巢周围(图2E-I)。
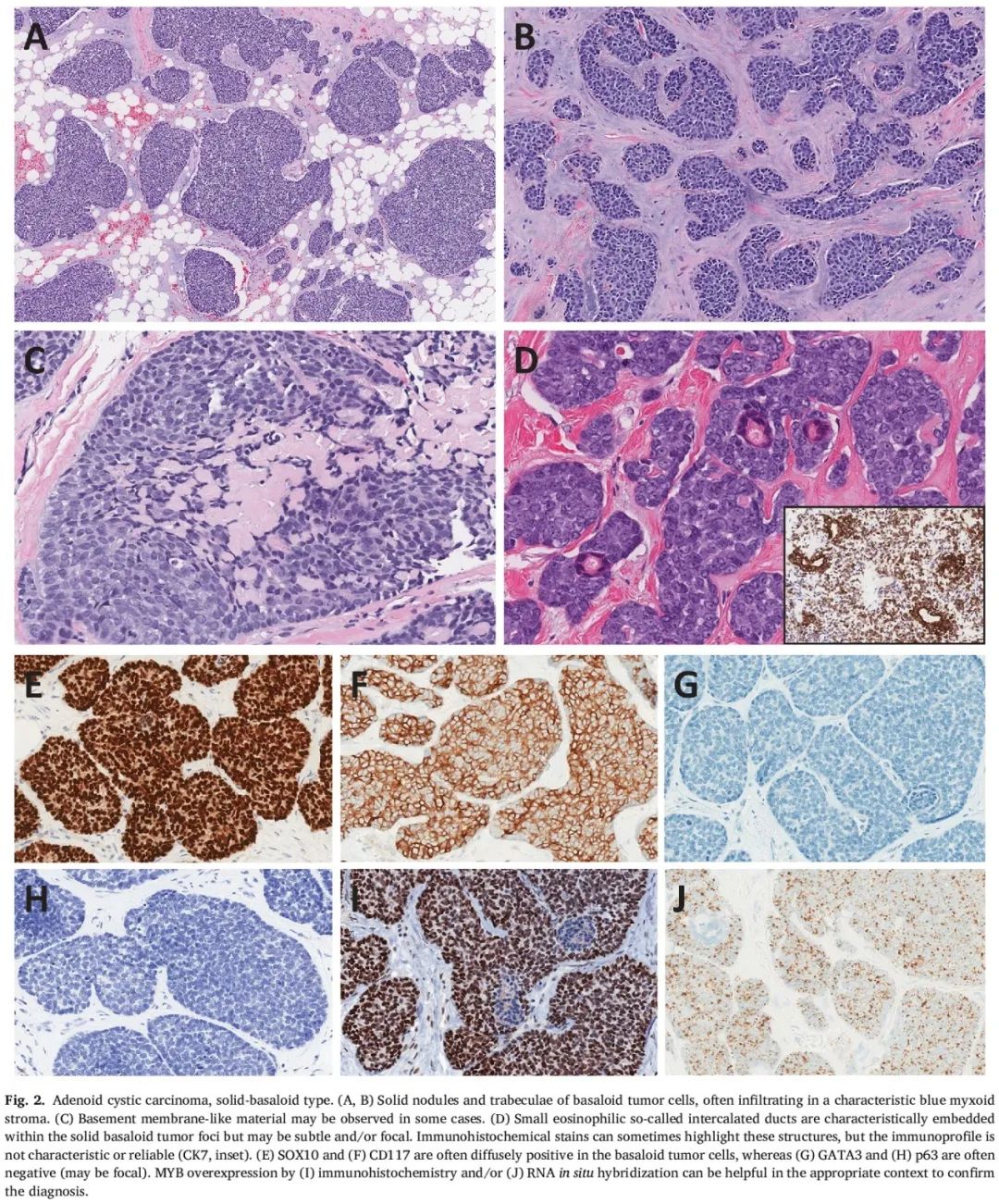
图2
在SB-AdCC中,C-AdCC特有的典型MYB::NFIB融合较少发生(0-21%)。另一方面,观察到其他MYB家族变异,包括新的或未鉴定的 MYB重排以及MYB或MYBL1扩增/拷贝数增加 。通过免疫组化或RNA原位杂交检测MYB过表达可能对诊断有帮助(图2I、J),MYB过表达在SB-AdCC中经常发生,而在TNBC-NST中很少见。MYB免疫组化在穿刺活检样本中可能比切除样本更有用,因为在一些切除标本中,可能由于蛋白半衰期短和固定缓慢而没有中心染色。SB-AdCC经常携带 NOTCH通路(包括NOTCH1、NOTCH2、SPEN)和染色质修饰基因(包括CREBBP)变异 。TP53突变不太常见。除了TP53突变肿瘤外,大多SB-AdCC基因组简单,总体突变负荷较低。这些发现与TNBC-NST形成对比,很多TNBC-NST携带TP53突变且基因组复杂。
AdCC伴高级别转化
AdCC伴高级别转化在涎腺中有很多描述,而在乳腺中极为罕见。当C-AdCC或SB-AdCC混合另一种高级别三阴性癌时,可做出该诊断。已报道的相关高级别癌包括TNBC-NST、化生性癌和小细胞癌。对这些肿瘤的基因分析有限,但在C-AdCC和高级别TNBC成分中都发现了 MYB::NFIB融合 ,后者还存在其他基因异常。
临床行为与管理
C-AdCC通常具有惰性临床行为,预后良好。在基于人群的研究中,5年和10年无复发生存率分别为98%和95%。患者诊断时通常处于早期,很少出现淋巴结转移,远处转移很罕见。这类肿瘤可通过手术切除±前哨淋巴结活检+放疗进行治疗。大多数C-AdCC患者可能不需要化疗。
SB-AdCC被认为更具侵袭性。回顾性研究显示,与C-AdCC相比,SB-AdCC往往分级更高,且似乎具有更高的淋巴结转移率、局部复发率和远处转移率(包括新发转移),疾病特异性生存率也更低。在AdCC中,与不良预后相关的组织学因素包括基底样形态、实性成分占比、坏死、Nottingham分级、淋巴血管浸润和淋巴结受累,这些特征更常与SB-AdCC相关。最近一项研究表明,在多因素分析中,基底样形态与较差的无复发生存率相关。乳腺AdCC最佳的分级方法仍存在争议。一些作者提出纳入实性和/或基底样形态占比的AdCC分级系统,与涎腺癌类似。与C-AdCC不同,SB-AdCC更常采用化疗。然而,治疗反应似乎总体较差,一项研究报道,在接受新辅助化疗的SB-AdCC中,无人达到病理完全缓解。SB-AdCC患者即便接受了化疗,预后仍较差,凸显出需要寻求替代治疗方法,而在这种背景下NOTCH抑制剂是一种有潜力的靶向疗法。
AdCC伴高级别转化的行为和治疗与高级别癌成分有关。
分泌性癌
SC是一种罕见的乳腺癌亚型,占所有乳腺癌的不到0.1%。这种肿瘤最初在儿童中被描述,以前被称为“幼年癌”,在成人中更常见。涎腺类似肿瘤以前被称为乳腺样分泌性癌。
组织学和免疫组化特征
SC由具有丰富的空泡状嗜酸性细胞质和明亮的嗜酸性管腔分泌物的肿瘤细胞组成,其特征是在致密的硬化性基质中呈微囊状巢状和片状排列。其他结构模式包括管状、乳头状和/或实性生长,在许多情况下是混合生长模式。细胞核呈圆形到椭圆形,为低级别到中级别,核仁小,有丝分裂活性低(图3A-E)。因此,尽管也有罕见的高级别肿瘤被报道,但大多数SC为Nottingham 1级或2级。可能存在具有相似形态特征的原位成分。尽管许多SC是三阴性的,但激素受体的低水平表达并不罕见。肿瘤细胞特征性表达S-100、SOX10、mammaglobin和MUC4,通常呈弥漫性分布。GATA3、TRPS1、GCDFP-15和基底角蛋白(CK5/6)也可能呈阳性(图3F-I)。
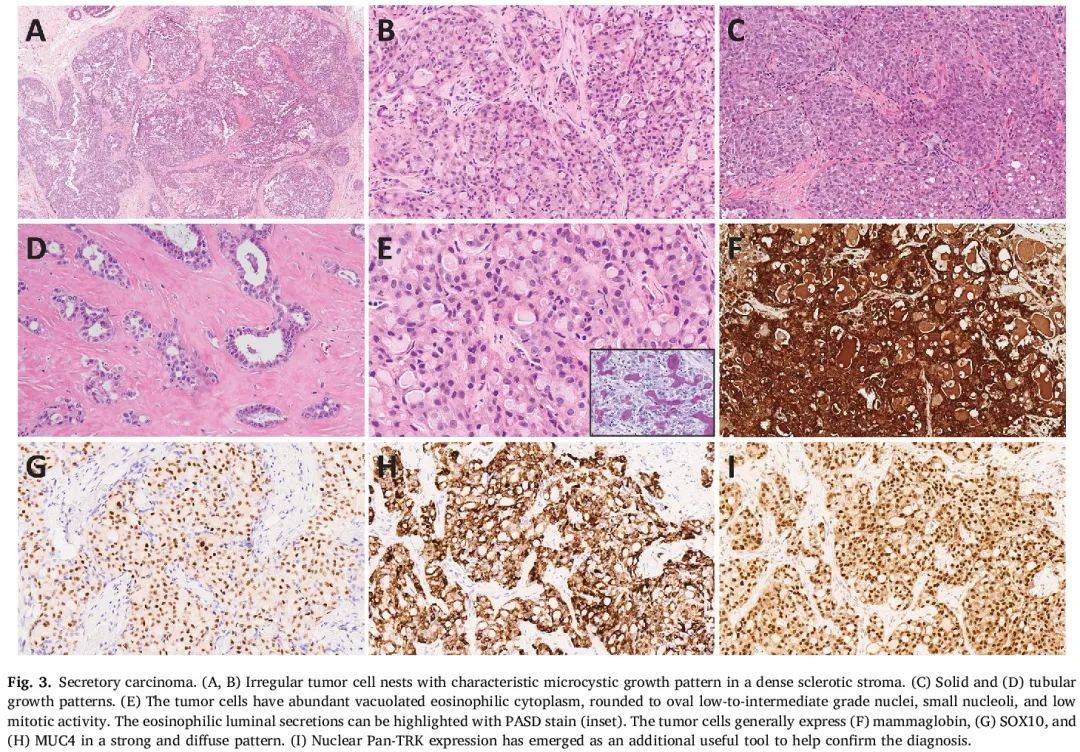
图3
分子病理学
乳腺和涎腺SC的特征是重现性t(12;15)染色体易位,导致形成 ETV6::NTRK3融合 基因 。 ETV6::NTRK3产生一种嵌合蛋白,该蛋白通过磷脂酰肌醇-3激酶(PI-3K)和丝裂原活化蛋白(MAP)激酶通路发出信号,驱动肿瘤发生。ETV6::NTRK3在原位SC中也有报道,被认为是这些肿瘤的早期主要致癌驱动因素。除了罕见的侵袭性肿瘤(见下文)外,到目前为止尚未发现其他致病驱动因素,且肿瘤突变负荷较低。ETV6重排FISH检测对SC灵敏且特异,DNA或RNA NGS也可用于检测这些融合。此外,使用pan-TRK抗体的免疫组化检测可以作为ETV6::NTRK3融合的可靠替代标志物,在适当的情况下,强烈且弥漫的细胞核染色支持SC的诊断。涎腺SC除了ETV6::NTRK3外还存在许多其他融合基因(包括 ETV6与RET、MET和MAML3融合,CTNNB1::ALK和VIM::RET ),而这些在乳腺SC中尚未有描述。一项研究描述了被诊断为乳腺SC的肿瘤存在 TPM3::NTRK1和LMNA::NTRK1融合 ,不过这些肿瘤没有被进一步描述或探索。鉴于已经大量乳腺SC进行了测序,估计假定的其他驱动融合极为罕见。
临床行为与管理
乳腺SC在临床上通常是惰性的,预后良好,5年和10年特异性生存率>90%。高达约15-30%的患者出现淋巴结转移,这些患者通常预后良好。可能出现晚期复发,凸显了长期随访的重要性。极少数患者出现远处转移和死亡,这些患者往往年龄较大,肿瘤体积较大。对这些罕见的侵袭性SC的生物学了解较少,发现了其他基因变异,包括 TERT启动子突变和CDKN2A/B缺失 。
SC的治疗包括切缘阴性的手术切除和前哨淋巴结活检。基于人群的研究显示,在成人SC患者中,放疗的使用较多,不过其疗效尚不确定。关于化疗的数据有限,但一般来说不使用化疗,特别是在淋巴结阴性的病例中。在转移性肿瘤患者中化疗效果不佳。靶向NTRK家族成员的小分子抑制剂,如拉罗替尼和恩曲替尼,在包括乳腺SC在内的TRK融合癌症中显示出良好的效果,或可用于侵袭性病例。
黏液表皮样癌
MEC在涎腺中是最常见的癌类型,而在乳腺中很罕见,在实践中很少遇到。
组织学和免疫组化特征
MEC是实性和/或囊性结节状肿瘤,由多种细胞类型组成,包括中间细胞、表皮样/鳞状细胞和黏液细胞,这些细胞呈大囊状、微囊状/腺状或实性排列(图4)。囊状和腺状间隙内常存在嗜碱性和/或嗜酸性分泌物。可能存在具有相似形态特征的原位成分。黏液细胞通常存在于囊性间隙的中心和管腔面,可能不太明显或呈局灶性,可以通过阿尔辛蓝(Alcian blue)、PASD和黏液卡红染色凸显。中间细胞具有较高的核质比和深染的细胞核,通常沿巢和结节周围分布。表皮样细胞可能类似鳞状细胞,但没有真正的角化。
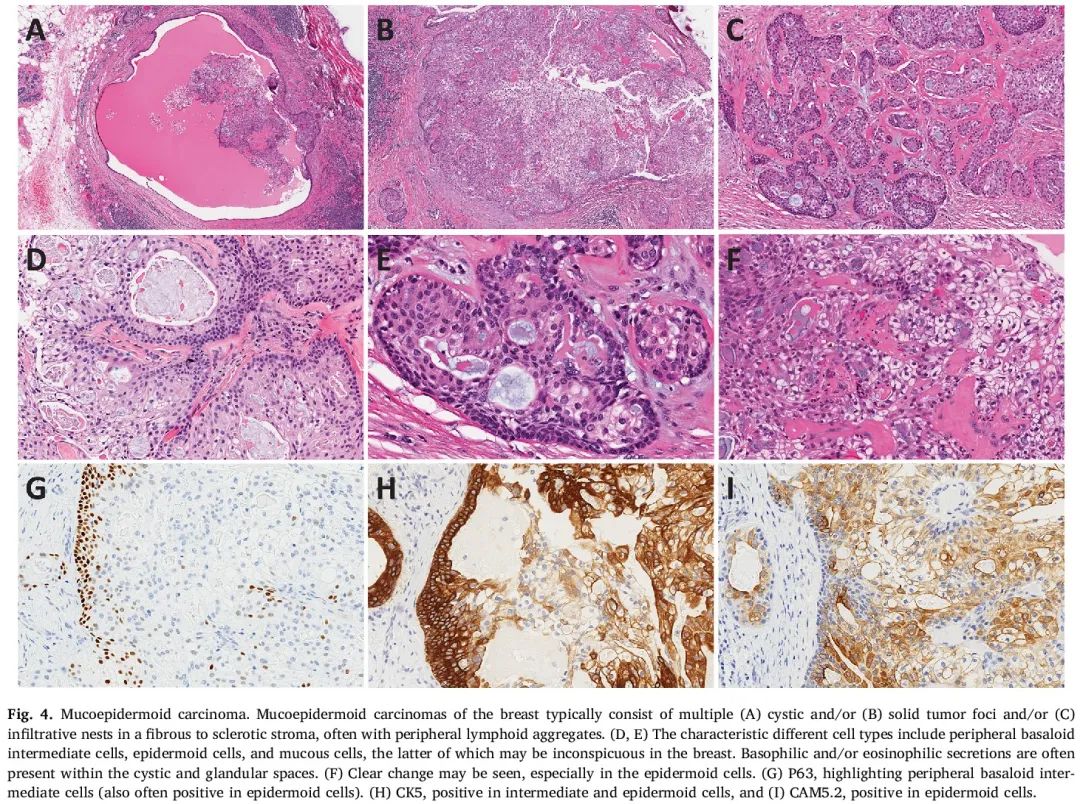
图4
MEC通常为三阴性(ER、PR和HER2表达均阴性),但极少数情况下可能出现ER低表达阳性。免疫组化可以凸显不同的肿瘤细胞群体(图4G-I)。中间细胞通常表达高分子量角蛋白,如CK5/6、CK14和CK17;表皮样细胞表达高分子量和低分子量角蛋白;黏液细胞通常表达低分子量角蛋白。P63在中间细胞和表皮样细胞中呈阳性。SOX10、S-100、MUC4、TRPS1、GATA3和mammaglobin也经常呈阳性,一项研究表明,SOX10表达可能有助于与皮肤汗腺瘤的鉴别诊断,汗腺瘤是一种组织学相似的良性附属器肿瘤,其特征也是CRTC1::MAML2融合。
分子病理学
乳腺和涎腺MEC都存在重现性t(11;19)染色体易位,导致 CRTC1::MAML2融合 基因。在少数病例中检测到 CRTC3::MAML2融合 ,包括1例乳腺MEC。MAML2重排和CRTC1/3::MAML2融合仅在低级别或中级别乳腺MEC中有过描述,在高级别MEC病例中,未进行检测和/或存在诊断不确定性。CRTC1/3::MAML2融合被认为是MEC的主要致癌驱动因素。除了1例融合基因阳性乳腺MEC存在SETD2失活突变外,尚未发现其他致病突变,且基因组简单,肿瘤突变负荷低。这些基因重排可以通过能够检测CRTC1/3::MAML2融合的MAML2 FISH或NGS来检测,这对于确认诊断有帮助。
临床行为与管理
乳腺MEC的预后与组织学分级和分期密切相关。MEC的分级可基于乳腺癌Nottingham系统或涎腺分级系统,在预后判断方面,这两种系统似乎可以互换。低级别和中级别MEC具有惰性的生物学行为,总体预后良好。对已发表病例的回顾发现,低级别MEC中有9%出现淋巴结转移,尚无远处转移或死于疾病的报道。另一方面,被诊断为高级别MEC的肿瘤往往具有侵袭性,47%的病例出现淋巴结转移,40%的病例出现远处转移,42%的病例死于疾病。
目前可用于指导乳腺MEC治疗的数据有限。一般推荐切缘阴性的手术切除。一些病例报告应用了放疗。鉴于淋巴结阴性的低级别肿瘤具有惰性的生物学行为和良好的预后,这类肿瘤可能不需要化疗。
腺泡细胞癌
乳腺AciCC是一种罕见的乳腺癌类型,具有浆液性分化,形态学上与同名的涎腺癌相似。然而,前文所讨论的其他涎腺型肿瘤似乎在发病机制上与其各自对应的涎腺肿瘤相关,而乳腺AciCC在遗传学上与涎腺AciCC不同,且似乎并无关联。
组织学和免疫表型特征
AciCC由多边形肿瘤细胞构成,这些细胞具有丰富的嗜酸性至嗜双色性颗粒状细胞质,细胞核呈圆形至椭圆形,位于中央,有明显的核仁,排列成小的浸润性腺体、实性巢状或实性片状结构(图5A-D)。细胞质颗粒通常较大、粗糙、呈嗜酸性,类似潘氏细胞,能被PASD染色。在某些病例中,细胞质呈透明状改变,颗粒不太明显。细胞异型性和有丝分裂活性通常不显著,在实性区域可能较高。AciCC可能是单纯的,也可能与其他类型的浸润性癌混合,如TNBC-NST或化生性癌(图5I-K)。
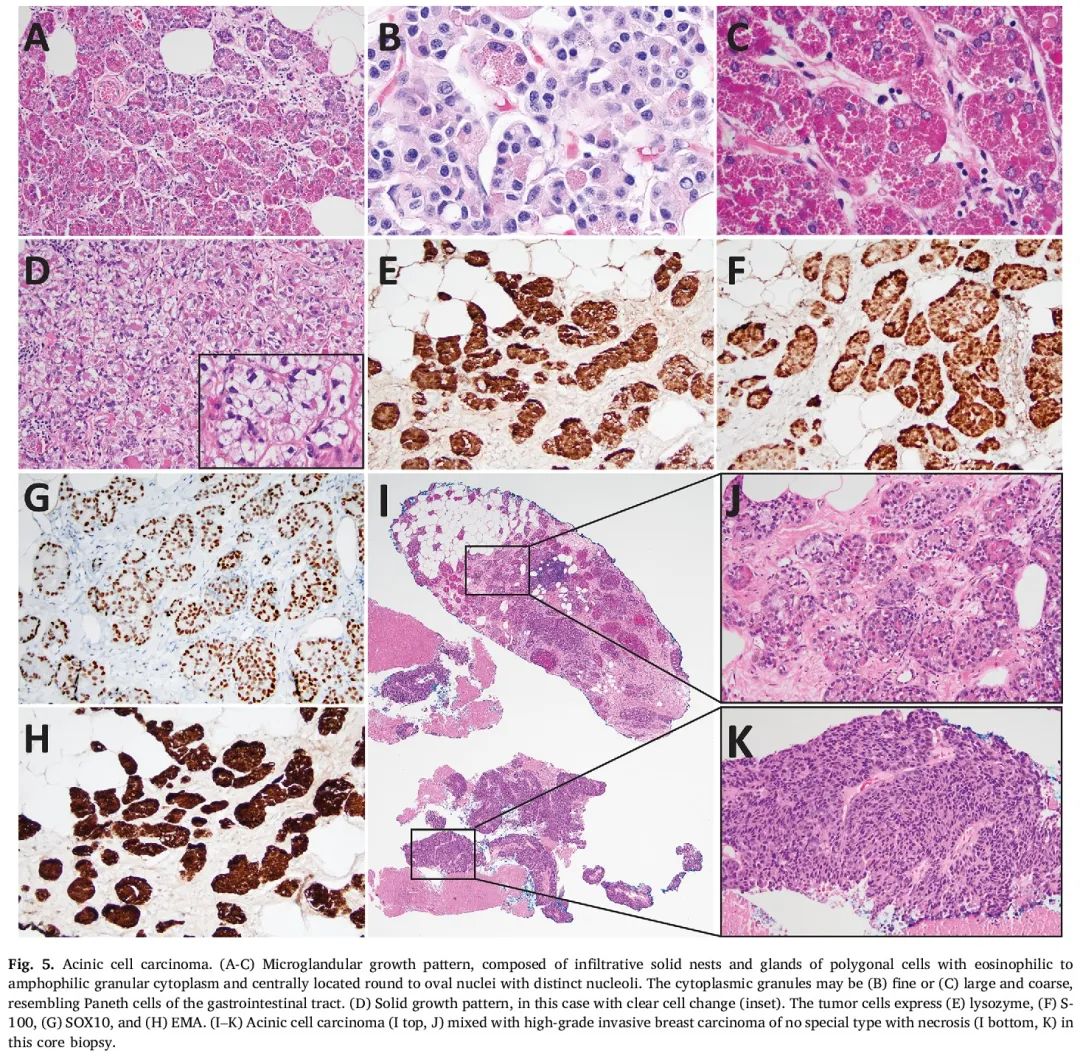
图5
免疫组化方面,肿瘤细胞表达浆液性分化标志物,如淀粉酶、α-1抗胰蛋白酶、α-1抗胰凝乳蛋白酶和溶菌酶,并且对S-100、SOX10和EMA呈阳性(图5E-H)。ER、PR、AR和HER2通常呈阴性,不过也有ER阳性和AR阳性病例的报道。GATA3和GCDFP-15可能呈阳性。形态学特征和免疫表型与微腺性腺病(MGA)和非典型MGA有重叠,这些病变可能难以鉴别。同时存在的MGA和AciCC具有克隆相关性。AciCC是一种独特的肿瘤类型,还是一种起源于MGA的具有腺泡细胞分化的浸润性癌,这一点仍存在争议。这些病变可能存在于低级别三阴性肿瘤的生物学谱中。
分子病理学
涎腺AciCC与重现性t(4;9)染色体易位有关,该易位导致致癌NR4A3蛋白过表达。NR4A3过表达可通过免疫组化检测,可用于辅助诊断涎腺AciCC。另一方面,在乳腺AciCC中,尚未发现t(4;9)和NR4A3过表达。相反,乳腺AciCC在遗传学上具有异质性,经常携带 TP53和PIK3CA基因突变 ,具有复杂的拷贝数谱,这些特征与高级别TNBC-NST更为相似。值得注意的是,AciCC的基因图谱与MGA相似。这些研究结果表明,尽管乳腺AciCC和涎腺AciCC在形态上有相似之处,但二者并无关联,相反,乳腺AciCC与高级别TNBC的关系更为密切。此外,这些数据支持MGA和AciCC属于低级别三阴性肿瘤通路的病变谱系。Guerini-Rocco等人的分析显示,在4例混合癌病例中,2例病例的腺泡细胞成分和高级别非腺泡细胞成分在克隆上相关,在1例病例的高级别成分中发现了额外的体细胞突变。因此,遗传学证据提示,部分乳腺AciCC朝着更具侵袭性的高级别癌发展。
临床行为与管理
关于乳腺AciCC临床行为及预后的信息较为有限。许多学者认为,这类肿瘤具有中等恶性潜能。已发表的病例中,大约四分之一的患者出现腋窝淋巴结转移,通常累及1到2个淋巴结。有少数出现远处转移的病例报道,转移部位包括肺、肝、骨和脑膜,其中一些似乎是含有高级别非腺泡细胞成分的混合癌。这些患者往往预后较差。尽管数据有限,没有高级别特征的单纯AciCC可能预后相对较好,在这种情况下,化疗可能获益不大。另一方面,与其他高级别浸润性癌混合的AciCC生物学行为可能更具侵袭性,与高级别成分相似,因此,应采用针对其他乳腺癌的方案来治疗这类患者。
多形性腺癌
乳腺PAC是一种极为罕见的涎腺型肿瘤,在PubMed参考文献中仅有4例报道。鉴于其罕见性,我们对这类肿瘤及其临床行为的了解有限。
组织学和免疫组化特征
乳腺PAC显示出与其涎腺对应肿瘤相似的组织学特征,其特点是形态单一的细胞呈多种生长模式,包括中心实性巢状结构,周围环绕小梁状、筛状结构、细胞链和单排,后者类似于浸润性小叶癌,通常见于肿瘤周围。肿瘤细胞具有中度多形性圆形至椭圆形细胞核,染色质呈空泡状,核仁不明显,有丝分裂活性较高(每10个高倍视野下有10-12个有丝分裂象)。瘤周基质通常为胶原,可能存在基底膜型物质。已发表的病例为Nottingham 2级。一个病例描述了原位成分。免疫组化显示,PAC表达Bcl-2,并呈现出部分膜E-钙黏蛋白染色模式。CK7表达情况不一,肿瘤周围呈阴性染色。P63在肿瘤细胞中可能呈片状阳性。所有报道的PAC病例均为ER和PR阴性,1例为HER2阴性(最初的3例肿瘤未进行HER2检测)。
分子病理学
常规涎腺PAC通常携带重现性PRKD1(p.E710D)激活热点突变,而筛状亚型(也称为涎腺筛状腺癌,CASG)更常携带涉及PRKD1、PRKD2或PRKD3的基因融合。然而,这些肿瘤之间并非总是能够可靠地区分,肿瘤之间的基因特征似乎存在重叠,部分PAC携带PRKD基因融合,部分筛状腺癌携带PRKD1点突变。仅有1例乳腺PAC进行了测序。未报道PRKD变异或已知的致病突变,虽然没有描述测序panel的细节和融合检测能力。
临床行为与管理
由于报道的PAC病例数量有限,限制了关于其临床行为和治疗的结论。一例患者出现广泛转移,在确诊后3年死亡,其他患者没有或仅有有限的临床随访。
多形性腺瘤
PA是一种双相性肿瘤,软骨黏液样基质中存在上皮和肌上皮腺性成分。PA在涎腺中是最常见的肿瘤,但在乳腺中较为罕见。这些肿瘤在组织学和免疫表型上相似,最近的研究支持至少在一部分肿瘤中存在共同的潜在基因关系。
组织学和免疫表型特征
PA是分叶状肿瘤,边界清楚,由温和的腺性结构和小管组成,它们镶嵌在独特的软骨黏液样基质中(图6A-E)。基质内通常还存在椭圆形、星状和梭形(通常肌上皮样)细胞。基质可能表现出软骨或骨分化。生长模式的多样性是PA的特征。不存在细胞异型性或明显的有丝分裂活性。一些肿瘤的发生与导管内乳头状瘤相关。在涎腺中,PA可能转变为癌(PA起源的癌)。在乳腺中也有少数PA起源的癌病例报道,被描述为三阴性浸润性导管癌和产生基质的化生性癌。
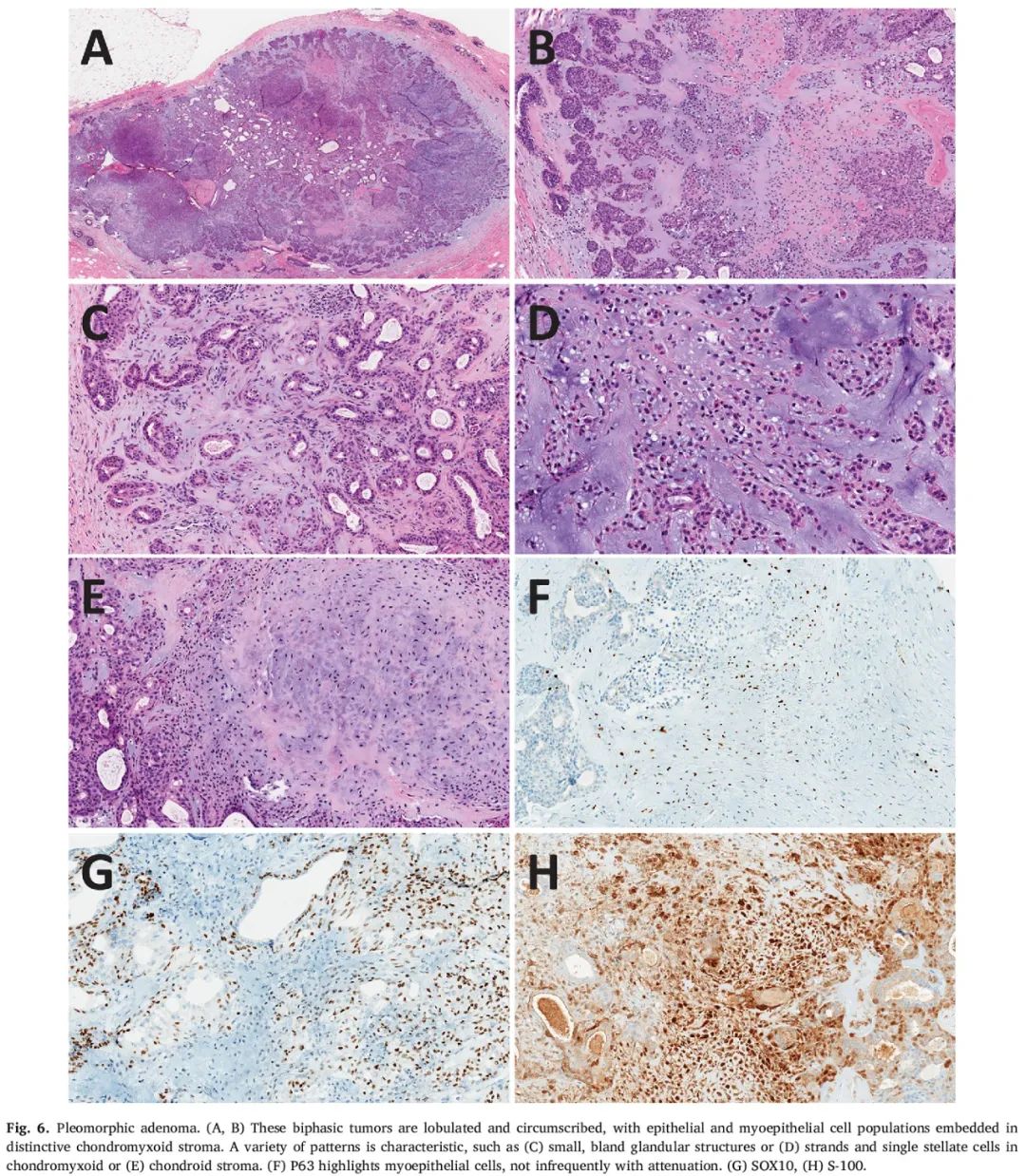
图6
免疫组化可凸显上皮和肌上皮细胞群(图6F-H)。肌上皮细胞标志物(p63、SMM、SMA、S-100、calponin)和CK14在肌上皮细胞中呈阳性,但可能较弱。低分子量角蛋白、EMA和ER在上皮细胞中呈阳性。
分子病理学
涎腺PA的特征是PLAG1或HMGA2重排,导致这两个基因分别与不同的融合伴侣融合。最常见的PLAG1融合伴侣是CTNNB1,其他还有CHCHD7、FGFR1、NFIB和LIFR等。最常见的HMGA2融合伴侣是WIF1和NFIB。在涎腺PA起源癌中也发现了PLAG1和HMGA2重排。这些重排分别通过启动子交换和增强子劫持上调PLAG1和HMGA2蛋白。通过免疫组化检测PLAG1和HMGA2蛋白过表达对诊断可能有帮助。一部分乳腺PA也存在 PLAG1或HMGA2重排 。一项研究分析了三例乳腺PA,在一例肿瘤中发现了 CTNNB1-PLAG1融合 ,在另一个肿瘤中发现了 HMGA2-WIF1融合 ,第三例肿瘤中未发现重排。在另一项研究中,FISH检测显示,5例乳腺PA中有2例存在PLAG1重排,其中一例存在 TRPS1-PLAG1融合 。因此,乳腺PA在基因层面是异质性的,但至少部分乳腺PA与其涎腺对应肿瘤有共同的基因基础。在乳腺PA起源癌中未观察到PLAG1或HMGA2重排,只有两例此类病例进行了FISH和RNA测序。
临床行为与管理
乳腺PA是良性的,治疗包括手术切除肿瘤和周围正常组织。少数患者出现局部复发,可能是由于切除不完全。在这种情况下,并且由恶性转化报道很少,一些研究认为PA是一种恶性潜能未定的肿瘤。在5例乳腺PA起源癌中,没有一例出现腋窝淋巴结或远处转移,不过大多数患者随访时间较短,长期结局不清楚。
腺肌上皮瘤和恶性腺肌上皮瘤
乳腺AME是一种罕见的双相性肿瘤,其特征是小的腺上皮内衬间隙被肌上皮细胞环绕。AME在涎腺中不是一种认定的实体,但乳腺AME在形态学上与涎腺EMC相似,后者是一种低级别肿瘤,总体预后良好。乳腺AME通常为良性,但少数肿瘤可能出现复发或转移,因此认为这类肿瘤恶性潜能未定。AME的上皮和/或肌上皮成分可发生明显的恶性转化(AME伴癌或M-AME)。AME和M-AME通常见于绝经后年长女性。
组织学和免疫组化特征
经典型AME通常是腺体多分叶状双相增殖,内衬上皮细胞和通常更为突出的周围肌上皮细胞(图7A-G)。生长模式包括梭形细胞、管状、分叶状和乳头状。上皮细胞可能呈现出大汗腺、鳞状或皮脂腺分化。肌上皮细胞可为上皮样、梭形、浆细胞样或肌样,并且可能出现透明细胞改变。梭形细胞AME由梭形肌上皮细胞构成,这些细胞挤压上皮腺性结构。管状AME由小导管组成,内衬管腔上皮细胞和腔外肌上皮细胞。分叶状AME表现为在硬化至黏液样基质物质中有主要由肌上皮细胞构成的细胞巢。乳头状AME应与导管内乳头状瘤或导管腺瘤相鉴别,后两者通常肌上皮细胞增殖较少。
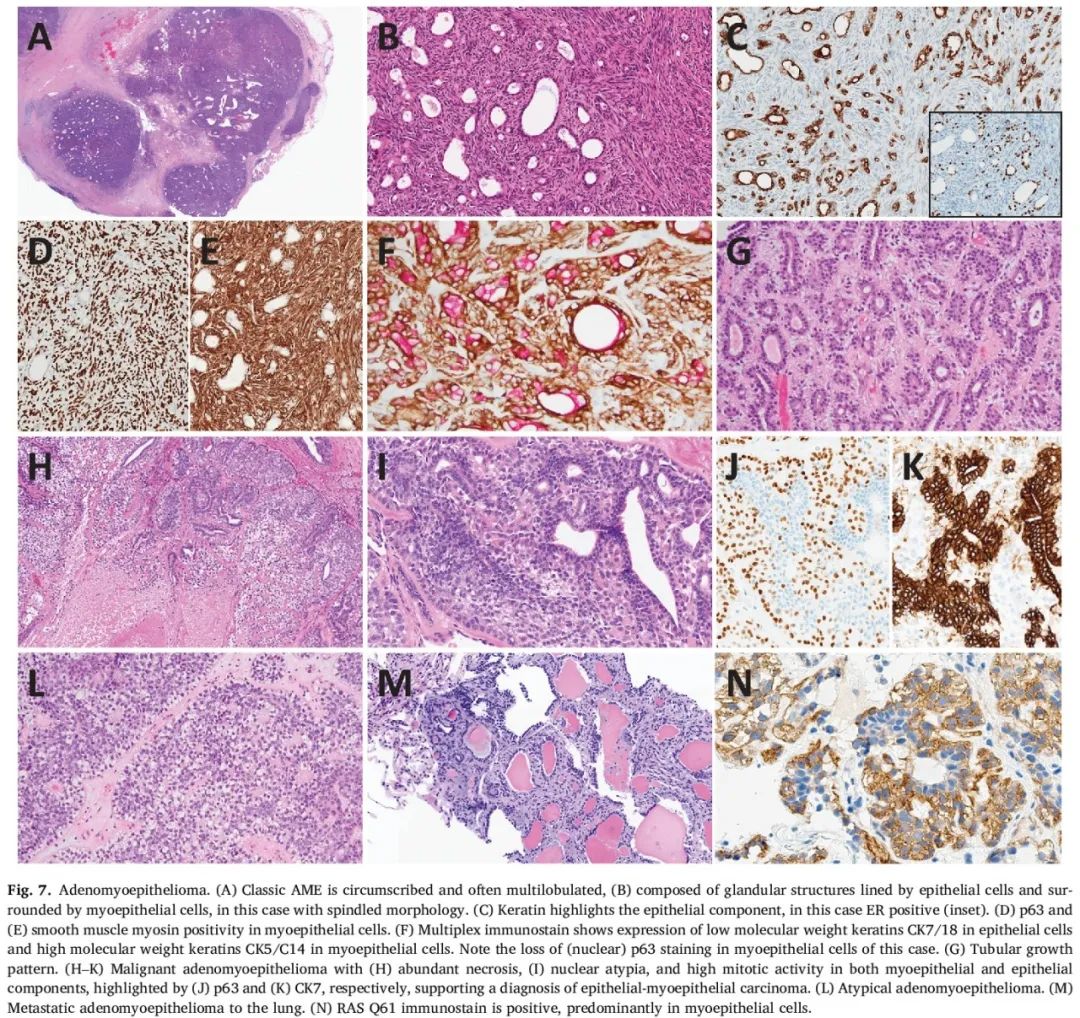
图7
AME可分为经典型、非典型和M-AME,不过这种分类通常较为主观。AME是边界清楚的肿瘤,无或仅有轻度细胞异型性,无坏死,有丝分裂活性低(每10个高倍视野(HPF)下少于3个有丝分裂象)。M-AME通常比AME体积更大,一般呈浸润性,具有明显的细胞核异型性,有丝分裂计数高(>10个/10 HPF),有或无坏死(图7H-K)。Rakha等人提出了一个分类系统,包含3种M-AME亚型:(1)原位AME,指的是起源于AME上皮成分的DCIS;(2)浸润性AME,即起源于AME上皮或肌上皮成分的癌;(3)AME伴浸润,指的是与共存的良性AME相关的另一种类型的浸润性癌(导管型、小叶型、化生性癌)。尽管该分类较为实用,但其临床意义未经过验证。当病变具有中间特征,如有丝分裂象为3-10个/10 HPF,轻度至中度细胞异型性和至多存在局灶性浸润或坏死时,可诊断为非典型AME(图7L)。
免疫组化有助于凸显两种细胞群(图7C-F)。肌上皮细胞表达肌上皮细胞标志物(p63、平滑肌肌球蛋白、calponin),尽管一种或多种标志物的表达可能较弱或缺失,特别是在非典型AME和M-AME中,建议采用一组染色(图7D-F)。上皮细胞对低分子量角蛋白呈阳性,并且可能表达CK/6。E-钙黏蛋白表现出特征性双色染色模式,上皮细胞染色较强,肌上皮细胞染色较弱。AME和M-AME可能ER/PR阳性或阴性,阴性表达与细胞核异型性、坏死和有丝分裂相关。
分子病理学
AME和M-AME经常存在PI-3K通路相关基因 PIK3CA、PIK3R1和AKT1以及HRAS基因突变 。一项研究观察到,大多数ER阳性肿瘤携带相互排斥的PIK3CA或AKT1热点突变,而HRAS p.Q61K/R突变仅限于ER阴性肿瘤,与PIK3CA或PIK3R1突变共存。其他研究在ER阳性AME中也发现了HRAS p.Q61R突变。密码子G12、G13和Q61处的HRAS热点突变也在M-AME中观察到。HRAS Q61突变在EMC中有类似描述,提示这些组织学相似的肿瘤之间存在基因关联。一项研究显示,RAS Q61R免疫组化染色可能有助于识别HRAS p.Q61R突变的AME,对该突变具有较高的特异性,但灵敏度中等(图7N)。
在没有PI-3K或HRAS突变的AME和涎腺EMC中都发现了 HMGA2变异(包括HMGA2-WIF1融合) ,凸显了这些肿瘤的基因异质性,也进一步表明了乳腺AME和涎腺EMC的相似性。此外,许多涎腺EMC存在HMGA2和PLAG1基因重排,这支持EMC通常起源于PA的观点,另外,在一部分乳腺AME中观察到HMGA2重排,提示一些乳腺AME和PA之间的类似关联。
临床行为与管理
经典型AME通常是良性的,切缘阴性的手术切除被认为是治愈性的。极少数没有非典型特征的病例发生转移,导致一些研究将这类肿瘤归类为恶性潜能未定的肿瘤。
M-AME很罕见,而且随访时间短,这限制了我们对其预后和临床管理的了解。据报道,多达约30%的M-AME病例发生转移,肿瘤体积较大(>2 cm)与转移有关。远处转移部位包括肺、骨、脑、肝、皮肤和甲状腺,淋巴结转移相对不常见。有晚期转移的报道。治疗方法包括切缘阴性的手术切除。化疗未显示出有效性。对于具有明显浸润性癌成分的M-AME,或许应该按照确立的乳腺癌方案进行治疗。最近的研究揭示了复发性或转移性M-AME的潜在治疗靶点。例如,在临床前研究中,MEK抑制剂在M-AME来源的异种移植模型中显示出抗肿瘤活性。一例患者使用了微管抑制剂表柔比星,显示出潜在获益。
总 结
乳腺涎腺型肿瘤较为罕见,与对应的涎腺肿瘤在形态学、免疫表型和/或遗传学方面存在重叠,凸显了许多这类肿瘤有着共同的潜在组织发病机制。涎腺型肿瘤在三阴性乳腺肿瘤谱内展现出独特的特征,包括通常惰性的临床行为。将涎腺型肿瘤与其他TNBC进行鉴别诊断尤为重要,以避免过度治疗。特征性基因变异和/或免疫组化替代标志物对于准确诊断和指导恰当的临床管理有着实际应用价值,在某些病例中,可能提示新兴疗法,例如TRK抑制剂用于罕见的侵袭性分泌性癌。
链接:http://www.lewenyixue.com/2024/12/04/%E6%9C%80%E5%85%A8%E7%BB%BC%E8%BF%B0%EF%BC%9A%E4%B9%B3%E8%85%BA%E6%B6%8E%E8%85%BA%E5%9E%8B%E8%82%BF%E7%98%A4%E7%9A%84%E7%BB%84%E7%BB%87%E7%97%85%E7%90%86%E5%92%8C%E5%88%86%E5%AD%90/