【CACA周刊】83期 被绑架的核糖体——肿瘤进展、转移与耐药
本期看点
序言
上期我们聊了细胞生物细胞中的传奇细胞器核糖体,今天我们百尺竿头更进一步,探索一下在肿瘤威胁日渐严重的当下,核糖体如何参与肿瘤进展、转移和治疗耐药,又是如何被“劫持”的。
在鉴定肿瘤细胞中核仁数量和形状的不规则变化时,肿瘤对核糖体的“劫持”行为第一次露出了马脚。由于核仁的功能与核糖体的形成密切相关,我们很容易联想到核糖体的生物发生在肿瘤转化中可能起作用。事实上也是如此,抑制rRNA转录的重要酶RNA Pol I可抑制多种肿瘤细胞的增殖。
核糖体一直以来被认为是保守的,但实际上rRNA变异体在不同细胞中以组织特异性方式选择性表达并导致核糖体异质性。另外,核糖体rRNA可能存在修饰,核糖体蛋白也可能发生化学计量变化、翻译修饰或序列改变,从而使核糖体更好地参与不同的细胞活动。
这种核糖体被称为“特化核糖体”,在肿瘤中则被称为“癌核糖体”。
癌核糖体首先参与了肿瘤进展。
大多数恶性肿瘤具有5S rDNA扩增和45S rDNA缺失成对出现,这显著影响了核糖体的生物发生,与较高的细胞增殖速率和核仁基因表达失控相关。
rDNA修饰的改变也可能触发肿瘤起始或促进肿瘤进展。一些研究已找到原发性乳腺癌、弥漫大B细胞淋巴瘤、急性髓性白血病中rRNA甲基化修饰改变对肿瘤进展的促进作用。
有趣的是,p53也参与了这一过程。p53调控核仁纤维蛋白(FBL)的表达,p53的变异“放纵”FBL从而改变rRNA甲基化标记,引发核糖体功能异常。
核糖体蛋白突变通过改变某些mRNA翻译的优先级而形成促进肿瘤进展的“促癌蛋白质组”,目前主要认为核糖体蛋白突变通过影响蛋白质合成的速率和保真度来影响肿瘤细胞的翻译能力、存活能力以及增殖能力。
在肿瘤转移过程中,肿瘤细胞需要发生关键的上皮-间充质转化(EMT)后从原发肿瘤“逃逸”并入侵转移部位。
EMT是一个在进化上保守的程序,核糖体生物发生的增加是执行该程序所必需的条件之一。
在MCF7乳腺癌细胞中,研究者发现Wnt5a抑制rDNA转录进而抑制了乳腺癌的迁移和侵袭。若在MCF7细胞中掺入外源性核糖体则会显著诱导EMT,并出现以ERα抑制为特征的转分化。这说明了核糖体的数量直接参与了EMT的调控,对于肿瘤转移至关重要。
EMT与表观遗传调控密切相关,其中多梳复合物2的酶催化亚基EZH2是影响肿瘤进展的一个主要表观遗传因子。EZH2同样可以影响核糖体,促进EMT转化。
EZH2调节调控rDNA位点甲基化的lncRNA,抑制核糖体生物发生,进一步揭示了EMT状态、表观遗传调控与核糖体生物发生之间复杂的相互作用。其他一些关键蛋白如RNA Pol I、RPL15、RPL27A、LARP6等也参与了核糖体生物发生从而影响肿瘤转移。
在耐药抵抗中,核糖体也发挥着重要作用。
例如,60S亚基组装因子Bop1的失活为癌细胞提供了抵抗大剂量化疗的生存优势,而核仁素则通过DNA修复提高了神经胶质瘤干细胞对替莫唑胺的敏感性。rRNA修饰蛋白NSUN5的缺失激活适应性翻译程序,促进肿瘤细胞在应激条件下存活。但有趣的是该蛋白的缺失却与良好的临床结果相关。
其他一些rRNA和rDNA加工蛋白参与了肿瘤对辐射的抗性,如NOB1的敲低增强了甲状腺癌细胞对放射的敏感性,减少细胞增殖、抑制细胞凋亡。
随着医学对核糖体参与肿瘤进展、转移和耐药的认识不断深入,RNA Pol I和核糖体生物发生已成为肿瘤治疗的重要靶标。监测核糖体蛋白在预测肿瘤风险、预后以及肿瘤细胞对化疗/放射耐药性方面也具有重要潜在价值。
深入剖析核糖体与肿瘤之间的关系,我们发现核糖体与肿瘤之间存在互作,肿瘤可通过“劫持”核糖体促进其自身发展,一些核糖体疾病也可促进肿瘤风险升高。
核糖体病是一组由核糖体合成异常和核糖体功能失调引起的发育障碍,核糖体病患者罹患恶性肿瘤的风险更大。
Diamond-Blackfan贫血是由核糖体蛋白基因RPS19、RPL5、RPS26和RPL11突变引起的,与白血病和肉瘤等恶性肿瘤的风险升高有关。5q minus综合征的病因是RPS14缺失伴5号染色体长臂缺失,与发生MDS和AML的风险升高相关。Gatti-Lux综合征是由前rRNA加工因子RMRP的突变或缺失导致,与患非霍奇金淋巴瘤和基底细胞癌的风险增加有关。先天性角化不良则与DKC1或NPM1突变相关,与MDS、白血病和头颈部恶性肿瘤的风险增加有关。
纵观全文,我们讨论了核糖体如何驱动肿瘤发生、参与肿瘤进展、促进肿瘤转移和获得治疗耐药。在下一期的CACA周刊中,我们将前往肿瘤“劫持”核糖体实现免疫逃逸的“案发现场”,实地考察这一颠覆性的认知革新。
医术观澜
……
1-
11月13日, Signal Transduction and Targeted Therapy :郑州大学第一附属医院任建庄教授、韩新巍教授公布一项DEB-TACE联合或不联合阿帕替尼治疗不可切除HCC的Ⅲ期研究结果 [1]。
该研究纳入中国12个中心,主要终点是PFS,次要终点是OS、ORR、DCR和TRAE。
研究共随机分组243例患者,分别接受DEB-TACE+阿帕替尼(n=122)和DEB-TACE(n=121)。DEB-TACE+阿帕替尼相比DEB-TACE,mPFS为7.1个月 vs 5.2个月,OS为23.3个月 vs 18.9个月,均显著改善。此外,DEB-TACE+阿帕替尼改善了患者ORR(56.6% vs 38.8%)和DCR(89.3% vs 80.2%)。

相比于只接受DEB-TACE的患者,接受DEB-TACE+阿帕替尼的患者在第二次DEB-TACE期间肝动脉变薄和痉挛发生率升高。常见的阿帕替尼相关TRAE包括高血压、手足综合征、疲劳和腹泻。
整体来看,DEB-TACE+阿帕替尼相比DEB-TACE生存改善,安全性可控。
医谷回声
……
1-
11月1日, Cancer Discovery :清华大学李梢教授提出了基于人工智能的中西医融合肿瘤防治新范式并在胃癌早期防治上取得了示范应用 [2]。
该研究提出了一种基于人工智能的中西医融合研究方法(AI-TWM),其核心在于利用基于生物网络的AI算法系统解析肿瘤发生相关中西医多模态大数据中的诊疗规律,实现肿瘤发生风险的智能预警以及防治中药的精准发现。AI-TWM为中医药和中西医融合防治肿瘤的创新发展提供了重要路径,也为AI时代肿瘤早期防治研究和全球传统医学研究提供了新视角与新思路。
团队利用AI-TWM在胃癌防治上开展示范性应用研究,率先提出“胃癌极早期”这一表征癌变临界状态的全新分期。在此基础上,利用AI-TWM分析方法,系统采集与智能解析50余万例胃炎癌转化中西医临床数据以及典型序贯病例的多组学数据,构建了胃炎癌转化表型-细胞-分子-药物等多层次生物网络,实现胃癌发生风险高精度预判和胃癌极早诊断,发现靶向胃癌极早期网络的药食同源中药,阻断胃癌极早期转化,填补防治空白。
文章同时也提出,“极早期”可能是包括消化道肿瘤在内的多种肿瘤发生的一个共性阶段,构建基于AI-TWM的极早期中西医防治体系将是肿瘤早期防治研究的重要方向,有望形成具有中国原创特色的肿瘤防治新模式,值得进一步深入,具有广阔前景。
2-
11月7日, eClinicalMedicine :北京协和医院向阳教授、蒋芳教授建议针对妊娠滋养细胞瘤的患者预后全球标准FIGO2000预后评分系统进行分化改进 [3]。
FIGO2000是妊娠滋养细胞瘤(GTN)患者预后的全球标准预后评分系统,但该系统在临床实践中存在多个关键局限性,包括对单药化疗耐药性评估不足以及在不合适的临床情况下过度使用等。
研究者根据FIGO2000存在的局限性及近期研究进展,总结了未来需要改进的内容。FIGO2000需要重新考虑系统包含的风险因素,尤其是肺转移、子宫病变等放射学因素。各风险因素的权重分配也需要重新调整,需要大型、同质患者队列使用多变量logistic回归的比值比来确定具体的得分。生殖系统和肺之外的转移的预后意义需要进一步评估。转移的计数标准需要进一步明确。低风险群体的定义需要进一步细化和完善,另外还需引入“超高风险”类别。FIGO2000在复发风险评估上存在缺陷,需要进一步完善。
研究者认为应为不同的临床场景开发多方面的细分模型,建议在FIGO2000的基础上开发预测单药治疗耐药性的模型、评估多药化疗耐药性的模型、预测耐药患者二线或挽救治疗疗效的模型、预测复发或生存的模型。未来,对于GTN患者,应该针对遗传和分子预测因子改进FIGO2000。
3-
11月14日, The Journal of Clinical Investigation :复旦大学附属肿瘤医院余科达教授通过多组学分析发现MAP3K1突变赋予HR +HER2 -乳腺癌免疫异质性 [4]。
HR +HER2 -乳腺癌是常见亚型,面临内分泌治疗耐药以及远处复发等挑战。免疫治疗已初见疗效,但仍处于早期探索阶段。
该研究对351例HR + HER2 - 乳腺癌患者进行多组学分析,发现HR + HER2 - 乳腺癌具有高度异质性的肿瘤免疫微环境。这种免疫异质性与MAP3K1突变有关,具体机制是MAP3K1促进抗原肽转运蛋白1/2的mRNA降解抑制MHC-Ⅰ介导的肿瘤抗原呈递,从而驱动免疫逃逸。在临床前模型中,后生元中的酪胺可以逆转MAP3K1突变诱导的MHC-Ⅰ下调,从而增强免疫疗法的疗效。
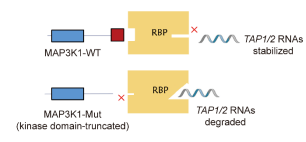
该研究发现了HR +HER2 -乳腺癌免疫异质性的驱动因素,阐明了其分子机制并提供了一种应对策略。
高峰科讯
……
1-
11月5日, Gut :复旦大学附属肿瘤医院虞先濬教授、施思教授发现增强PARPi在胰腺癌中疗效的合成致死新靶标:TPX2 [5]。
PARPi已获批用于携带BRCA1/2种系突变的转移性胰腺癌患者的维持治疗,但BRCA1/2在胰腺癌中罕见。为进一步扩大PARPi在胰腺癌中的应用,研究者通过RNA测序筛选PARPi敏感性的潜在靶标。
研究者发现,TPX2是一个可利用的靶标。TPX2在对PARPi敏感的胰腺癌异种移植模型中下调,抑制TPX2在体外和体内赋予了PARPi合成致死性。TPX2以细胞周期依赖性的方式发挥作用,在S/G2期,磷酸化的TPX2 S634促进BRCA1募集到双链断裂区域进行HR修复,非磷酸化的TPX2则与53BP1相互作用用于非同源末端修复。磷酸化与否的平衡决定了DNA双链断裂的修复通路选择。有丝分裂中磷酸化的TPX2增强Aurora A活性,促进有丝分裂进程,增强染色体稳定性。

研究者用细胞穿透肽靶向磷酸化的TPX2会导致基因组不稳定和有丝分裂灾难,增强肿瘤细胞对PARPi的敏感性。此外,抑制TPX2或其磷酸化与吉西他滨联合使用进一步增强了胰腺癌对PARPi的敏感性。
该研究解释了TPX2控制DNA双链断裂修复途径的机制,为PARPi在胰腺癌的应用拓宽了范围。
2-
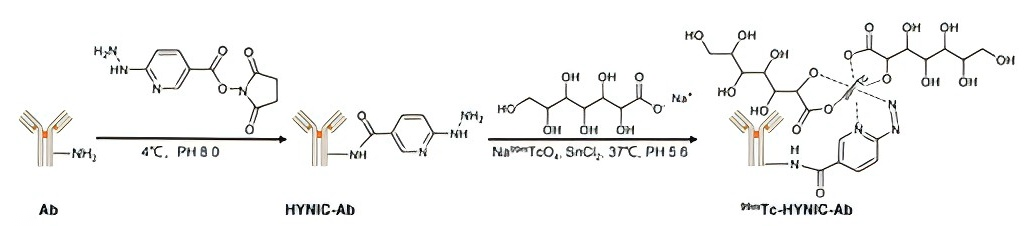
11月8日, Advanced Science :上海市肺科医院何雅億教授、赵丽淑博士和苏州大学高明远教授、曾剑峰教授通过LAG-3和PD-L1核成像对肺癌进行无创免疫分型和免疫治疗监测 [6]。
免疫疗法显著改善了肺癌患者的预后,但因依赖PD-L1等具有时空异质性的单一标志物而具有局限性。
该研究使用99 mTc -HYNIC-αLAG-3探针和99 mTc -HYNIC-αPD-L1探针监测LAG-3和PD-L1肿瘤特异性摄取水平,证明SPECT/CT成像显示的摄取水平与免疫组织化学表达水平呈显著线性相关。双指数成像同时定量LAG-3和PD-L1成功区分了肺癌的四种免疫类型。
本研究证明LAG-3和PD-L1核成像用于无创免疫分型和免疫治疗监测的可行性。
3-
11月11日, Advanced Science :上海浦东医院与中国科学院上海药物研究所研究团队发现MGAT4A/Galectin9驱动的N-糖基化畸变是TP53突变子宫内膜癌预后不良的促进机制 [7]。
新证据表明异常糖基化是肿瘤的恶性特征,但其在子宫内膜癌(EC)特别是伴TP53突变亚型中的作用知之甚少。
该研究确定了在Galectin9存在时MGAT4A通过促进糖代谢增强EC的增殖和侵袭。N-糖蛋白质组学研究进一步揭示了Galectin9结合到葡萄糖转运蛋白GLUT1的MGAT4A上的N-聚糖增加了其在细胞膜表面的分布,导致糖摄取增强。另外,EC细胞中的TP53致癌突变通过扰乱正常TP53的肿瘤抑制miRNA(包括miR-34a和miR-449a/b)进而上调了MGAT4A表达。
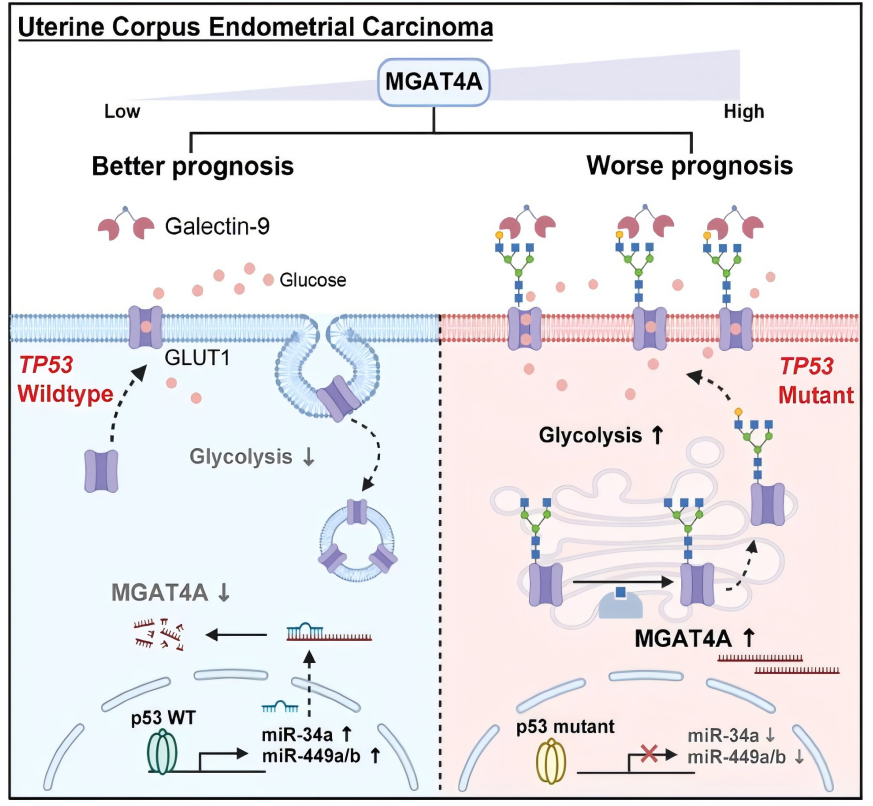
该研究揭示了p53突变驱动的高恶性程度EC在糖代谢中的关键调节因子,为临床治疗提供新靶点。
刊后语
大风泱泱,大潮滂滂;大道如砥,医者无疆。
积跬步以至千里,每一期周刊都是恶性肿瘤学科发展的剪影;积小流以成江海,一年周刊浓缩肿瘤领域各科前沿进展的精华!关注CACA周刊,带你领略恶性肿瘤学科发展的四季花开。
CACA周刊,我们下周不见不散!
编辑 | 李瑞源
排版 | 晓晓
审核 | 李瑞源
链接:http://www.lewenyixue.com/2024/12/04/%E3%80%90CACA%E5%91%A8%E5%88%8A%E3%80%9183%E6%9C%9F%20%E8%A2%AB%E7%BB%91%E6%9E%B6%E7%9A%84%E6%A0%B8%E7%B3%96%E4%BD%93%E2%80%94/






赶快来坐沙发