STTT | 北协和赵宏课题组揭示结肠癌肝转移新机制:TRPS1基因突变的关键作用
撰文:图图
IF : 40.8
推荐度: 
亮点:
该研究通过单细胞全外显子测序技术,揭示了结肠癌肝转移中 TRPS1 基因突变的关键作用。此外还通过全面的多组学分析验证了 TRPS1 基因突变的结直肠癌患者与结肠癌几种关键分子亚型之间的关系。这一发现不仅深化了对结肠癌转移过程的理解,增强了研究结果的可信度,也为未来的精准治疗提供了新的潜在靶点。
近日, 中国医学科学院北京协和医学院赵宏教授团队 在 国际知名期刊 《 Signal Transduct Target Ther 》 发表了题为: Single-cell exomesequencing reveals polyclonal seeding and TRPS1 mutations in colon cancermetastasis 的研究文章。
肝转移仍然是结肠癌患者死亡的主要原因,鉴定导致转移的特定驱动基因突变可能提供可行的治疗靶点。为了探索转移内的克隆进化和遗传异质性,因此本研究对一名 IV 期结肠癌患者的原发肿瘤、肝转移和淋巴转移中分离的 150 个单细胞进行了单细胞外显子组测序,进一步揭示驱动结肠癌肝转移发展的潜在机制。
研究设计
本研究首先对一名 76 岁男性 IV 期结肠患者的原发肿瘤、肝转移和淋巴转移中分离的 150 个单细胞进行了单细胞外显子组测序的,并通过计算同一组织内每对单细胞之间的相似性来分析组织内的肿瘤异质性。随后通过单细胞转录组分析还揭示了 EMT (上皮 - 间质转化)评分和 CNV (拷贝数变异)评分与多克隆转移之间的关联,并在体内外实验中证实。最后在更多的结肠癌病例中检测到进一步的 TRPS1 突变驱动结肠癌肝转移发展的潜在机制。
1. 对单细胞进行聚类和 PCA 分析
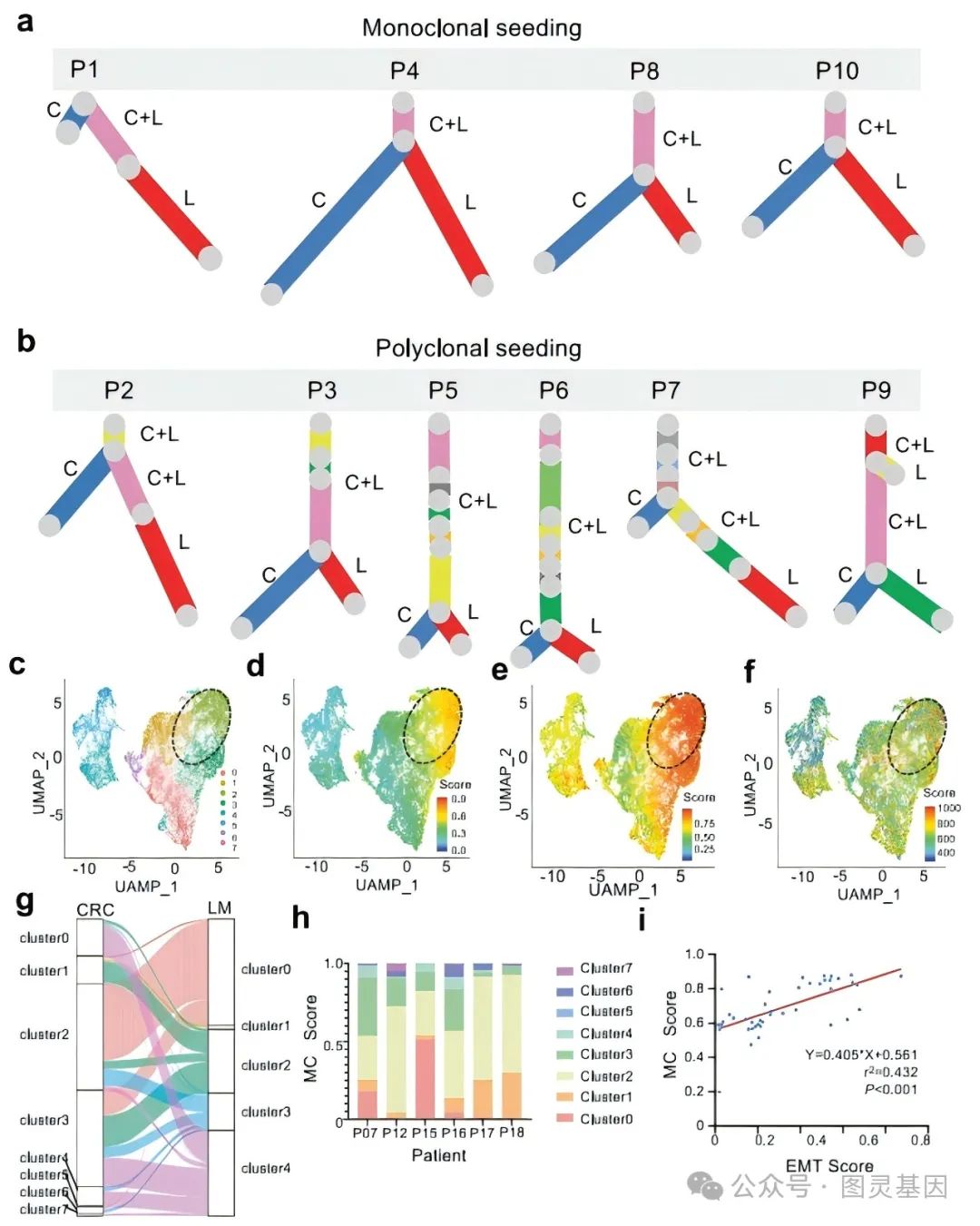
图 1. IV 期结肠癌患者的腺瘤、原发性结肠癌和转移组织的聚类和进化分析
该研究对来自肿瘤、腺瘤和正常细胞的单细胞外显子组测序数据进行了聚类和 PCA 分析。根据肿瘤细胞突变将肿瘤和正常组织分为四组:非肿瘤、腺瘤、原发肿瘤和肝转移以及淋巴转移。来自正常血液和结肠、原发肿瘤和肝转移的细胞聚集在一起,但与淋巴转移细胞相比,显示出不同的聚集模式(图 1A )。随后为了确定在 PCA 分析中能够将细胞区分为不同群组的遗传特征,使用无监督分层方法对有突变的单细胞进行了聚类,结果确定了每种组织类型中最特殊的突变(图 1B ),并阐明了该结肠癌病例的克隆演化过程(图 1C )。
2. 原发性和转移性组织的组织内异质性
图 2. 基于单细胞突变景观的原代组织和转移组织的组织内异质性
该研究测序结果揭示了肿瘤样本的遗传图谱,明确指出淋巴转移和肝转移均源自于原发肿瘤的同一区域。接下来通过计算同一组织内每对单细胞之间的相似性来分析组织内的异质性。结果发现肝转移和淋巴转移瘤的异质性都高于原发肿瘤。在分析原发肿瘤的四块组织中,结肠 1 区域在异质性的值和分布方面与两块转移组织有部分相似,而结肠 5 区域与肝脏和淋巴转移组织的相似度最高(图 2 )。这些结果与之前的分析一致,表明转移组织来源于原发肿瘤结肠 1 和结肠 5 区域中的肿瘤细胞。
图 3. 10 例转移性结肠癌中的亚克隆结构和 6 例 CRLM 患者的原发性 CRC 和匹配肝转移样本的单细胞 RNA-seq 分析
因此转移瘤中的异质性与原发肿瘤中特定区域的异质性相似,而不是由于血液中 CTC 的聚集而导致异质性更高,或由于单细胞播种而导致异质性更低。对 10 例结肠癌原发肿瘤和肝转移肿瘤的外显子组进行进一步分析后发现,其中 6 例存在多克隆播种现象(图 3 )。随后比较了单克隆组和多克隆组结直肠癌患者的临床信息,结果发现两者在 T 分期上存在显著差异,多克隆组中 T3 期的比例较高,单克隆组中 4a 、 4b 期的比例较高。综上表明,肝脏和淋巴转移起源于多克隆来源的循环肿瘤细胞( CTC )簇,而不是来自原发肿瘤的单个细胞。
为了进一步验证多克隆播种,对 6 名 CRLM 患者的原发性 CRC 和匹配的肝转移样本进行了单细胞 RNA 序列分析,分别获得了 8 个和 5 个癌症亚组(图 3C )。结果发现第 2 组和第 3 组的转移贡献得分( MC 得分)明显高于其他组(图 3D )。因此计算了不同亚组的 EMT 得分,发现 MC 得分高的集群也表现出较高的 EMT 得分(图 3E )。这表明 EMT 相关基因表达量高的多克隆肿瘤细胞更有可能从原发部位扩散到肝脏。
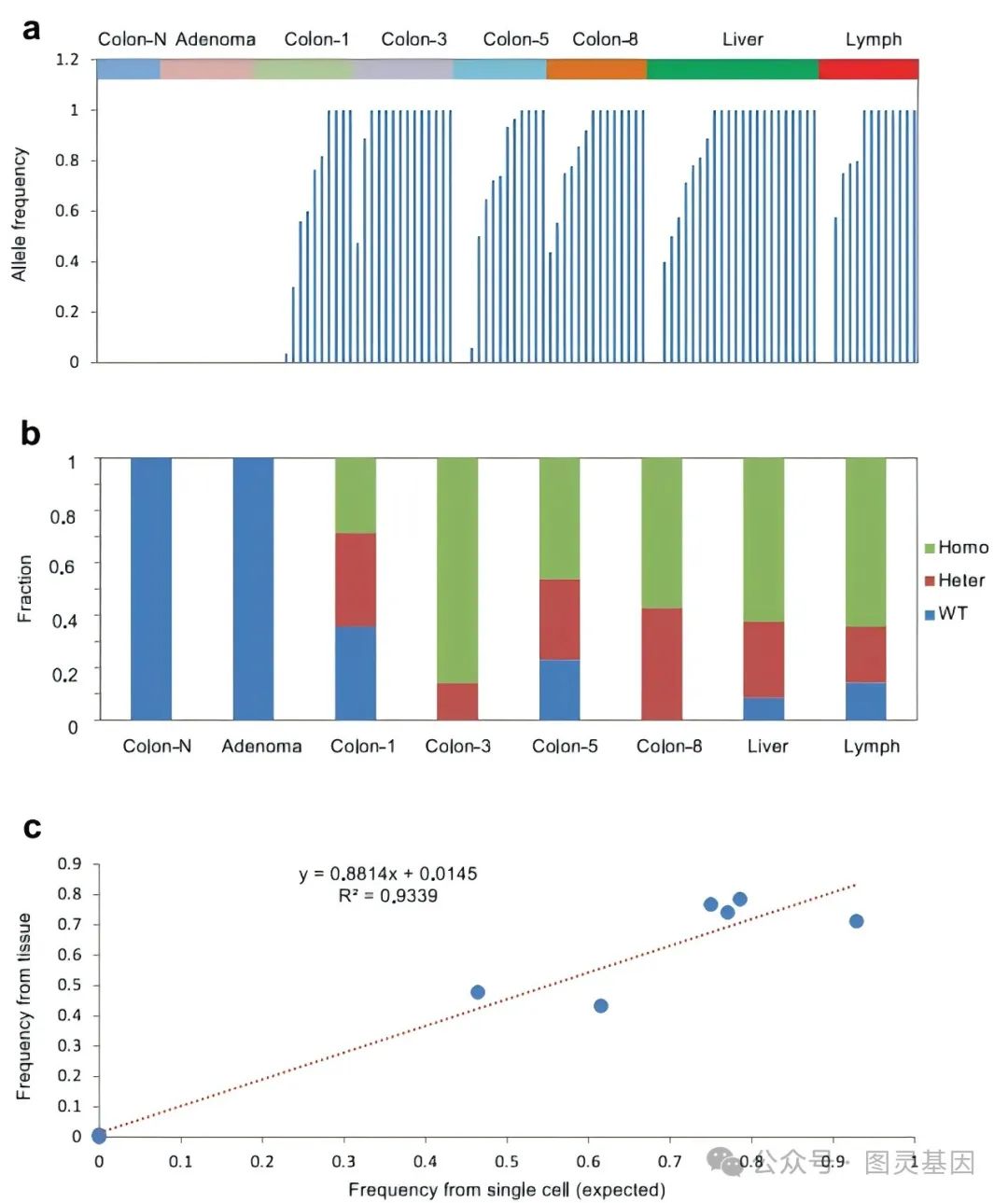
图 4. 基于 APC 突变状态的原代组织和转移组织的组织内异质性
为了验证所有突变统计所估计的异质性,重点分析了 APC 基因的突变状态。相比之下结肠 1 、 5 和两个转移组织的 APC 突变状态显示出更大的异质性(图 4 )。此外还结合了特定组织中单个细胞的突变状态,评估了 APC 突变的突变分数。值得注意的是这些 APC 野生型单细胞与突变型细胞显示出不同的突变状态。这表明组织迁移可能涉及的不仅仅是单个细胞,而是包括 APC 野生型和突变型细胞在内的细胞群。
3. TRPS1 R544Q 突变促进结直肠癌体外和体内转移
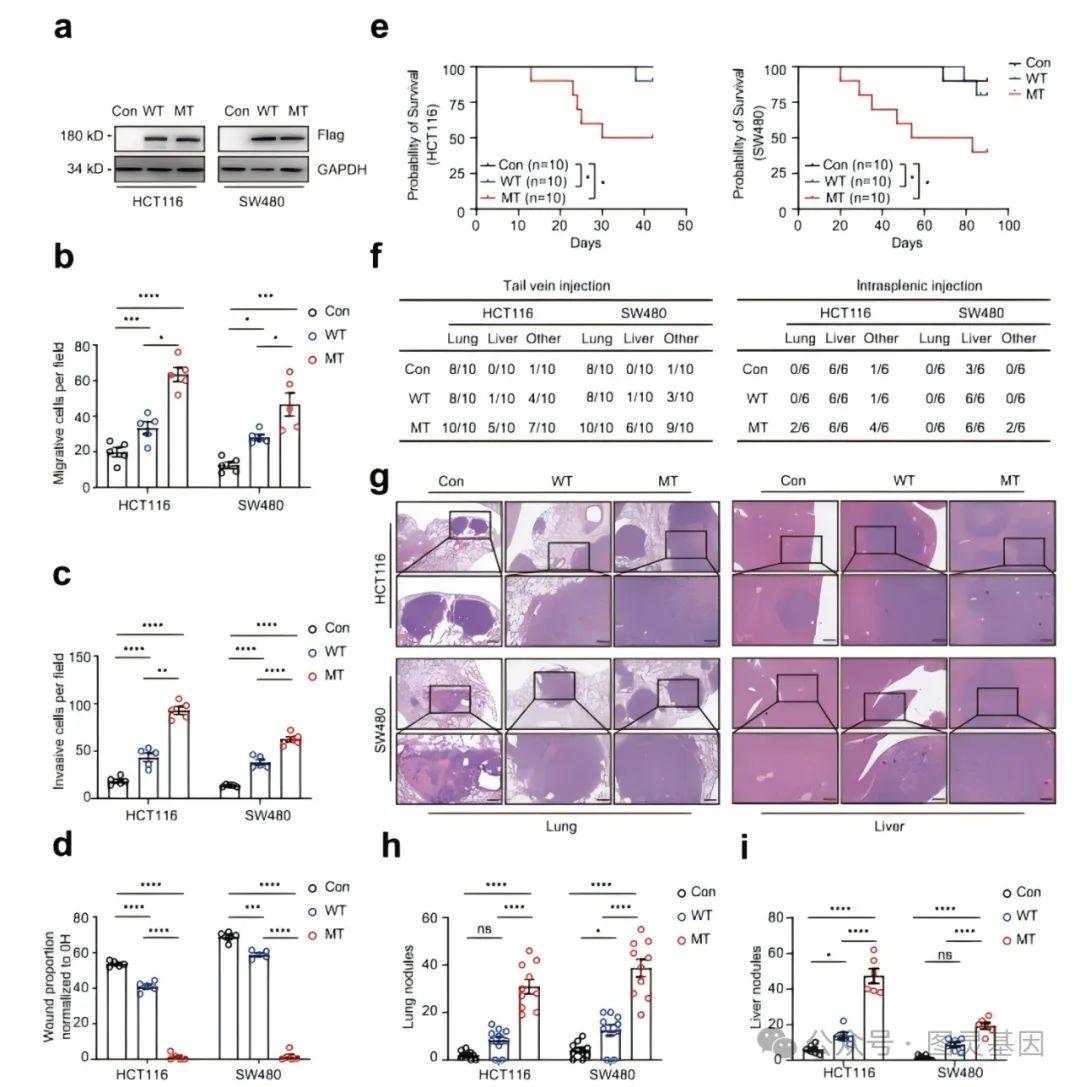
图 5. TRPS1R544Q 突变在体外和体内促进结直肠癌细胞转移
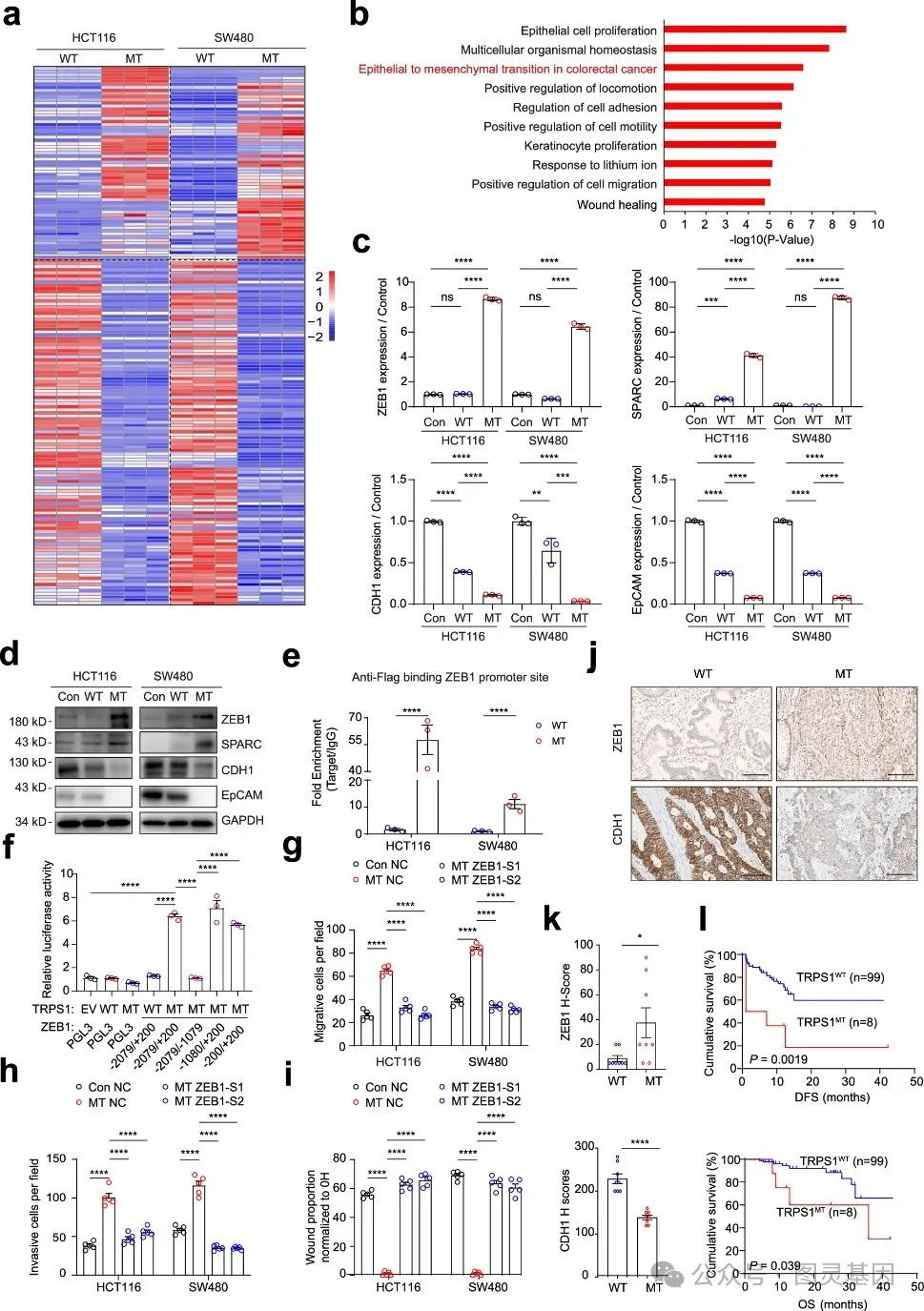
接下来本研究构建了稳定异位表达野生型和突变型 TRPS1 的 HCT116 和 SW480 细胞,在体外迁移和侵袭试验中检测了突变体 TRPS1 的远处器官归巢潜能。结果表明 TRPS1-MT 组的转移能力是 TRPS1-WT 组的 2 至 3 倍,是对照组的约 3 至 5 倍(图 5 )。
为了检测 TRPS1-MT 在 HCT116 和 SW480 细胞中的转移潜力,分别通过尾静脉注射和脾内注射建立了肺转移和肝转移小鼠模型。对肺部(尾静脉注射)和肝脏(脾内注射) H&E 染色显示, TRPS1-MT 组的结节数量是 TRPS1-WT 组的 3 至 5 倍,而对照组的结节数量相对较少。 Ki67 染色显示, TRPS1 突变在肝转移灶中表现出明显的细胞增殖。荧光素酶标记的 HCT116 细胞在 TRPS1 突变体过表达后也观察到类似的转移结果。综上所述, TRPS1 R544Q 突变增强了 HCT116 和 SW480 细胞在体外和体内的转移,其作用机制涉及 TRPS1(R544Q)/ZEB1 信号轴。
4. TRPS1 突变体( R544Q )通过与 ZEB1 的启动子区结合促进上皮到间充质的转化
图 6. TRPS1 突变体( R544Q )通过 ZEB1 促进结直肠癌细胞转移
为了研究 TRPS1 R544Q 突变介导 CRC 转移的分子机制,接下来对改造后的 HCT116 和 SW480 细胞进行了大量 RNA 测序。分析结果显示, HCT116 和 SW480 TRPS1-WT 细胞与 TRPS1-MT 细胞共有 172 个差异表达基因( DEGs )。与 TRPS1-WT 或对照细胞相比, qRT-PCR 分析显示 ZEB1 和 SPARC 上调, CDH1 和 EpCAM 下调(图 6 )。 WB 分析证实了这些结果。相反敲除 TRPS1 会导致 ZEB1 和 SPARC 的表达减少,而 CDH1 和 EpCAM 的水平得到恢复。
由于 TRPS1 是一种主要位于细胞核内的转录因子,对 TRPS1-WT 和 TRPS1-MT 细胞进行了靶标下裂解和标记( CUT&Tag )测序分析,以确定 TRPS1 的全基因组结合位点。结果显示,与 TRPS1 突变相关的各种 EMT 基序富集。通过 ChIP-qPCR 进一步验证了 TRPS1-MT 与 ZEB1 和 EpCAM 启动子的结合。因此 ZEB1 被认为是 TRPS1-MT 在 CRC 肝转移中的一个关键靶点。随后检测了敲除 ZEB1 对 TRPS1-MT 细胞迁移、侵袭和伤口愈合的影响,结果表明敲除 ZEB1 能显著抑制 TRPS1 R544Q 突变体诱导的细胞迁移和侵袭。
接下来对基因组测序的原发性人类结直肠癌组织进行了免疫组化( IHC )染色,以评估 ZEB1 、 CDH1 和 TRPS1 突变之间的相关性。结果表明与 TRPS1 野生型样本相比, ZEB1 在 TRPS1 突变的 CRC 组织中表达明显,而 CDH1 在 TRPS1 突变的 CRC 组织中表达减弱。随后,我们分析了 107 例 CRC 肿瘤中 TRPS1 突变状态与病理分期的相关性。结果显示, TRPS1 突变与 M1 期之间存在明显关联。更重要的是, Kaplan-Meier 生存分析显示, TRPS1 突变与无病生存期( DFS )差和总生存期( OS )差密切相关,突显了其在 CRC 患者中的预后相关性(图 6 )。
总的来说,这些结果表明, TRPS1 突变通过激活 ZEB1 表达显着促进结直肠癌转移,从而增强上皮到间充质的转化,这种机制途径最终导致 CRC 患者预后不良。
5. 讨论与总结
本研究中只分析了一名患者的样本,因此由于个体特异性因素存在固有的局限性,这限制了研究结果的普遍性,无法直接对单个样本进行完美分类,但进一步研究了 TRPS1 基因突变的结直肠癌患者与结肠癌几种关键分子亚型之间的关系,通过全面的多组学分析验证了发现。
首先在单细胞基因组规模上,对来自 9 个组织样本的 150 个细胞进行了外显子组测序。其次在大基因组水平上,对原发性结肠肿瘤进行了全外显子组测序,并匹配了 10 名患者的肝转移组织,证实了肝转移源于原发肿瘤多克隆接种的理论。第三在单细胞转录组水平,分析了 6 例患者的原发性结肠癌和匹配转移组织的转录组测序数据。
研究结果表明,表现出 EMT 相关基因表达升高的肿瘤细胞更容易从原发部位传播并在肝脏中建立,从而加强了研究结论。这种多方面的方法不仅增强了研究结果的可信度,还强调了癌症转移的复杂性,提供了对肿瘤传播的更深入理解和确定潜在的治疗途径。
总之该研究对结肠癌患者从原发肿瘤和转移部位获得的大量单细胞进行了全面的遗传分析。单细胞水平分析能够比较不同组织的遗传景观,并检查每个样本中的组织内异质性。结果支持肝脏和淋巴转移都来源于原发肿瘤内的特定区域的模型,并涉及独立多克隆细胞簇的迁移。最后 TRPS1 可能通过增强上皮 - 间充质转化来促进结肠癌中的转移性多克隆接种。
教授介绍
赵宏,主任医师,硕士生导师, 2003 年毕业于中国协和医科大学 ( 八年制 ) 获医学博士学位。现任中国医学科学院肿瘤医院肝胆外科副主任。专业方向:结直肠癌肝转移、神经内分泌肿瘤、肝细胞肝癌的外科治疗。
参考文献
Cai J, Zhang W, Lu Y, Liu W, Zhou H, Liu M, Bi X, Liu J, Chen J, Yin Y,Deng Y, Luo Z, Yang Y, Chen Q, Chen X, Xu Z, Zhang Y, Wu C, Long Q, Huang C,Yan C, Liu Y, Guo L, Li W, Yuan P, Jiao Y, Song W, Wang X, Huang Z, Ying J,Zhao H. Single-cell exome sequencing reveals polyclonal seeding and TRPS1mutations in colon cancer metastasis. Signal Transduct Target Ther. 2024 Sep23;9(1):247. doi: 10.1038/s41392-024-01960-8. PMID: 39307879; PMCID:PMC11417107.
链接:http://www.lewenyixue.com/2024/12/03/STTT%20%7C%20%E5%8C%97%E5%8D%8F%E5%92%8C%E8%B5%B5%E5%AE%8F%E8%AF%BE%E9%A2%98%E7%BB%84%E6%8F%AD%E7%A4%BA%E7%BB%93%E8%82%A0%E7%99%8C/









赶快来坐沙发