Nat Cancer | RAS•GTP复合体通过促进核蛋白出核驱动癌症
美国国立卫生研究院( NIH )的科学家及其合作者表示,他们发现了一种新的途径,即 RAS 基因(在癌症中常见的突变基因)可能会驱动肿瘤生长,而不只是在细胞表面发挥众所周知的信号传导作用。
根据研究人员在《 NatureCancer 》杂志上发表的文章“ Thepro-oncogenic noncanonical activity of a RAS•GTP:RanGAP1 complex facilitatesnuclear protein export ”,突变 RAS 有助于启动一系列涉及特定核蛋白转运的事件,导致肿瘤生长失控。
RAS 基因是癌症中第二常见的突变基因,而突变的 RAS 蛋白是一些最致命癌症的关键驱动因素,包括几乎所有的胰腺癌、一半的结直肠癌和三分之一的肺癌。几十年的研究表明,突变的 RAS 蛋白通过激活细胞表面的特定蛋白质,产生持续的信号流来告诉细胞生长,从而促进肿瘤的发育和生长。
“这是第一项表明突变的 RAS 基因能够以一种全新的方式促进癌症的研究。”研究作者、美国国立卫生研究院国家癌症研究所( NCI )副所长 Douglas Lowy 医学博士说,“ RAS 蛋白的额外作用的发现对改善治疗具有令人兴奋的意义。”
研究人员认为,他们的工作可能对治疗 RAS 引发的癌症具有潜在的应用价值。他们已经开始研究 RAS 的这种功能在胰腺癌中的作用,特别是因为这种类型的癌症很少有有效的治疗方法。
阻断突变 RAS 蛋白的药物被用于癌症治疗只有几年的时间,并且已经被 FDA 批准用于治疗肺癌和肉瘤。尽管他们的开发取得了重大的科学成功,但迄今为止, RAS 抑制剂对患者预后的影响有限,大多数患者的生存期仅延长了几个月。
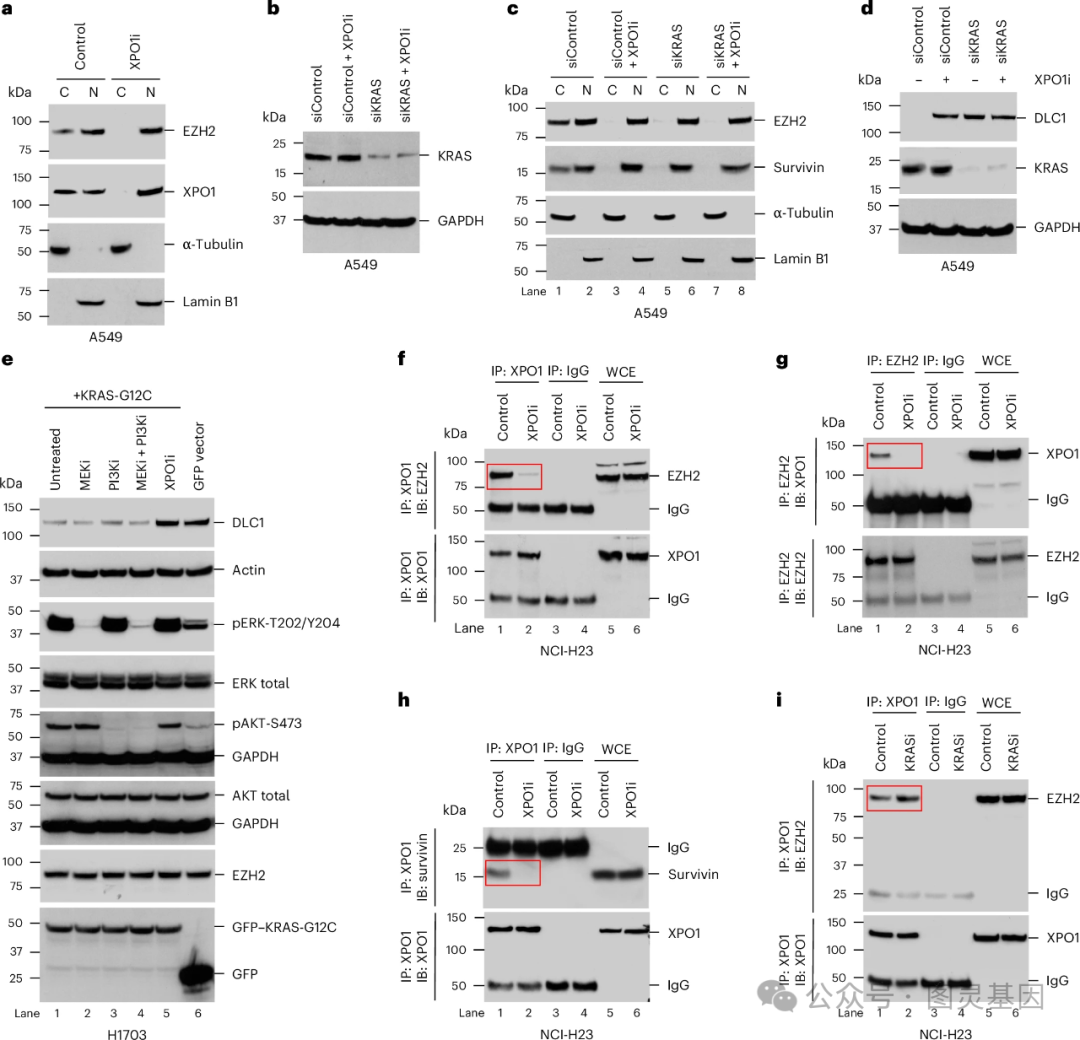
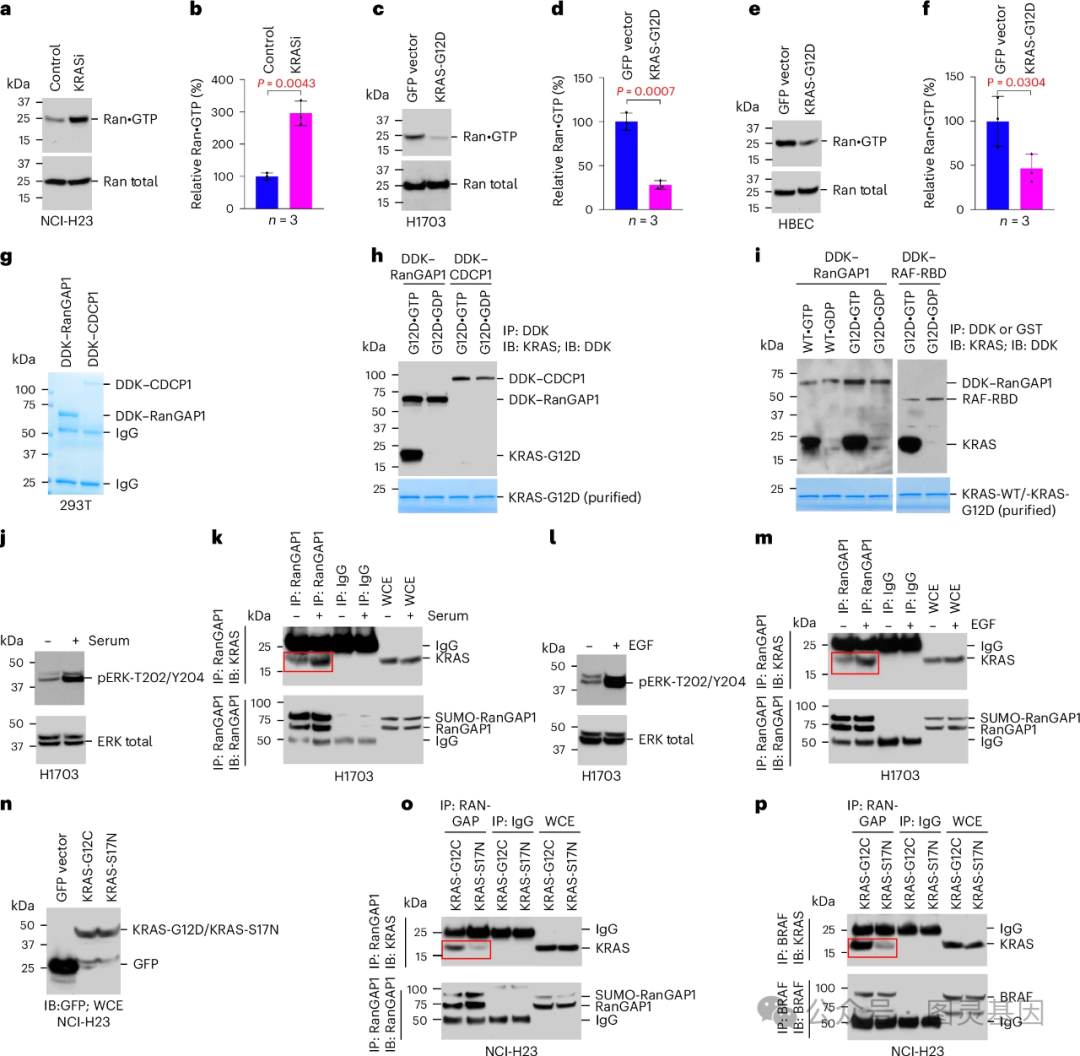
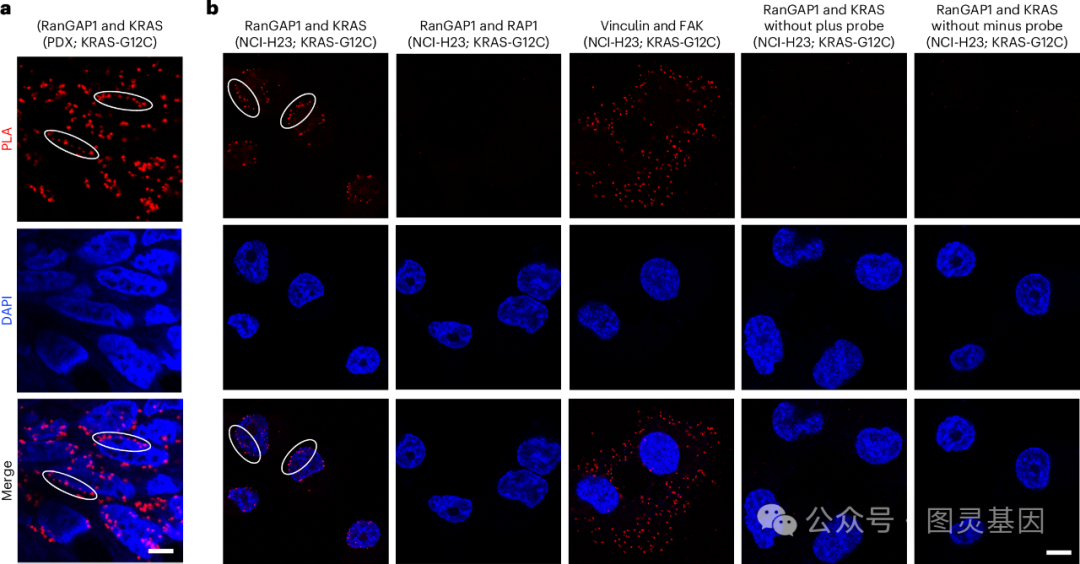
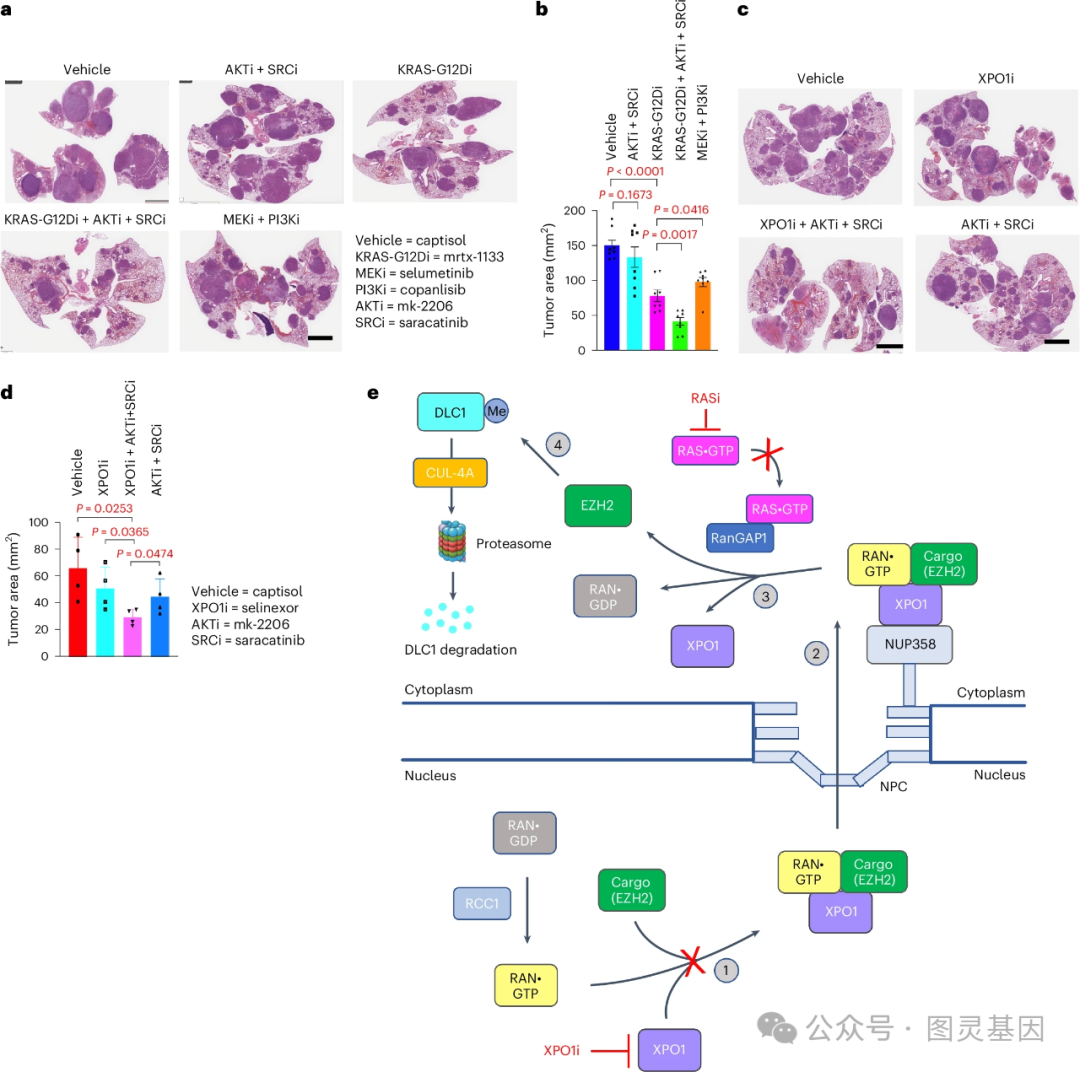
35 年前,由 Lowy 领导的一个小组进行了早期研究,确定 RAS 是一种致癌基因,并帮助解释了它是如何促进肿瘤生长的。在这项新的研究中,研究小组发现突变 RAS 直接参与了从细胞核转运到细胞质的复合物释放核蛋白 EZH2 的过程。一旦被释放, EZH2 就会促进一种叫做 DLC1 的肿瘤抑制蛋白的分解。阻断突变 RAS 阻止了 EZH2 的释放,恢复了 DLC1 的活性。
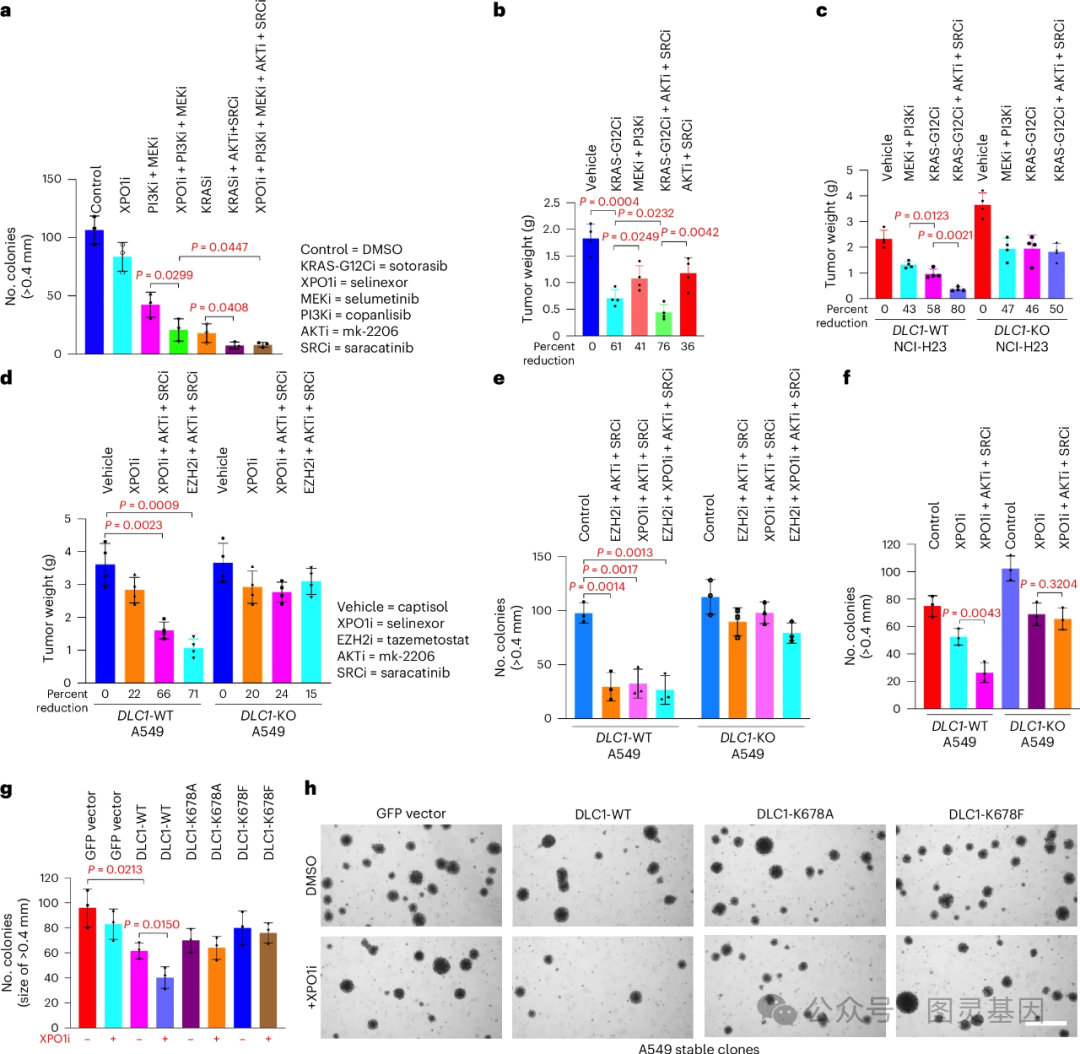
在人类肺癌细胞系和小鼠肺癌模型的实验中,研究人员发现,将 RAS 抑制剂与不同的靶向癌症药物联合使用,重新激活 DLC1 的肿瘤抑制活性,具有强大的抗癌活性——比单独使用 RAS 抑制剂更有效。
该研究还发现,突变的 RAS 蛋白在其他类型的癌症中也具有相同的功能,这表明这种机制可能是 RAS 基因突变的癌症的普遍特征。
“考虑到 RAS 的这一新作用,有朝一日可能会开发出新的治疗组合。” Lowy 说。
链接:http://www.lewenyixue.com/2024/12/03/Nat%20Cancer%20%7C%20RAS%E2%80%A2GTP/






赶快来坐沙发