选择性抑制肿瘤!复旦大学发文:发现肝内胆管癌治疗新药
【导读】 肝内胆管癌(ICC)是一种目前缺乏有效临床治疗的高致死性恶性肿瘤。消除癌干细胞样癌细胞是治疗ICC的一种极具前景但极具挑战性的策略。
11月28日,复旦大学研究团队在期刊《Advanced Science》上发表了题为“Synthetic Retinoid Sulfarotene Selectively Inhibits Tumor-Repopulating Cells of Intrahepatic Cholangiocarcinoma via Disrupting Cytoskeleton by P-Selectin/PSGL1 N-Glycosylation Blockage”的研究论文,本研究中,研究人员发现尽管5-氟尿嘧啶、顺铂、佩米加汀和吉西他滨都能抑制ICC-TRCs,但硫福罗汀的效能更为显著。硫福罗汀能将视黄醇受体α(RARɑ)从细胞质转运至细胞核,并通过转录水平抑制P-选择素的表达。此外,它还能直接与FUT8相互作用。这些作用共同作用,通过破坏PSGL1-调控的细胞骨架来抑制ICC-TRCs。 这些发现为通过破坏P-选择素/PSGL1相互作用和改变PSGL1糖基化模式来破坏细胞骨架完整性和消除ICC-TRCs提供了策略。

https://onlinelibrary.wiley.com/doi/full/10.1002/advs.202407519
背景信息
01
肝内胆管癌(ICC)在中国和东南亚地区发病率尤其高,是仅次于肝细胞癌的原发性肝癌第二大类型,占肝恶性肿瘤的20%左右,占所有消化系统恶性肿瘤的3%。这是一种高度侵袭性和致命的疾病,5年总体生存率(OS)仍维持在9%左右。仅有20%-30%的患者在可切除阶段被诊断出来,但即使经过手术切除,5年生存率也只有约20%-35%。相比之下,大多数不可切除患者的中位生存期(mOS)为11.7个月。尽管手术和系统性治疗的领域正在迅速发展,但治疗效果仍然不佳。因此,迫切需要探索更有效的ICC治疗方法。
肿瘤再生细胞(TRCs)代表了一群自我更新能力强、高度肿瘤形成的癌细胞亚群,在癌症的关键事件中发挥着关键作用。这些事件包括维持细胞增殖、抵抗细胞死亡、远距离转移、免疫逃避、代谢重编程、衰老相关分泌表型以及耐药性等。为了消除这些TRCs,本研究小组开发了一种新型合成维甲酸,称为硫福罗汀(WYC-209,SFT)。在体外和体内评估,包括患者来源的异种移植(PDX)模型中,SFT对各种癌症类型的TRCs显示出卓越的抑制作用,因此它被用作潜在的TRCs靶向分子。SFT对TRCs的选择性抑制可能有助于解决上述ICC问题。
FUT8是ICC-TRCs中SFT的直接靶点
02
糖基化是在细胞内质网/高尔基体中的一种酶促过程,是蛋白质翻译后修饰的主要方式之一,由不同的糖基转移酶和/或糖苷酶催化。鉴于SFT对RARɑ的影响,研究人员首先推测它可能通过增加核内RARɑ的转运来调节糖基转移酶/糖苷酶的转录。经过交集运算后,研究人员重点关注了MGAT3基因,它是N-乙酰葡萄糖胺转移酶III的编码基因,通过β1,4糖苷键将N-乙酰葡萄糖胺连接到β-岩藻糖上,从而催化N-糖链核心的三糖N-甘露糖的β1,4糖苷键的形成。RNA-seq和qRT-PCR数据表明,SFT处理显著降低了ICC-TRCs中MGAT3 mRNA的水平,但在2D ICC细胞中未见明显变化。因此,研究人员使用siRNA沉默ICC-TRCs中的MGAT3。然而,沉默MGAT3未能抑制PSGL1的糖基化、细胞球体的生长、迁移和侵袭。这些结果表明,MGAT3的变化只是SFT治疗后的附加效应,而不是SFT抑制ICC-TRCs的原因。
研究人员从HUCCT1-TRCs中提取总蛋白,并用DMSO或SFT(1 mm)处理。经胰蛋白酶消化后,使用质谱进行分析。生物信息学分析确定这些4047个肽段代表了1791种不同的蛋白质。随后,使用数据库将蛋白质转换为对应的编码基因。将它们与糖基转移酶或糖苷酶编码基因进行交集,总共获得了10个潜在的直接靶点,包括OGT、MGAT2、GALNT2、GALNT6、GALNT7、PIGT、FUT8、POFUT1、ALG2和UGGT1。RNA-seq数据表明,SFT治疗后这些基因的表达没有显著变化。研究人员推测,SFT可能通过直接与它们结合来调节酶的活性。
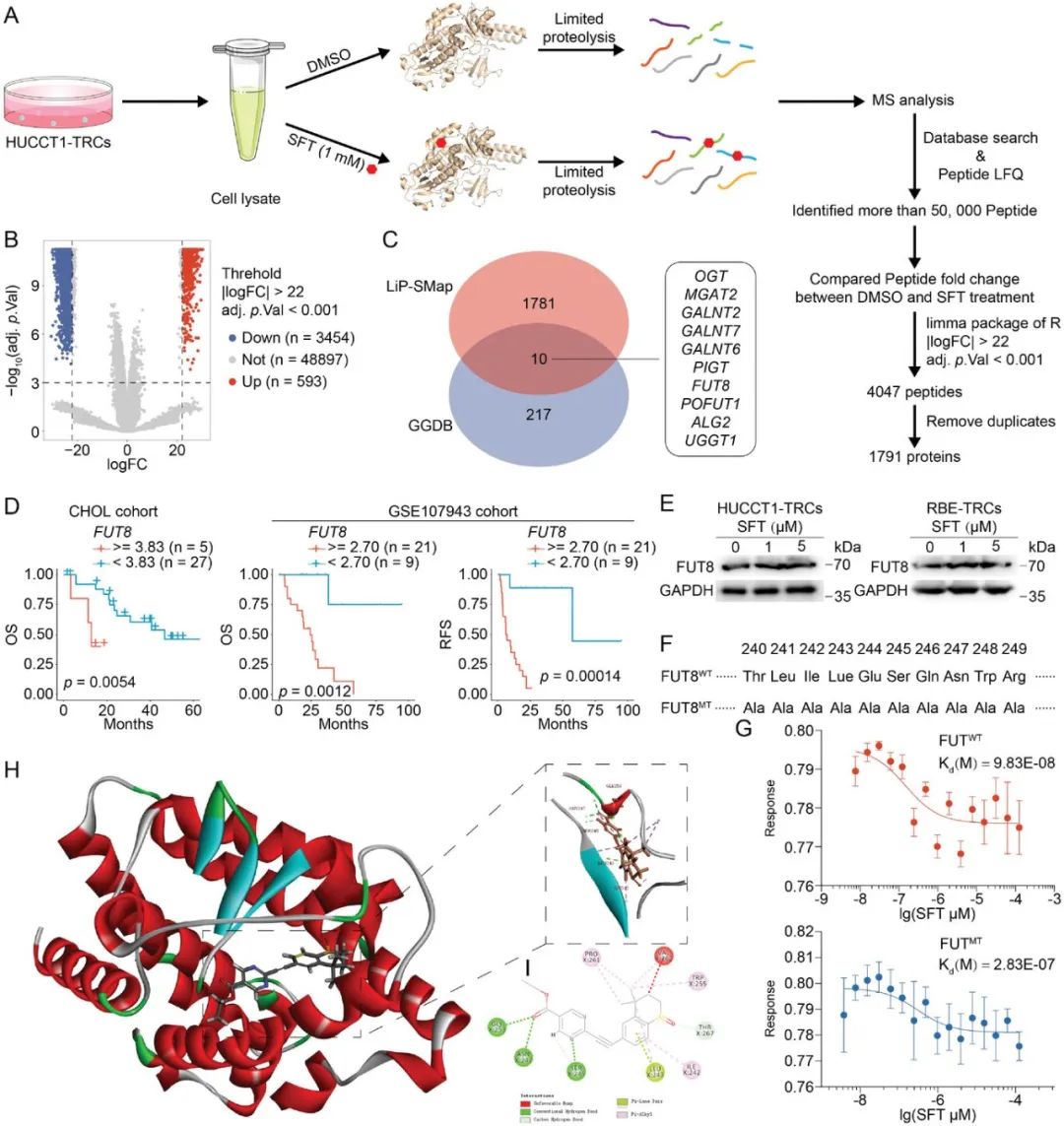
硫福罗汀直接与FUT8结合
为了确定直接靶点,研究人员评估了ICC中10个潜在靶点的重要性。差异分析显示,OGT、GALNT2、GALNT6、GALNT7、PIGT、FUT8、POFUT1、ALG2和UGGT1在ICC组织中的表达水平高于正常组织。生存分析显示,只有FUT8与患者的总生存期(OS)和无复发生存期(RFS)显著相关。SFT治疗不会对FUT8的mRNA或蛋白水平产生显著影响。研究人员通过将这10个残基替换为ALA构建了突变型FUT8,并纯化了FUT8WT和FUT8MT蛋白。MST数据表明,SFT与FUT8WT蛋白具有很强的亲和力,但与FUT8MT蛋白的亲和力降低,Kd值分别为9.83E-08和2.83E-07。模拟对接数据表明,SFT与SER245、ASN247、GLY253、THR267形成稳定的氢键相互作用,与ILE242、TRP255、PRO261形成疏水相互作用。因此,SFT可能直接与ICC-TRC中的FUT8结合。
为了研究FUT8在ICC-TRCs中的作用,研究人员使用特异性的sgRNAs在HUCCT1-TRCs中敲低FUT8。FUT8的缺失显著抑制了HUCCT1-TRCs的克隆球体形成、迁移和侵袭,降低了F-肌动蛋白荧光强度和F/G-肌动蛋白比率,并降低了HUCCT1-TRCs中糖基化的PSGL1蛋白的表达。此外,研究人员将空载体、FUT8WT或FUT8MT质粒转染到FUT8敲除的HUCCT1-TRCs中。研究人员发现,SFT治疗只能将PSGL1从约70 kDa降至约35 kDa,而在FUT8敲除的HUCCT1-TRCs或FUT8MT HUCCT1-TRCs中,效果不明显。此外,SFT治疗在FUT8WT HUCCT1-TRCs中产生了最强的抑制作用,包括克隆球体形成、迁移和侵袭,以及F/G-肌动蛋白比率,而在FUT8KO HUCCT1-TRCs或FUT8MT HUCCT1-TRCs中产生了较弱的抑制作用。综上所述,抑制FUT8的活性是SFT抑制ICC-TRCs的另一种机制。
结语
03
本研究揭示了P-选择素/PSGL1轴在ICC中通过重塑细胞骨架促进干细胞特性的新作用。研究人员还发现了硫福罗汀选择性抑制ICC-TRCs的新机制。这些发现扩大了硫福罗汀在癌症治疗中的潜在应用。
【参考资料】
https://onlinelibrary.wiley.com/doi/full/10.1002/advs.202407519
链接:http://www.lewenyixue.com/2024/12/03/%E9%80%89%E6%8B%A9%E6%80%A7%E6%8A%91%E5%88%B6%E8%82%BF%E7%98%A4%EF%BC%81%E5%A4%8D%E6%97%A6%E5%A4%A7%E5%AD%A6%E5%8F%91%E6%96%87%EF%BC%9A%E5%8F%91%E7%8E%B0%E8%82%9D%E5%86%85%E8%83%86/





赶快来坐沙发