探究TGF-β在癌症免疫调控中的作用机制
转化生长因子-β( TGF-β )是一种最有效和多效性的调节性细胞因子,它几乎控制着肿瘤引起的免疫反应的每个阶段,从初级淋巴器官中的淋巴细胞发育到次级淋巴器官淋巴白细胞的启动,以及针对肿瘤自身的效应器功能。
TGF-β在健康组织中的不同功能使寻找有效和安全的靶向TGF-β途径的癌症治疗方法变得更加复杂。本文概述了TGF-β信号在肿瘤引起的免疫反应中的复杂背景,希望能够为关于TGF-β基于机制的癌症免疫治疗提供有用的帮助。
自从TGF-β1被发现以来,已有超过30个TGF-β超家族成员被鉴定和表征,它们在合成、信号转导机制和功能方面具有共同点。根据其结构和功能的相似性,TGF-β超家族分为TGF-β和骨形态发生蛋白( BMP )亚家族。
通常,TGF-β亚家族包括TGF-βs、activins, Nodal,而BMP亚家族则含有BMP、生长和分化因子( GDF )和抗Mullerian激素( AMH )。
哺乳动物中存在三种高度同源的TGF-β亚型,即TGF-β1、TGF-β2、TGF-β3。在TGF-β超家族中,TGF-β亚型的研究最为广泛。根据癌症基因组图谱( TCGA )的数据,TGF-β1是大多数人类癌症中表达最为普遍的亚型。此外,与TGF-β2和TGF-β3相比,TGF-β1的表达与TGF-β信号激活最密切相关。
TGF-β作为一种非活性前体合成的蛋白,需要活化才能发挥作用。TGF-β前体由三部分组成:一个信号肽,一个称为潜伏相关肽( LAP )的N端长前体,以及C端对应于成熟细胞因子的短片段。在内切酶Furin裂解后,通过二硫键连接的TGF-β同源二聚体与二硫键连接的LAP同源二聚体通过二硫键结合。
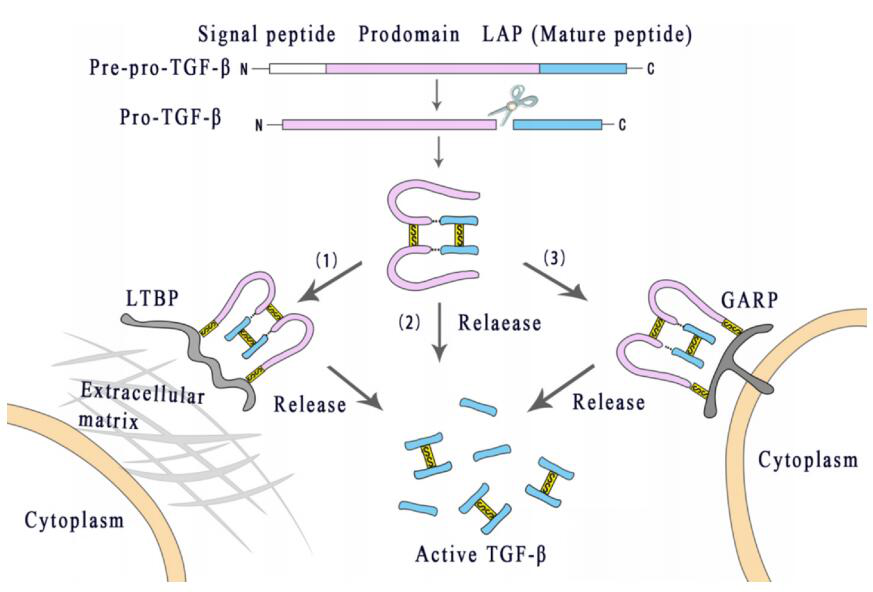
这种被称为小潜伏复合物( SLC )的分子通常通过二硫键与潜在的TGF-β结合蛋白( LTBP )交联,形成大潜伏复合物( LLC ),与细胞外基质( ECM )中的纤维蛋白相互作用,使潜伏的TGF-β稳定储存而不是进一步激活。
此外,潜伏的TGF-β还可与Treg或巨噬细胞表面的跨膜糖蛋白A为主的重复序列蛋白( GARP )和LRRC33结合。在LAP上的Arg-Gly-Asp( RGD )序列与整合素αvβ6或αvβ8相互作用后, TGF-β1和TGF-β3才从其潜伏复合物中变构释放。只有从潜伏复合物中释放出来,TGF-β才能具有活性并激活其受体。
TGF-β通过TGF-βI型受体( TGF-βRI或ALK5 )和TGF-βII型受体( TGF-βRII )触发信号传导,这两种受体都是跨膜丝氨酸/苏氨酸激酶受体。
与TGF-β结合后,TGF-βRII作为高亲和力的TGF-β受体招募并磷酸化TGF-βRI的胞内结构域,形成异四聚体,随后激活下游信号的SMAD蛋白。
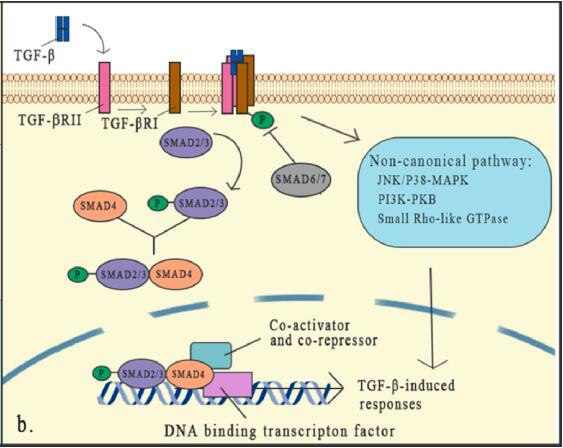
SMAD依赖的经典通路是TGFβ信号传导的核心部分。哺乳动物中有8种SMAD蛋白分为三类,包括受体相关SMADs( R-SMADs )、协同SMADs( co-SMADs )和抑制性SMAD( I-SMADs )。
TGF-β与受体结合激活受体可导致R-SMADs的活化,一旦激活,SMAD2/3与受体分离并与SMAD4形成异源三聚体结构,然后转移到细胞核,在那里它们与DNA转录因子和辅因子结合,激活或抑制数百个靶基因。
I-SMADs的表达是由TGF-β信号作为反馈反应诱导的。SMADs通常通过不同激酶的磷酸化和不同泛素连接酶的泛素化来激活或抑制SMADs,从而控制SMADs的稳定性和活性。SMAD6和SMAD7通过与R-SMADs竞争与TGF-β受体复合物的结合来降低R-SMAD的磷酸化和活化。
除了TGF-β信号转导的典型途径已被深入研究并证明具有重要作用外,非经典的( 非SMAD )信号通路仍然存在,但人们对其了解较少。虽然TGF-β信号转导的核心机制已经得到了很好的研究,但是这种信号与特定因子和其他信号通路的相互作用在TGF-β级联调节中形成了一个密集的网络,这表明TGF-β在微环境中的作用是复杂的。任何影响TGF-β信号传导元件的细胞信号都会改变其有效性。
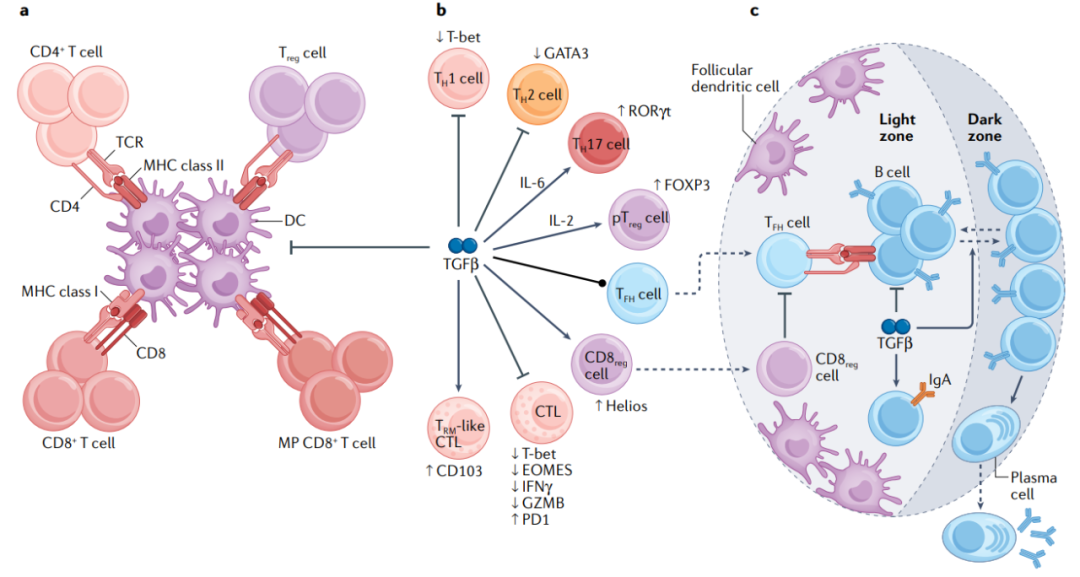
适应性免疫系统由T细胞和B细胞组成,它们在细胞表面表达抗原特异性T细胞受体( TCR )和B细胞受体。TGF-β在癌症中对这些淋巴细胞的发育、活化和分化起着重要的调节作用。
辅助性T细胞
TGF-β信号传导促进低亲和力胸腺CD4+T细胞中IL-7Rα的表达,以支持其在外周组织中的存活,同时抑制CD4+T淋巴细胞抗原驱动的阴性选择。此外,TGF-β抑制外周自身反应T细胞的激活、增殖和效应器分化。TGF-β诱导的SMAD3–SMAD4复合物激活PKA以触发羧基末端SRC激酶( CSK )介导的近端TCR信号抑制,以防止意外的T细胞启动。TGF-β还下调转录因子T-bet和GATA3,以分别抑制CD4+T细胞分化为TH1细胞和TH2细胞。相比之下,TGF-β与IL-6协同作用,诱导TH17细胞的分化。因此,TGF-β作为CD4+T细胞活化和增殖的关键调节因子,并引导三种主要T辅助细胞亚群的分化。
T滤泡辅助细胞( T FH )细胞在表达B细胞新抗原的模型中表现出强大的抗肿瘤功能。TGF-β可能通过抑制TCR信号传导来限制T FH 细胞的生成。另一方面,TGF-β介导的IL-2R表达抑制可以使CD4+T细胞与IL-2信号隔离,从而促进TFH细胞的生成、。因此,TGF-β可以在控制T FH 细胞分化中发挥相反的作用,需要进行研究来阐明其在癌症背景下如何影响TFH细胞反应。
调节性T细胞
胸腺Treg细胞分化是由TGF-β信号介导的。TGFβ介导的胸腺Treg生成不涉及转录因子FOXP3的诱导,而是通过减少激动性抗原触发的T细胞克隆缺失间接起作用。在TGF-β存在下,外周Treg( pTreg )细胞也可以与幼稚CD4+T细胞分化,部分通过SMAD3介导的Foxp3转录的诱导。除了影响pTreg细胞分化外,TGF-β还可以以自分泌的方式抑制Treg细胞的扩增。在乳腺癌和前列腺癌的转基因模型中,Treg细胞中TGFBR2或TGF-β1的缺失不会影响肿瘤生长。因此,尽管TGF-β诱导Foxp3表达,但pTreg细胞分化可能不会导致肿瘤浸润Treg细胞。
细胞毒性T细胞(CTL)
TGF-β促进IL-7Rα的表达和胸腺CD8+T细胞谱系,而抑制外周CD8+T淋巴细胞的抗原驱动增殖。此外,FOXP1与TGF-β激活的SMAD2和SMAD3相互作用,以抑制转录因子MYC和JUN,这些转录因子驱动CD8+T细胞的增殖。TGF-β还抑制T-bet和EOMES的表达,它们支持CD8+T细胞分化为细胞毒性T淋巴细胞。此外,SMAD2和SMAD3与ATF1协同抑制CTL效应分子的表达,包括IFN-γ和颗粒酶B。CTL的慢性抗原刺激导致T细胞“耗竭”状态,其特征是抑制性受体( 包括PD-1 )的高表达。TGF-β以SMAD3依赖的方式增强PD-1表达。因此,TGFβ参与多种基因表达程序,以减弱CTL分化和功能。
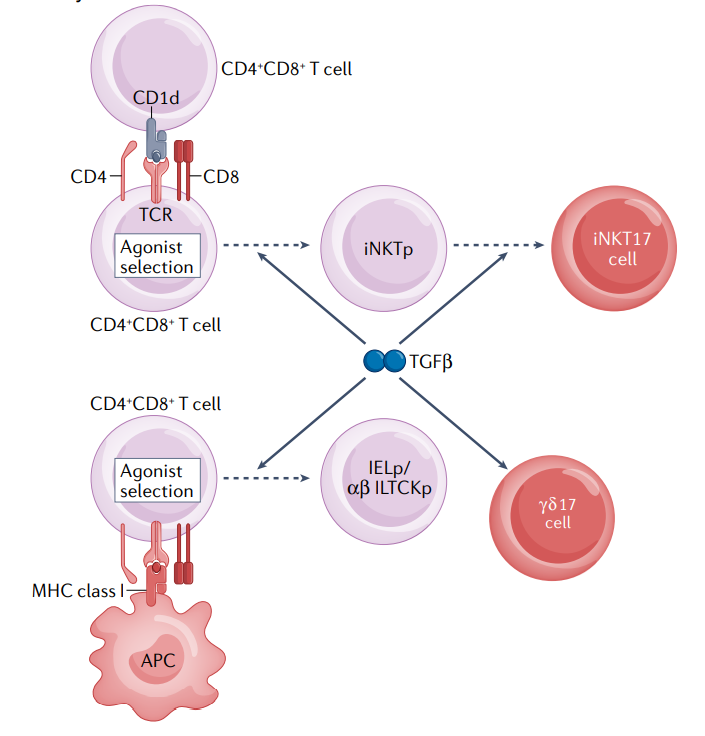
先天性T淋巴细胞
恒定自然杀伤T细胞( iNKT细胞 )和γδT细胞亚群,这些非常规的αβT细胞和γδT细胞分化也受到TGF-β的调控。在胸腺中, TGF-β是CD1d–脂质抗原反应性iNKT细胞前体( iNKTp )和MHC–肽抗原反应性上皮内淋巴细胞前体( IELp )发育所必需的。此外,TGF-β是产生IL-17的iNKT细胞( iNKT17细胞 )和γδ谱系T细胞( γδ17细胞 )分化所必需的。
B 细胞通过分泌抗体介导体液免疫反应,这涉及激活次级淋巴器官中的常规 B2 细胞。 B 细胞中 TGF-β 信号传导的阻断导致活化和增殖增强,而向 IgA 的类别转换被减弱。 Peyer 斑块是 IgA 产生的主要位点, TGF-β 信号传导的阻断不会影响淋巴结中 IgA 的产生,生发中心 B 细胞中 TGF-β 的信号传导的延迟抑制不会影响 Peyer 斑中 IgA 的转换。 生发中心 B 细胞表现出高水平的 TGF-β 依赖性 SMAD2 磷酸化, TGF-β 信号传导促进其从生发中心的亮区向暗区的转变以及抗体亲和力成熟。 因此, TGF-β 在控制 B 细胞反应方面具有多效性功能。
考虑到在Peyer斑中B细胞激活的早期阶段,TGF-β信号传导对于IgA转换是选择性需要的,TGF-β可能在前列腺肿瘤相关IgA+浆细胞反应中发挥类似的作用,但这种作用发生在何处以及是否在其他肿瘤环境中发生仍然未知。
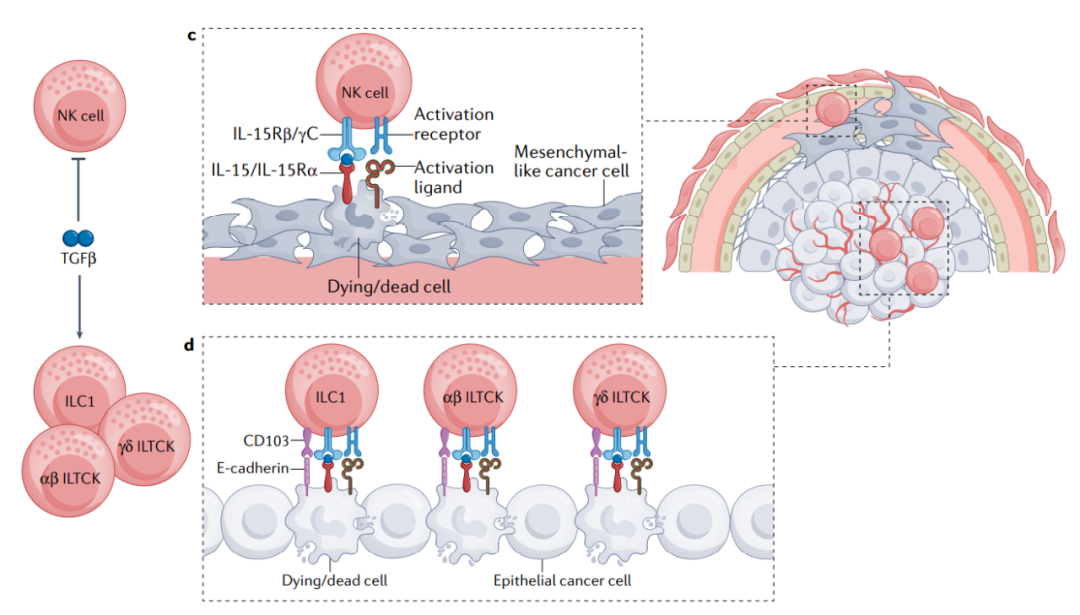
固有免疫系统包括淋巴和髓系细胞谱系,它们构成抵抗免疫挑战的第一道防线,并调节适应性免疫反应。 与对 T 和 B 细胞的影响类似, TGF-β 在控制癌症中的固有免疫细胞功能方面表现出多效性功能。
NK细胞
NK细胞中TGFBR1的表达可增强癌细胞转移,并加速纤维肉瘤的生长,这表明TGF-β通过释放SMAD4转录抑制活性( 如通过SMAD4–SKI–SKIL介导的活性 )抑制NK细胞介导的癌症转移监测。TGF-β抑制NK细胞中IL-15诱导的代谢调节物mTOR复合物1的活化,这可能是其增殖减少、活化受体表达减少和细胞毒活性受损的原因。此外,TGF-β阻碍人NK细胞中IL-2诱导的糖酵解和氧化磷酸化,这可能限制其抗肿瘤活性。这些发现共同表明,TGF-β可以抑制NK细胞介导的肿瘤监测。
辅助性固有淋巴细胞
ILC2对IL-33的信号响应,产生炎性细胞因子。阻断TGF-β信号可减少ILC2祖细胞数量,并与IL-33受体ST2的低表达相关,减少ILC2的发育。而ILC2与抗肿瘤活性相关,在小鼠黑色素瘤模型中,ILC2衍生的GM-CSF促进嗜酸性粒细胞的扩增和效应器功能,以抑制肿瘤的发育。此外,胰腺癌或黑色素瘤患者的高水平ILC2浸润与良好的临床预后相关。
另一方面,与TGF-β在促进抗肿瘤ILC2反应中的这些积极作用相反,在结直肠癌模型中,TGF-β信号传导促进ILC3转化为产生IL-10的调节型ILCs群体,并且这些调节性ILC与癌细胞的共转移导致加速肿瘤生长。
单核和巨噬细胞
TGF-β在巨噬细胞的发育中起着关键作用,组织巨噬细胞可以从胚胎祖细胞分化而来,包括表皮朗格汉斯细胞和肺泡巨噬细胞,这两者都需要自身分泌TGF-β1来维持。但TGF-β是否以及如何进一步影响它们在癌症中的功能仍有待探索。
除了组织驻留的巨噬细胞外,单核细胞经常被招募到肿瘤中并分化为肿瘤相关的巨噬细胞。TGF-β可诱导单核细胞的趋化性,并可影响单核细胞衍生的巨噬细胞表型。
粒细胞
中性粒细胞是循环中最丰富的粒细胞,经常被肿瘤吸收。它们主要具有促肿瘤功能,驱动癌细胞基因组不稳定、癌细胞增殖和肿瘤血管生成。在结肠癌转基因模型中,中性粒细胞特异性缺失TGF-βR1与肿瘤浸润中性粒细胞数量减少相关,并抑制转移。因此,TGF-β可诱导中性粒细胞募集以促进肿瘤发展。
 Galunsertib
Galunsertib M7824( Bintrafusp-alfa )是一种由抗PD-L1的抗体和TGF-βRII分子的胞外段组成的双功能分子,可以“捕获”在TME中的TGF-β。在1期临床试验中,接受1200毫克剂量治疗的PD-L1阳性和PD-L1高表达的铂预处理NSCLC患者的客观缓解率( ORRs )分别为36.0%( n=10/27 )和85.7%( n=6/7 ),疗效令人鼓舞并且具有可管理的耐受性。然而,在随后进行的针对肺癌和胆管癌的II期和III期临床试验中失败,为其前景蒙上了一层阴影。
作为一种进化上古老的调节细胞因子, TGF-β 在免疫系统内外具有多效性功能。 其促肿瘤或抗肿瘤免疫活性取决于其来源、剂量、环境和淋巴细胞靶点,以及癌症类型和疾病阶段。 TGF-β 在次级淋巴器官和肿瘤自身的淋巴细胞活化和分化过程中调节启动依赖性免疫应答。
更深入地了解TGF-β如何影响体内稳态中的组织相关免疫反应,将进一步阐明TGF-β在癌症中破坏这种平衡时所起的作用。我们对TGF-β信号在各种癌症中复杂性的进一步研究,将为未来针对这一途径进行癌症治疗的尝试注入新的活力。
参考文献:
1.TGFβcontrol of immune responses in cancer: a holistic immuno-oncology perspective. NatRev Immunol.2022 Nov 15.
2. Roles of TGF-β signaling pathway in tumor microenvirionment and cancer therapy. Int Immunopharmacol. 2020 Oct 21;89(Pt B):107101.
链接:http://www.lewenyixue.com/2024/12/03/%E6%8E%A2%E7%A9%B6TGF-%CE%B2%E5%9C%A8%E7%99%8C%E7%97%87%E5%85%8D%E7%96%AB%E8%B0%83%E6%8E%A7%E4%B8%AD%E7%9A%84%E4%BD%9C%E7%94%A8%E6%9C%BA%E5%88%B6/
如果本内容对您有帮助,欢迎给我打赏,支持创作