Cancer Cell | 突破耐药:乳腺癌CDK4/6 i耐药与TP53介导的细胞衰老转化
最近,一项发表在Cancer Cell上的研究揭示了TP53基因突变与CDK4/6抑制剂长期疾病控制失败之间的关联,并提出了通过CDK2抑制来克服p53缺失,促进细胞衰老转化,从而实现长期疾病控制的新策略。
乳腺癌是全球女性最常见的恶性肿瘤之一,其中激素受体阳性(HR+)乳腺癌占据了较大比例。CDK4/6抑制剂作为HR+乳腺癌治疗的重要药物,通过抑制细胞周期G1期的关键蛋白,有效控制了疾病的进展。然而,患者对CDK4/6抑制剂的响应存在高度异质性,从几个月到几年不等。
2024年11月,Cancer Cell发表了题为“Long-term breast cancer response to CDK4/6 inhibition defined by TP53-mediated geroconversion”的研究文章,深入探究TP53基因状态对HR+乳腺癌患者CDK4/6抑制剂治疗响应的影响,研究揭示了可通过联合抑制CDK2来克服p53缺失导致的耐药性,从而实现长期疾病控制的新机制,为开发新的联合治疗方案提供了理论基础,有望改善患者的治疗预后。
01▼研究设计
本研究是一项基于大样本、临床注释的队列研究,共纳入467名接受一线CDK4/6抑制剂(阿贝西利、帕博西利和他莫西利)联合内分泌治疗的转移性HR+乳腺癌患者。研究通过MSK-IMPACT检测平台对患者肿瘤样本进行基因组测序,分析了与治疗响应相关的基因变异。研究将患者根据治疗时间分为短期、中期和长期响应三组,通过Firth-penalized logistic regression和elastic net Cox回归模型分析基因变异与无进展生存期(PFS)的关系。
02▼研究结果
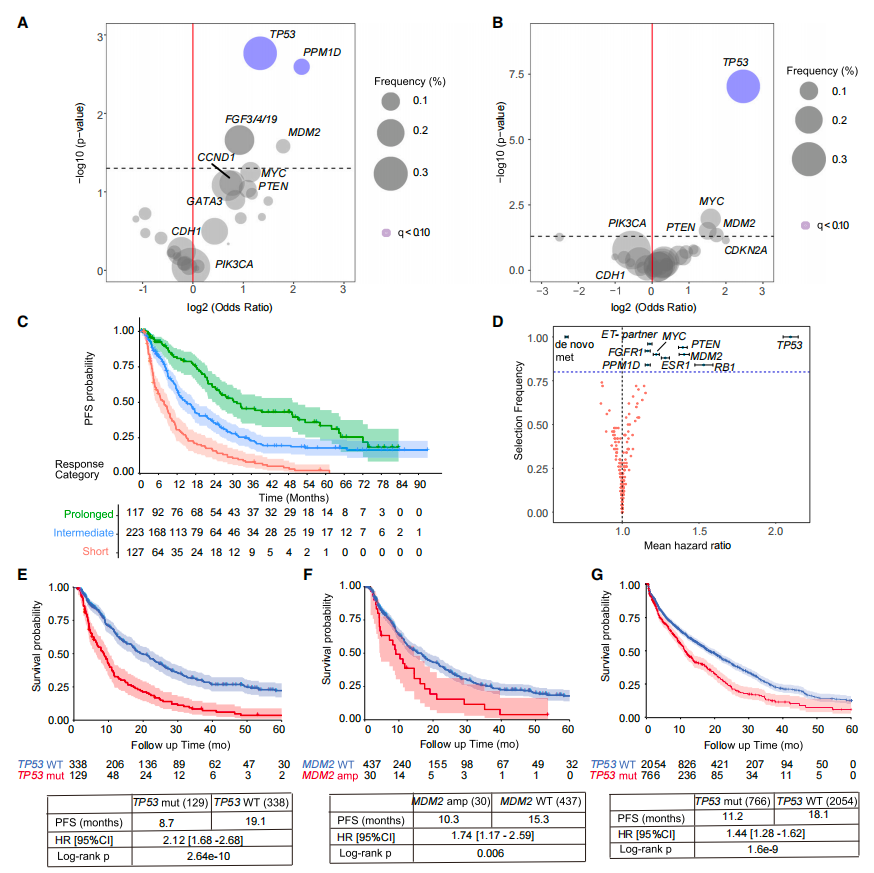
研究发现,TP53基因的缺失(27.6%)和MDM2基因的扩增(6.4%)与缺乏长期疾病控制相关。在HR+乳腺癌模型中,p53的缺失并不改变CDK4/6活性或G1期阻滞,而是通过CDK2促进药物不敏感的p130磷酸化。磷酸化p130的持续存在阻止了DREAM复合体的组装,使细胞能够重新进入细胞周期并促进肿瘤进展。CDK2抑制剂能够克服p53的缺失,导致细胞衰老转化,表现出衰老表型。研究结果表明,完全抑制CDK4/6和CDK2激酶似乎是实现HR+乳腺癌长期响应的必要条件。
TP53和MDM2基因变异与长期疾病控制的关联
本研究首先通过分析467名接受一线CDK4/6抑制剂治疗的转移性HR+乳腺癌患者,发现TP53基因缺失(占比27.6%)和MDM2基因扩增(占比6.4%)与缺乏长期疾病控制相关。这一发现提示,TP53和MDM2的基因状态可能是预测CDK4/6抑制剂疗效的重要生物标志物。
图1 在未能实现长期对CDK4/6i反应的患者中富集的体细胞变化
TP53缺失对CDK4/6抑制剂反应的影响
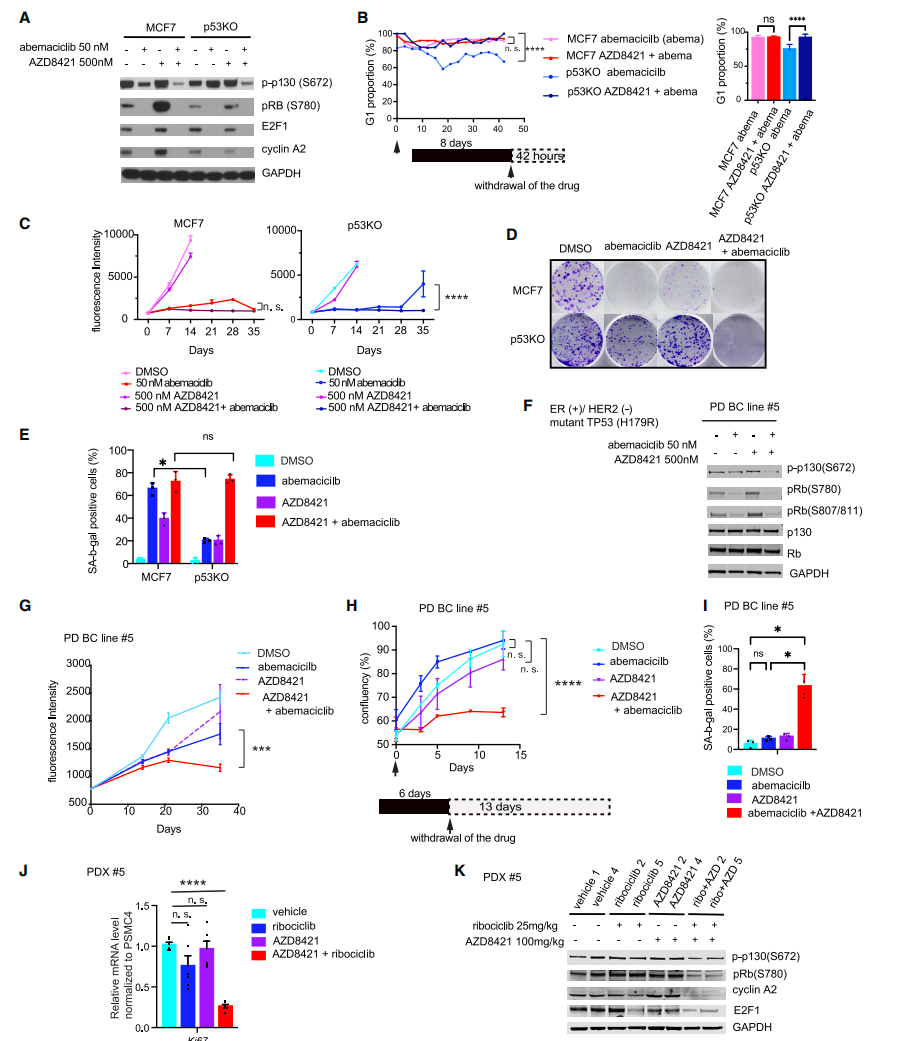
研究进一步利用HR+乳腺癌模型揭示,p53的缺失并不影响CDK4/6活性或G1期阻滞,而是通过CDK2促进药物不敏感的p130磷酸化。磷酸化p130的持续存在阻止了DREAM复合体的组装,从而使细胞能够重新进入细胞周期并促进肿瘤进展。
CDK2抑制剂的潜在治疗作用
研究中还发现,CDK2抑制剂能够克服p53缺失导致的耐药性,通过促进细胞衰老转化(geroconversion)和衰老表型的显现,实现对肿瘤的长期抑制。这表明,联合抑制CDK4/6和CDK2可能是治疗TP53突变型HR+乳腺癌及抑制药物耐受性的潜在策略。
图2 CDK2和CDK4/6的联合抑制实现持久的肿瘤生长抑制
长期反应与基因组多样性的相关性
研究结果还表明,为了在基因组多样性的HR+乳腺癌中实现长期反应,完全抑制CDK4/6和CDK2激酶似乎是必要的。这一点在图1中得到了体现,其中展示了不同基因变异与长期疾病控制的关联,以及通过弹性网Cox回归模型对患者进行风险分组的结果。
FELINE试验中TP53状态对治疗反应的影响
在对FELINE 2期临床试验的分析中,研究人员发现TP53功能丧失的患者在接受CDK4/6抑制剂治疗后难以实现持久的细胞周期停滞,而TP53野生型患者则能保持较低的细胞增殖活性。这一结果进一步证实了TP53状态对CDK4/6抑制剂治疗效果的重要影响。
03▼总结讨论
本研究的结论强调了TP53基因状态在预测CDK4/6抑制剂长期疗效中的重要性,并提出了联合CDK2抑制剂作为一种新的治疗策略,以增强p53缺失HR+乳腺癌患者的治疗效果。这一发现不仅为HR+乳腺癌的个体化治疗提供了新的分子标志物,也为开发新的联合治疗方案提供了理论基础。未来的研究需要进一步验证这些发现,并探索如何将这些知识转化为临床实践中的精准治疗策略。
通过这项研究,我们不仅加深了对HR+乳腺癌治疗响应异质性的理解,也为未来的治疗提供了新的视角。随着精准医疗的不断进步,我们有望为每一位乳腺癌患者提供更为个性化、更为有效的治疗方案。
链接:http://www.lewenyixue.com/2024/12/02/Cancer%20Cell%20%7C%20%E7%AA%81%E7%A0%B4%E8%80%90%E8%8D%AF%EF%BC%9A%E4%B9%B3/
如果本内容对您有帮助,欢迎给我打赏,支持创作