重振抗肿瘤活性!《自然》子刊发现恢复老年人免疫功能的关键,有望提升癌症免疫疗效
与年轻人相比,老年人患各种癌症的风险上升,也更容易遭受病毒感染,这些都是免疫系统变老、免疫功能下降的体现。科学家将免疫系统随着年龄增长而出现的退行性改变称为 免疫衰老 。研究者指出,免疫衰老是衰老个体共有的生理现象,也是诱发肿瘤等疾病的关键原因。
日前,来自中国科学院上海营养与健康研究所、中国科学院上海药物研究所、上海市胸科医院和河北工程大学的研究人员在《自然》子刊 Nature Aging 上合作发表论文, 揭示了衰老影响T细胞抗肿瘤免疫反应的关键机制 。同时,这项研究指出了一个潜在治疗靶点, 有望帮助衰老免疫系统中的T细胞重振抗肿瘤活性 。

免疫系统中的T细胞,尤其是CD8 T细胞,在抗肿瘤免疫中扮演至关重要的角色,能在识别抗原后直接攻击并杀死肿瘤细胞,还能通过形成记忆T细胞在日后快速消除相同或类似的肿瘤细胞,发挥长期保护作用。而在肿瘤微环境中,一些CD8 T细胞会迁移到肿瘤组织中形成组织驻留记忆T细胞,提供长时间的免疫监视。目前多种肿瘤免疫疗法就是通过提升CD8 T细胞的功能来达到消除肿瘤的目标。因此, T细胞在免疫衰老过程中发生的改变也影响了老年患者对肿瘤免疫疗法的应答效果 。
作者在新研究中发现, 衰老会减损CD8阳性的组织驻留记忆T细胞,从而使CD8 T细胞的抗肿瘤活性不足 。实验中,研究人员分别将来自年轻小鼠和老年小鼠的CD8 T细胞过继转移到免疫缺陷小鼠体内并诱导皮下肿瘤,随后对肿瘤浸润的CD8 T细胞进行单细胞测序分析。其结果显示,衰老组的组织驻留记忆T细胞浸润减少。进一步体外实验证明,衰老个体的CD8 T细胞向组织驻留记忆T细胞分化的能力受到抑制。
后续的多因素基因筛选显示, 细胞凋亡调节因子BFAR在老年个体的CD8 T细胞中高度富集,是抑制组织驻留记忆T细胞产生的关键 。BFAR是一种E3泛素连接酶,通过激活JAK2的去泛素化,限制细胞因子诱导的JAK2信号通路激活,进而导致组织驻留记忆T细胞的分化减少。
实验显示,在CD8 T细胞中特异性敲除BFAR基因,可促进其在肿瘤微环境中向组织驻留记忆T细胞分化,进而增强其抗肿瘤的免疫功能。基于这一结果, 研究团队进一步开发了BFAR抑制剂 。体外实验和体内实验证明,该小分子抑制剂iBFAR2可模拟BFAR敲除的表型,可促进CD8 T细胞在肿瘤微环境中向组织驻留记忆T细胞分化,增强T细胞的抗肿瘤免疫功能,恢复老年个体的CD8 T细胞的抗肿瘤免疫功能。。
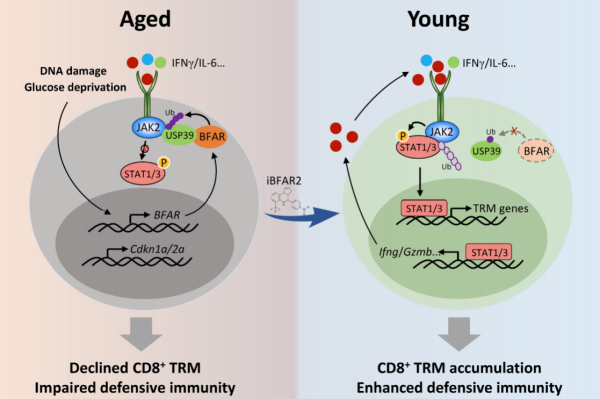
▲ 衰老抑制CD8 T细胞介导的抗肿瘤免疫模式图(图片来源:参考资料[2])
在使用PD-1抗体进行肿瘤免疫治疗时,老年个体可能因免疫衰老而缺少抗肿瘤免疫应答。新研究表明,小分子抑制剂iBFAR2可增加PD-1抗体介导的免疫治疗敏感性,降低高剂量PD-1抗体引起的系统性炎症的副作用。iBFAR2可抑制PD-1抗体不响应肿瘤的生长。由此可见, 靶向BFAR可以促进老年个体的抗肿瘤免疫应答,可以增敏PD-1抗体的肿瘤免疫治疗效果 ,为临床PD-1抗体不响应患者的肿瘤免疫治疗提供新策略。
作者总结指出,这一研究对衰老个体和PD-1抗体治疗不响应患者的肿瘤免疫防御能力缺陷的机制研究作了补充, BFAR作为衰老调控的关键靶点,对临床老年患者肿瘤免疫治疗具有重要意义 。
参考资料:
[1] Pei, S., Deng, X., Yang, R. et al. Age-related decline in CD8 tissue resident memory T cells compromises antitumor immunity. Nat Aging (2024). https://doi.org/10.1038/s43587-024-00746-5
[2] 研究发现衰老导致T细胞抗肿瘤免疫失能机制 Retrieved Nov. 29 2024 from https://www.cas.cn/syky/202411/t20241127_5040591.shtml
链接:http://www.lewenyixue.com/2024/12/02/%E9%87%8D%E6%8C%AF%E6%8A%97%E8%82%BF%E7%98%A4%E6%B4%BB%E6%80%A7%EF%BC%81%E3%80%8A%E8%87%AA%E7%84%B6%E3%80%8B%E5%AD%90%E5%88%8A%E5%8F%91%E7%8E%B0%E6%81%A2%E5%A4%8D%E8%80%81%E5%B9%B4/