66%患者的肿瘤得到控制!《自然》:双效合一的CAR-T策略,突破实体瘤治疗难题
嵌合抗原受体T细胞(CAR-T细胞)疗法的问世对肿瘤治疗领域来说是革命性的,它创新性地通过改造患者自身的T细胞,让T细胞携带了能够靶向癌细胞抗原的分子。在重新输回患者体内后,CAR-T细胞就能精确地寻找肿瘤,发挥杀伤性作用。
目前,CAR-T疗法已经在血液癌症治疗中取得乐观结果,包括白血病、淋巴瘤和多发性骨髓瘤等。美国FDA也批准了多款用于治疗复发性或难治性血液肿瘤的CAR-T疗法。

不过,CAR-T疗法在实体瘤中的治疗效果仍然不够理想,其中实体瘤的肿瘤微环境(TME)是抑制CAR-T细胞活性的重要原因。 TME中会持续性产生具有免疫抑制效应的分子,造成T细胞迅速衰竭;同时TME中支持T细胞活化的细胞因子水平也非常低,比如白介素-15(IL-15) 。这种双重打击极大地限制了CAR-T细胞在实体瘤中发挥作用。
因此,除了让T细胞能识别肿瘤抗原,科学家还想通过改造,进一步增强CAR-T细胞的疗效。今日,来自美国贝勒医学院的研究团队在《自然》杂志发表了一篇全新论文,他们展示了一种经过双重改造的CAR-T细胞—— T细胞既能靶向实体瘤常见抗原GPC3,同时也能表达IL-15。 新研究将其称作 15. CAR-T细胞 ,其能够比常规的CAR-T细胞更有效地清除实体瘤。
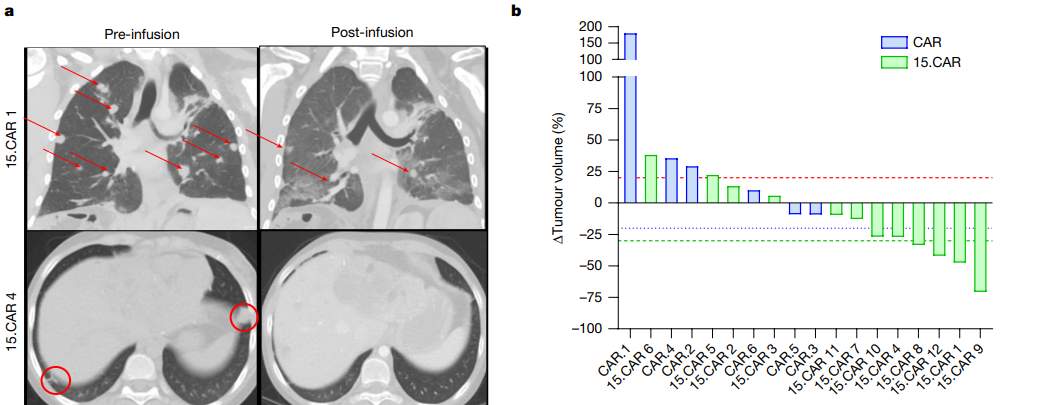
在1期临床试验中,接受常规的GPC3 CAR-T细胞治疗的实体瘤患者,没有产生明显的抗肿瘤反应。 而接受15. CAR-T细胞治疗的12位实体瘤患者中,有8人的疾病得到控制,其中4人获得部分缓解 ,这代表着CAR-T疗法有望在实体瘤中同样起效。

GPC3是一类实体瘤细胞表面常见的蛋白,它能够吸引Wnt蛋白聚集从而触发细胞增殖信号,比如肝细胞癌通常就有着GPC3过度表达的特征。因此在新研究中,T细胞改造工程的其中一步就是让其表达针对GPC3的嵌合抗原受体。
在患者招募阶段,研究团队首先要获取肿瘤样本进行分析,确认肿瘤表达了GPC3才会纳入后续试验中。所有符合条件的患者接受淋巴去除术之后被分成两组。一组接受的是GPC3 CAR-T细胞治疗,另一组接受的是15. CAR-T细胞治疗。
从治疗观察结果来看,两组患者都没有产生明显的副作用,但GPC3 CAR-T细胞组的患者也没有产生客观反应,可以说是“无功无过”。另一边,15. CAR-T细胞组的患者状况更好: 4位患者获得了部分缓解,其中两位患者的肿瘤负荷至少下降了26%。 此外,所有产生反应的患者血清中都有着更高的趋化因子。 总体来看,在 15. CAR-T治疗组中的12名患者中, 有8名展现出疾病控制状态(即获得缓解或病变稳定),疾病控制率达到66.7%。 其中有一名患者的肝脏肿瘤中产生了接近完全的肿瘤坏死。
链接:http://www.lewenyixue.com/2024/11/28/66%25%E6%82%A3%E8%80%85%E7%9A%84%E8%82%BF%E7%98%A4%E5%BE%97%E5%88%B0%E6%8E%A7%E5%88%B6%EF%BC%81%E3%80%8A%E8%87%AA%E7%84%B6%E3%80%8B%EF%BC%9A%E5%8F%8C%E6%95%88/