肿瘤侵袭与转移潜在机制!成都中医药大学:发现肿瘤治疗潜在策略
【导读】 放射学上,肺腺癌(LUAD)中的玻璃样结节(GGN)和部分实性结节(PSN)在临床表现、生物学特征和预后方面存在显著的异质性。本研究旨在探讨不同放射学表型间非小细胞肺癌(LUAD)的异质性及其影响肿瘤演变的相关因素。
11月23日,成都中医药大学研究团队在期刊《Molecular Cancer》上发表了研究论文,题为“Single-cell RNA sequencing reveals immune microenvironment niche transitions during the invasive and metastatic processes of ground-glass nodules and part-solid nodules in lung adenocarcinoma”,本研究中,研究人员对8例GGN-和7例PSN-LUAD肿瘤组织在不同疾病阶段(包括微创性腺癌(MIA)、侵袭性腺癌(IAC)和转移性肺癌(MLC))进行了单细胞RNA测序(scRNA-seq),并分析了4例相邻正常组织。研究人员采用免疫组织化学、多重免疫荧光染色和外部scRNA-seq数据来确认标志基因的表达以及CXCL9 + TAMs和TREM2 + TAMs的分布模式。另外,研究人员使用基因编辑、器官培养和异位移植技术构建了LUAD小鼠模型,并进行了包括组织病理学、RNA测序和蛋白质免疫印迹在内的全面分析,以验证关键通路。

https://molecular-cancer.biomedcentral.com/articles/10.1186/s12943-024-02177-7#Sec1
背景知识
01
随着高分辨率低剂量计算机断层扫描的广泛应用,越来越多的肺腺癌(LUAD)病例以肺结节的形式被发现,其中玻璃样结节(GGN)和部分实性结节(PSN)是最常见的两种类型,占所有肺结节的31.7-69.7%。值得注意的是,具有GGN特征的早期LUAD术后5年无病生存率几乎为100%。相比之下,PSN显示出更高的转移和疾病进展风险。这表明LUAD的不同放射学特征与恶性表型和疾病进展之间可能存在强烈的相关性。
LUAD的肿瘤微环境(TME)由癌细胞、浸润性免疫细胞、间质细胞和其他细胞类型以及非细胞组织成分组成,它们相互相互作用并共同决定肿瘤的发生和发展。单细胞RNA测序(scRNA-seq)技术能够对单个样本中的数千个细胞进行评估,从而揭示肿瘤细胞的异质性和复杂TME的微妙细节。通常认为LUAD的发展是从原位腺癌(AIS)开始,经过微侵袭腺癌(MIA)阶段,发展为侵袭性腺癌(IAC),最终发展为远处转移性肺癌(MLC)。目前,研究人员已经利用scRNA-seq技术揭示了LUAD从早期到侵袭性阶段的进化轨迹。然而,这些研究并不全面,无法全面捕捉LUAD从早期阶段的发展过程,也无法识别不同病理阶段同一类型肺结节的特征。据研究人员所知,目前尚无全面研究评估GGN和PSN特征对MIA、IAC和MLC-LUAD的分子和免疫学特征的影响。
GGN-和PSN-LUAD的单细胞景观
02
在成都中医药大学附属医院和四川省肿瘤医院胸外科(均为非配对样本),研究人员从19例未经治疗的LUAD患者中获取了19例新鲜肺组织切片样本,其中包括4例相邻正常肺组织样本;3例GGN-MIA、3例GGN-IAC和2例GGN-MLC样本;3例PSN-MIA、3例PSN-IAC和1例PSN-MLC样本。
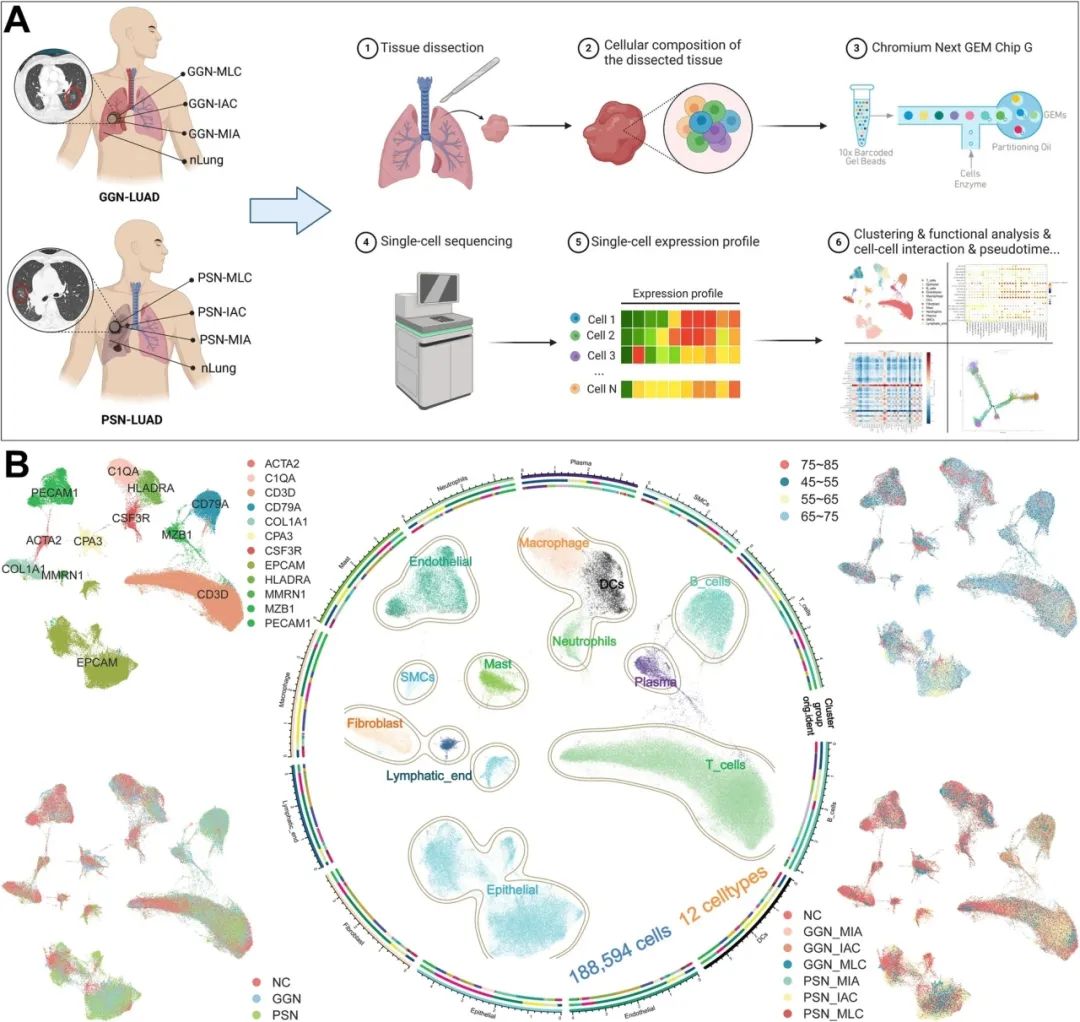
肺腺癌(LUAD)患者的肺部结节(GGN)和部分实性结节(PSN)的放射学特征表现为肿瘤和相邻组织内的细胞景观
研究人员将样本消化成单细胞悬液后,应用单细胞RNA测序技术。经过过滤后,共获得188,594个细胞,其中包括来自19个肺组织样本的20,145个细胞,其中GGN-MIA组有20,145个细胞,GGN-IAC组有32,233个细胞,GGN-MLC组有6,539个细胞,PSN-MIA组有22,273个细胞,PSN-IAC组有16,184个细胞,PSN-MLC组有21,235个细胞,NC组有45,038个细胞。研究人员将细胞分为12个簇,并用标准标记基因表达进行注释,包括T细胞、上皮细胞、B细胞、内皮细胞、巨噬细胞、树突状细胞、成纤维细胞、肥大细胞、中性粒细胞、浆细胞、淋巴管内皮细胞和平滑肌细胞。在为每个细胞群赋予肿瘤分期后,对正常肺组织(NC组)、GGN-和PSN-LUAD组织中各种细胞类型的组成异质性进行了深入调查和总结。与NC组不同,PSN-LUAD和GGN-LUAD组观察到了T和B淋巴细胞的富集,而中性粒细胞浸润减少。此外,随着GGN-LUAD和PSN-LUAD发生侵袭和转移的变化,在特定组织中存在的肿瘤细胞的组成也发生了变化。这些发现表明,在不同肿瘤组织阶段的细胞组成差异可能与疾病进展机制有关。
内皮细胞在PSN型和GGN型肺腺癌侵袭和转移过程中调控血管生成
03
内皮细胞是构成血液/淋巴管的重要细胞类型,可以影响肿瘤微环境中的营养输送和氧气供应。先前的研究表明,内皮细胞数量减少会导致缺氧的肿瘤微环境形成,而缺氧会通过代谢重编程促进肿瘤细胞转移。研究人员的发现与这一假设相符。与正常组织相比,GGN-和PSN-LUAD在肿瘤微环境中的内皮细胞比例显著降低,其中PSN-LUAD的内皮细胞比例更低。关键是,MLC阶段的内皮细胞计数比MIA和IAC阶段更明显地减少。
为了进一步观察不同亚型的内皮细胞的趋势,研究人员将内皮细胞进一步细分为六个细胞类型:动脉、毛细血管、毛细血管-血细胞、尖端、静脉和淋巴细胞。通过分析肿瘤微环境中不同血管内皮细胞亚型的比例,发现所有肿瘤样本中尖端细胞的比例均高于正常样本,且随着疾病进展,该比例逐渐升高,而其他主要肺内皮细胞类型的比例变化并不显著。速度分析显示,尖端细胞位于静脉内皮细胞和毛细血管内皮细胞之间的发育和分化轨迹上,拟时轨迹分析的结果表明尖端细胞具有更强的分化能力。据报道,尖端细胞可以感知微环境中的缺氧水平和血管生长因子(VEGF)信号,是诱导肿瘤毛细血管网络形成的主要细胞类型。肿瘤在不同生长阶段依赖于血管生成来满足其代谢需求。在这项研究中,研究人员观察到PSN-LUAD样本中尖端细胞的比例高于GGN-LUAD样本,这可能是临床上观察到PSN-LUAD肿瘤侵袭和转移速度更快的一种潜在机制。
研究意义
04
本研究系统性地揭示了GGN-和PSN-肺腺癌(LUAD)细胞组成及免疫反应中存在的显著异质性,为理解LUAD的复杂生物学机制提供了新的视角。本研究发现IFN-γ(干扰素-γ)通过激活STAT1信号通路,调节CXCL9+TAMs与CD8+组织驻留记忆T细胞(Trm)之间的相互作用,这一发现揭示了IFN-γ在影响GGN-和PSN-LUAD侵袭与转移中的关键作用机制。 因此,本研究对于推动LUAD的免疫治疗研究和发展具有重要意义。
【参考资料】
https://molecular-cancer.biomedcentral.com/articles/10.1186/s12943-024-02177-7#Sec1
链接:http://www.lewenyixue.com/2024/11/27/%E8%82%BF%E7%98%A4%E4%BE%B5%E8%A2%AD%E4%B8%8E%E8%BD%AC%E7%A7%BB%E6%BD%9C%E5%9C%A8%E6%9C%BA%E5%88%B6%EF%BC%81%E6%88%90%E9%83%BD%E4%B8%AD%E5%8C%BB%E8%8D%AF%E5%A4%A7%E5%AD%A6%EF%BC%9A/