国内首篇铁死亡Cell论文:西湖大学邹贻龙/王曦团队揭示癌症转移与铁死亡易感性的关联,并提出治疗新策略
转移 是导致癌症相关死亡的主要原因,是管理癌症患者的一个紧迫的医疗挑战。 在卵巢癌病例中,循环癌细胞首先从血流、淋巴血管系统和/或腹腔液中的流体环境中渗出,然后到达远端器官。由于高机械应力和立即暴露于免疫监视和宿主器官后的清除,转移性外渗是一个低效的过程,只有一小部分癌细胞成功侵入目标组织实质。
癌细胞的各种内在特征和外在因素是实现外渗的必要条件,包括细胞运动性增强、癌细胞膜内脂质相行为改变,以及趋化因子、趋化因子受体和细胞-细胞黏附分子的改变。然而,我们对支持癌细胞转移性外渗的脂质组的特征仍然知之甚少。
2024年11月25日,西湖大学 邹贻龙 、 王曦 团队合作,在国际顶尖学术期刊 Cell上发表了题为: ACSL4 and polyunsaturated lipids support metastatic extravasation and colonization的研究论文 。
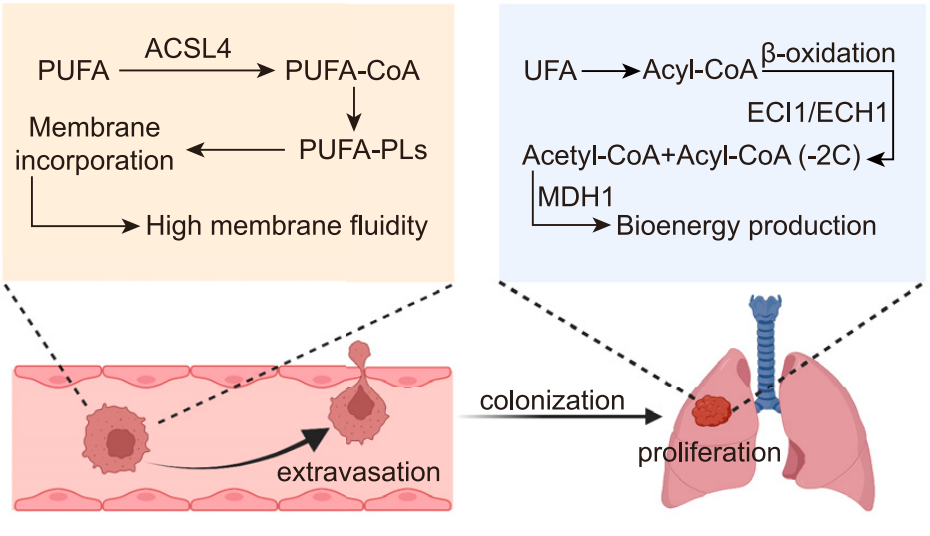
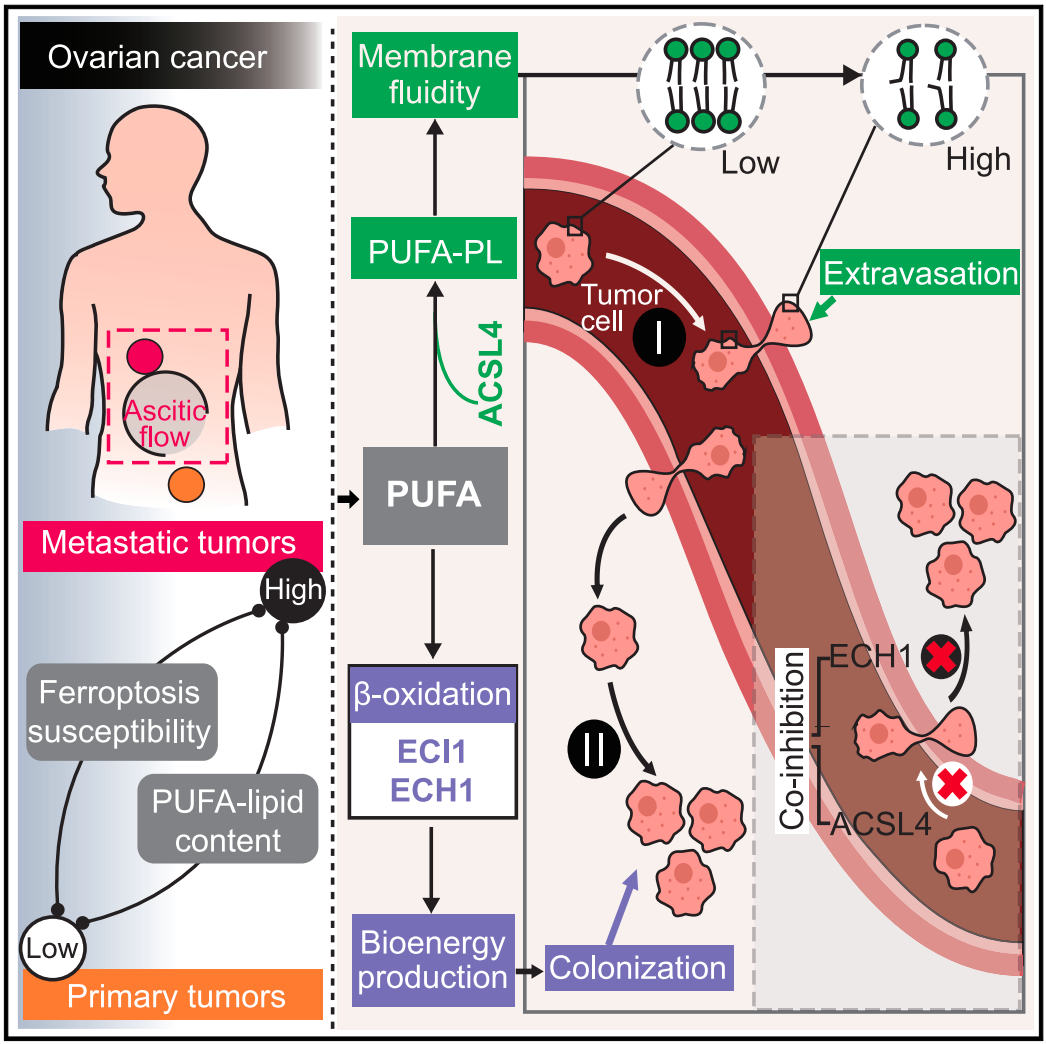
该研究 揭示了多种癌症的转移潜能和铁死亡易感性之间的相关性 ,转移的癌细胞具有更高的铁死亡敏感性和多不饱和脂肪酸脂质 (PUFA-Lipid)含量。 该研究发现 ACSL4是一种促血行转移因子,通过增强膜流动性和细胞侵袭性促进转移性外渗 。而ACSL4还通过促进多不饱和脂肪酸 (PUFA)向酰基辅酶A (acyl-CoA)的酯化发挥促进 铁死亡的作用。 该研究还发现, 多不饱和脂肪酸脂质在促转移的同时,依赖 ECH1等限速酶,因此, 共抑制ACSL4和ECH1,可有效抑制肿瘤转移。
总的来说, 该研究揭示了多不饱和脂肪酸脂质在肿瘤进展和转移中的双重功能,为开发靶向肿瘤转移的新型药物奠定了基础。
由于选择压力,到达远端器官的癌细胞可能继承了在循环和外渗期间最适合生存的脂质代谢特征;然而,这种脂质程序如何支持宿主组织微环境中重新激活的增殖仍然未知。
为了形成宏观转移灶,癌细胞在低营养可利用性的靶器官微环境中采用多种策略来满足高能量需求,包括激活线粒体生物发生和氧化磷酸化。
β-氧化 是脂肪酸在一系列酶的作用下,在α碳原子和β碳原子之间断裂,生成乙酰辅酶A (CoA),和较原来少两个碳原子的脂肪酰辅酶A。β氧化以高通量的乙酰辅酶A (CoA)为线粒体提供燃料,因此在支持体内癌细胞生长中发挥关键作用。然而,在传播的癌细胞中,发生β-氧化的脂肪酸的来源仍然缺乏表征。
在这项最新研究中,研究团队通过查询泛癌症表型数据库,包括癌症转移图谱 (MetMap)数据集和癌症治疗反应门户网站 (CTRP)中的泛癌细胞系的化合物敏感性数据集, 该研究发现,在一些癌症谱系中 (包括卵巢、肝脏和头颈部癌)高转移潜能与诱导铁死亡的易感性相关。利用从卵巢癌患者的原发灶和转移灶中新鲜分离的癌细胞进行的化合物敏感性分析证实,转移性肿瘤细胞的铁死亡易感性和多不饱和脂肪酸 (PUFA)-脂质含量升高。
接下来,研究团队进行了两轮体内克隆筛选,建立肝、肺转移效率较高的卵巢癌远端转移小鼠模型。随后的体内CRISPR筛选发现了多个转移前代谢基因,包括参与NAD生成的NMNAT1和参与PUFA-脂质生物合成ACSL4。 ACSL4通过增强膜流动性和促进迁移来特异性介导血源性播散过程中的转移性外渗。值得注意的是, ACSL4作为脂质代谢酶,通过促进多不饱和脂肪酸 (PUFA)向酰基辅酶A (acyl-CoA)的酯化,从而促进 铁死亡。 此外,高PUFA-脂质的转移细胞依赖于不饱和脂肪酸 (UFA) 的β-氧化在肿瘤微环境中生存。
研究团队还发现,上述特性可通过抑制参与C=C双键移位的限速酶——MDH1、ABHD6、ECI1或ECH1——来限制肿瘤的生长,为通过β-氧化和三羧酸循环途径分解UFA做准备。在卵巢癌和黑色素瘤肺转移模型中,联合抑制 ECH1和 ACSL4以阻断UFA代谢的两个步骤可协同抑制转移。
-
泛癌表型数据挖掘揭示转移-铁死亡敏感性之间的相关性;
-
聚焦代谢的体内CRISPR筛选揭示了ACSL4的促转移作用;
-
ACSL4通过增强膜流动性和侵袭性促进转移性外渗;
-
高不饱和脂肪酸脂质 的 肿瘤细胞依赖于ECH1等限速酶进行β-氧化和转移;
-
共抑制ACSL4和ECH1,可有效抑制肿瘤转移。
总的来说,该研究指出,卵巢癌进展依赖于不饱和脂肪酸至少两种看似独立的功能,包括其氧化以产生能量,以及并入磷脂以增强膜流动性、迁移潜能和外渗效率。这项研究为发生在卵巢和其他部位的转移性癌症提出了一种潜在的联合治疗策略。
值得一提的是, 该论文是国内首篇 铁死亡 研究的 Cell 论文,此前,国内铁死亡研究领域只有一篇 CNS 主刊论文——
2024年1月31日,同济大学医学院/附属第十人民医院 王平教授团队在 Nature期刊发表论文,发现并揭示了远端胆固醇合成通路关键酶通过调控 7-脱氢胆固醇 (7-DHC) 的水平来调控 铁死亡敏感性的机制,提出了通过药物调控7-DHC水平是一种有前途的治疗癌症和缺血再灌注损伤的新策略 。
西湖多维动态代谢组学核心实验室主任 邹贻龙博士和西湖基因组学与生物信息学核心实验室主任 王 曦 博士为论文共同通讯作者,西湖实验室助理研究员 王煜棋博士、西湖大学博士生 胡鋩泽及南京市妇幼保健院/南京医科大学附属妇产医院 曹剑医生为论文共同第一作者。
论文链接 : https://www.cell.com/cell/abstract/S0092-8674(24)01270-4
版权声明:本文为“乐问号”作者或机构在乐问医学上传并发布,仅代表该作者或机构观点,不代表乐问医学的观点或立场,不能作为个体诊疗依据,如有不适,请结合自身情况寻求医生的针对性治疗。
链接:http://www.lewenyixue.com/2024/11/27/%E5%9B%BD%E5%86%85%E9%A6%96%E7%AF%87%E9%93%81%E6%AD%BB%E4%BA%A1Cell%E8%AE%BA%E6%96%87%EF%BC%9A%E8%A5%BF%E6%B9%96%E5%A4%A7%E5%AD%A6%E9%82%B9%E8%B4%BB/
THE END







赶快来坐沙发