双靶点CAR-T细胞治疗:前沿进展与临床应用探索
嵌合抗原受体( CAR )T细胞已经复发性血液系统恶性肿瘤的治疗中取得了显著的成功,如急性淋巴细胞白血病( ALL )、非霍奇金淋巴瘤( NHL )和多发性骨髓瘤( MM )。CD19和B细胞成熟抗原( BCMA )是两种最成功的CAR靶点,具有良好的应答率。靶向CD19的已批准的CAR-T药物总有效率( ORR )达到70%以上,而靶向BCMA的idecabtagene vicleucel 和ciltacabtageneautoleucel分别达到73%和97%。然而,在使用CAR-T细胞治疗的患者中,至少有50%仍会出现复发或进展。
CAR-T细胞治疗后复发的主要机制在于CAR-T细胞的有限持久性、CAR-T细胞功能抑制和抗原逃逸。为了最大限度地减少因靶点逃逸而复发的风险,临床试验中正在积极探索双靶点CAR-T识别一种以上肿瘤相关抗原的策略。这种策略可以通过使用两种具有不同抗原结合特异性的混合CAR-T细胞或能够靶向两种不同抗原的单个CAR-T细胞来实现。
目前,在血液系统恶性肿瘤的临床前模型和临床试验中,双靶点CAR-T细胞治疗的抗原至少有三种组合:CD19/CD20、CD19/CD22以及BCMA/CD38。最近,双靶点CAR-T在临床上的使用越来越多,从披露的综合临床数据中,双靶点CAR-T展现出极富前景的应用价值。
用于双靶点 CAR-T 细胞治疗的主要 CAR 结构包括: 单靶点 CAR 混合、二价串联 CAR 、二价环形 CAR 和双顺反子 CAR 。 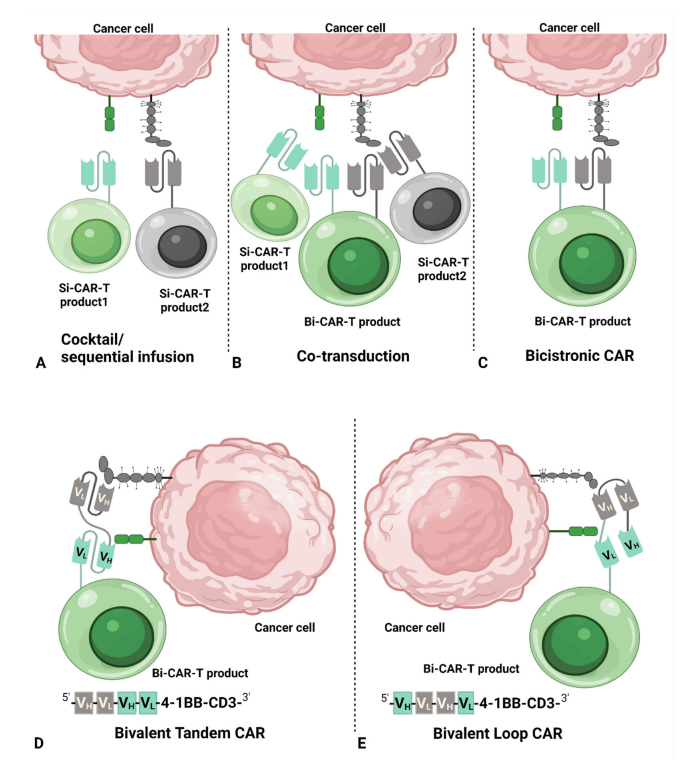
通过分别用两种不同载体转导T细胞可以产生两种单独的CAR-T细胞产品。然后,将两种单独的CAR-T细胞以1:1的比例混合在一起,同时输注或者进行序贯输注。
另一种方法可以通过T细胞与两个单独载体的共转导产生,每个载体编码一个单独的CAR结构。在最终的混合产物中包含两个单独的单靶点CAR-T细胞和一个双靶点CAR-T细胞。
双顺反子CAR-T细胞是将一个双顺反子载体引入T细胞以在同一个T细胞产生两个不同的CAR,其中每个CAR靶向不同的抗原结合域。
二价串联CAR-T细胞是将一个二价载体引入T细胞以产生双结构域。通过将单链抗体片段( scFv )的轻链可变结构域( VL )和重链可变结构域( VH )按不同顺序排列,可以形成两种不同的结构:串联和环形。串联结构由一个单链抗体的VL-VH直接连接到另一个单链抗体的VL-VH形成,而环状结构由一个单链抗体的VL-VH夹在另一个单链抗体的VH-VL中间形成,区别于二价串联CAR。
与单靶点CAR-T细胞治疗相比,双靶点CAR-T细胞治疗的优势在于其能够减少肿瘤细胞的抗原逃逸。单靶点CAR-T细胞治疗的临床研究已经显示超过90%的完全响应( CR ),在双靶点CAR-T细胞治疗的初始反应方面几乎没有改善的空间。因此,双靶点CAR-T细胞治疗的期望不仅是提高反应的持久性,而且是在使用单靶点CAR-T细胞治疗后复发或难治的患者中重新产生响应。
在少数研究中,双靶点CAR-T细胞疗法似乎已证明DOR和OS优于单靶点CAR-T细胞。例如,接受CD19单靶点CAR-T细胞治疗的患者的OS与接受CD22单靶点CAR-T细胞治疗的患者接近,但比接受CD19/CD22双靶点CAR-T细胞治疗的患者的OS短。在非霍奇金淋巴瘤中,CD19/CD20双靶点CAR-T细胞治疗的PFS和OS的百分比高于CD19单靶点CAR-T细胞。
CD19/CD20或CD19/CD22的双靶点CAR-T的设计策略基于这样的假设,即靶向CD20或CD22将有利于减少CD19的抗原逃逸。已披露的数据表明,靶向CD22或CD20的单靶点CAR-T细胞治疗或双靶向CAR-T细胞治疗可以使CD19逃逸的患者获得CR。特别是,七名先前接受过CD19单靶点CAR-T细胞治疗的患者,其中五名患者在接受双靶点CAR-T细胞治疗后获得CR。因此,临床数据支持CD19/CD20或CD19/CD22双靶向CAR-T细胞治疗用于对CD19-CAR-T细胞治疗耐药的复发患者。
另外,在多发性骨髓瘤中,BCMA-CAR和第二个CAR的组合仍在探索。BCMA/CD19和BCMA/CD38的双靶点CAR-T细胞疗法已进入临床,而BCMA/CS1( SLAMF7 )和BCMA/GPRC5D双靶点CAR-T细胞疗法即将进入临床。BCMA/CD19双靶点CAR-T细胞治疗在一小部分患者中显示出令人振奋的疗效,五名患者的ORR为100%,只有一个3级的细胞因子释放综合征( CRS )发生,没有神经毒性( NT )发生。此外,BCMA/CD38双靶点CAR-T细胞也显示出良好的效果。在使用BCMA/CD38双靶点CAR-T细胞治疗后,8例sCR患者中有5例在中位随访9个月时仍保持sCR,9个月的PFS为75%。
理论上,双靶点 CAR- T 细胞治疗由两种抗原刺激,这就产生了一个问题,即患者的 CAR-T 细胞激活是否会比单靶点 CAR-T 细胞更强,从而导致不良事件的发生率高于单靶点 CAR-T 细胞?
已有的数据表明,在单靶点CAR-T细胞和双靶点CAR-T细胞治疗之间,1-2级CRS的发生率相似。在可用的已报告的研究中,单靶点CAR-T细胞治疗的九个临床试验中有两个(22.2%)没有报告3-4级CRS,而双靶点CAR-T细胞在八个临床试验中有三个(37.5%)没有报告3-4级CRS。另外,42.9%(3/7)的单靶点CAR-T细胞临床试验未报告3-4级NT,而双靶点CAR-T细胞则有50%(4/8)未报告3-4级NT。
通过简单的数字比较,可以发现,与单靶点CAR-T细胞治疗相比,双靶点CAR-T细胞治疗并未产生更严重的CRS和NT,反而更低。当然,考虑到样本量、不同的临床适应症以及在CAR-T细胞治疗早期对CRS和NT的管理,似乎需要更多的研究来证实这一结论。
虽然 CAR-T 细胞治疗在血液恶性肿瘤中取得了卓越的成效,但是复发的问题依然严峻。 为了克服 CAR-T 细胞治疗的肿瘤免疫逃避,多靶点的 CAR-T 细胞治疗已成为目前研究的热点。 双靶点的 CAR-T 细胞治疗的疗效已经在部分临床试验中得到了验证,双靶点 CAR-T 细胞的安全性似乎也优于单靶点 CAR-T 细胞,严重 CRS 和 NT 的发生率均较低。
然而,在双靶点CAR-T细胞治疗中,如何实现1+1>2,仍然需要对CAR靶点的选择以及CAR结构进行进一步的优化。总之,双靶点CAR-T细胞治疗仍然处于早期的发展阶段,需要更多临床前和临床试验数据的支持,相信其未来一定会在肿瘤免疫治疗中发挥出独特而关键的作用。
参考文献:
1.Current Status and Perspectives ofDual-Targeting Chimeric Antigen Receptor T-Cell Therapy for the Treatment ofHematological Malignancies. Cancers (Basel).2022 Jul; 14(13): 3230.
链接:http://www.lewenyixue.com/2024/11/27/%E5%8F%8C%E9%9D%B6%E7%82%B9CAR-T%E7%BB%86%E8%83%9E%E6%B2%BB%E7%96%97%EF%BC%9A%E5%89%8D%E6%B2%BF%E8%BF%9B%E5%B1%95%E4%B8%8E%E4%B8%B4%E5%BA%8A/