代谢失衡与免疫的双重奏——癌症产生和发展的“帮凶”
在这个快节奏的时代,我们的饮食和生活方式正在无形中重塑着身体的代谢节奏。但你知道吗?代谢的微妙变化不仅影响着我们的体重和血糖,更在悄悄改变着我们的免疫系统,代谢紊乱不仅是糖尿病、肥胖等疾病的元凶,还可能成为癌症进展的帮凶!
当我们的代谢系统出现紊乱,如肥胖、糖尿病等,体内的巨噬细胞和T细胞——这两位免疫系统的主力军——也会受到影响。 它们是免疫反应的前线士兵,负责清除感染和监控肿瘤。然而,代谢物的失衡会改变它们的功能,从而影响局部和全身的免疫状态。想象一下,巨噬细胞在肿瘤微环境中,因为代谢紊乱而“昏昏欲睡”,不再能有效攻击癌细胞,反而成为肿瘤细胞的盟友,变成了CD8 T细胞的敌人;T细胞也因为同样的紊乱而失去了对肿瘤的监控能力,打破了原本的免疫平衡,肿瘤细胞挟持调节性T细胞(Treg)为自己所用,维持住免疫抑制环境。这不仅让癌症有了可乘之机,也让代谢紊乱类疾病更加顽固。 科学家们正在研究如何通过调节代谢来恢复这些免疫细胞的功能,以期达到治疗疾病的目的。 通过特定的饮食、药物或生活方式的改变,我们或许能够重置免疫细胞的活力,让它们重新成为身体的守护者。
小编带大家一起来阅读一下代谢类紊乱疾病(肿瘤)中巨噬细胞和T细胞的交互作用的文章,第一篇发表在 Nature Review Cancer(IF = 72.5) 杂志上,题为“ Macrophages and T cells in metabolic disorder-associated cancers 巨噬细胞和T细胞在代谢紊乱相关癌症中的作用 ”的文章,这篇文章主要综述了由非遗传性因素引起的代谢紊乱,探索在肥胖、MASLD、MASH和T2D背景下巨噬细胞和T细胞的表型适应、起源和调节肿瘤的能力。进一步描述代谢物和营养物质对巨噬细胞和T细胞的影响,以及它们在代谢紊乱发病机制和相关癌症发展中的作用。通过探索代谢紊乱相关癌症中巨噬细胞和T细胞之间异质性细胞通讯,提出观点:最初旨在治疗代谢紊乱疾病时,如何加入改变巨噬细胞和T细胞功能、宿主全身免疫和肿瘤发生的能力,如何限制或增强抗肿瘤治疗的有效性。

癌症长期以来被视为一种代谢性疾病,代谢重编程目前被认为是癌症发生和发展的关键条件。代谢紊乱患者发展成为癌症的风险增加, 导致代谢紊乱的风险因素主要包括遗传因素、久坐的生活方式和过度热量摄入 ;代谢紊乱中,大多数代谢物(如氨基酸脂质和糖类)增加,氨基酸失衡可能与代谢紊乱报道中强调的谷胱甘肽水平降低有关。代谢失衡可以直接诱导氧化应激、内质网(ER)应激和下游的活性氧(ROS),继而引起DNA损伤或DNA修复受损。代谢物可以通过抑制凋亡途径,抑制肿瘤抑制因子或激活致癌基因来改变致癌信号通路。此外,代谢物可以直接促进癌症后期阶段的肿瘤细胞增殖。
巨噬细胞在代谢紊乱和癌症中的作用
促炎巨噬细胞倾向于依赖糖酵解过程供能,抗炎巨噬细胞倾向于依赖氧化磷酸化和脂肪酸氧化过程供能。在代谢紊乱中,巨噬细胞会形成花环样结构(CLSs),肥胖患者的脂肪组织部位以及遗传性和饮食诱导的肥胖小鼠模型中、乳腺癌患者癌组织中的脂肪沉积中也检测到CLSs。在这种CLSs会促进炎症级联反应进而引起胰岛素抵抗。
巨噬细胞可以适应周围环境中代谢物的变化,这表明代谢紊乱相关的代谢物改变可以调节巨噬细胞的丰度和表型 (图2a-c) 。接下来作者通过描述几个代谢紊乱小鼠模型结构描述代谢物对巨噬细胞介导的炎症反应调节作用,比如胆固醇血症小鼠模型中,氧化磷脂的摄取驱动巨噬细胞的促炎表型,维持全身炎症状态,加剧代谢紊乱;肥胖小鼠模型中,谷氨酰胺合成酶低表达与脂肪组织内促炎特征相关,当给予小鼠谷氨酰胺补充时,会改变脂肪组织中积累的额CD11c+巨噬细胞比例,这强调谷氨酰胺在调节代谢紊乱中巨噬细胞极化中的作用。
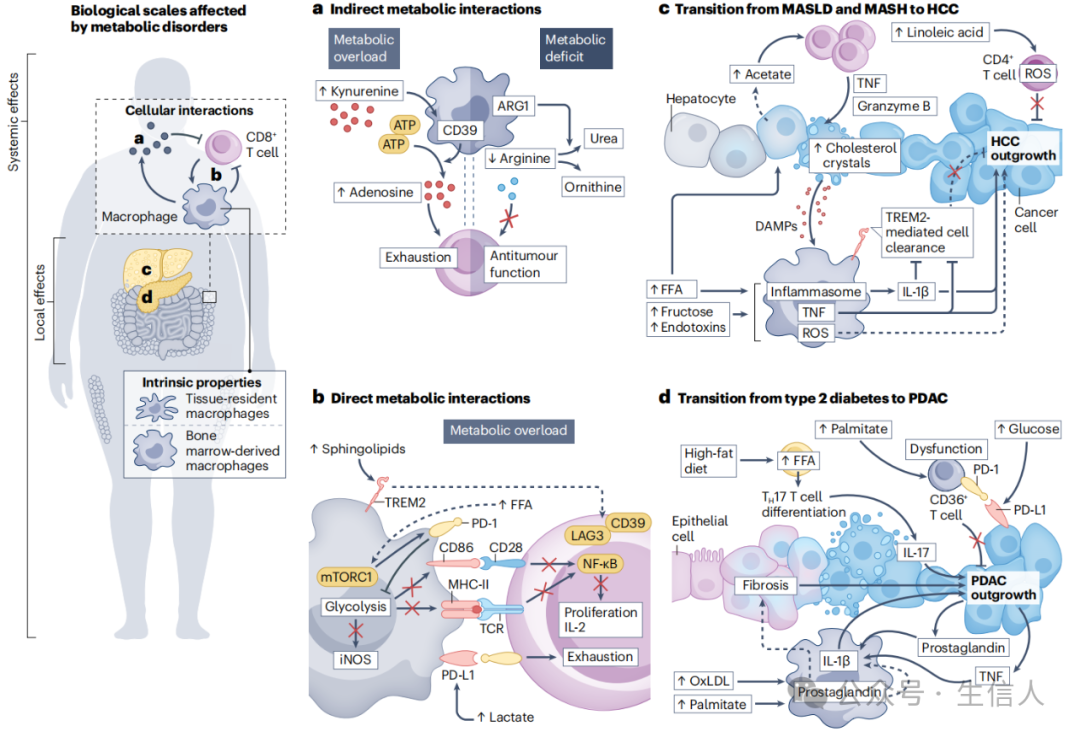 图2 代谢物失衡改变免疫细胞表型,促进致癌转化
图2 代谢物失衡改变免疫细胞表型,促进致癌转化
代谢紊乱和癌症中出现 脂质相关巨噬细胞(LAMs) ,在疾病的产生和进展中发挥着重要作用。它们至少部分依赖于代谢物的暴露形成,尤其是脂质。比如在乳腺癌患者中LAMs与较差的预后相关;前列腺癌小鼠模型中,高脂饮食(HFD)喂养会增加LAMs产生。在携带HFD喂养的肥胖结直肠癌小鼠模型中发现,PD-1表达增加,进而导致巨噬细胞的吞噬能力降低脂质摄取增加,当进行PD-1阻断以后,会恢复巨噬细胞的吞噬能力和对糖酵解的依赖(促进抗炎)进而赋予这些TAMs抑制肿瘤的能力。此外研究表明不同胆汁酸以不同方式影响巨噬细胞极化,比如HFD会增加次级胆汁酸去氧胆酸(DCA)产生,它可以以TLR2依赖性方式促进巨噬细胞M1型极化,而次级胆汁酸鹅去氧胆酸(LCA)则通过与TGR5结合,促进M2型巨噬细胞极化。这些发现强调巨噬细胞衍生的代谢物可以塑造局部环境,使其更有利于肿瘤的进展。
T细胞在代谢紊乱和癌症中的作用
在代谢紊乱中,T细胞数量和表型也发生了适应性改变,如在肥胖症患者和肥胖小鼠模型中,T细胞表现出衰竭和功能障碍的迹象。目前已有的研究表明代谢紊乱对局部和系统性T细胞功能有深远的影响,可能通过T细胞功能障碍、降低免疫监视和/或T细胞驱动的炎症能力,塑造宿主对癌症发展的易感性。
T细胞在激活过程中经历了代谢重编程,这个过程包括有氧糖酵解和氨基酸以及脂质的摄取,这使得T细胞非常容易受到周围环境代谢特征变化的影响。例如,氨基酸对于抗肿瘤和T细胞活动至关重要,代谢紊乱相关的氨基酸失衡可以调节T细胞的功能 (图1b) 。T细胞的活性和分化也可以通过脂质调节,黑色素瘤肺转移小鼠模型中,肿瘤内过量的胆固醇使瘤内CD8+ T细胞积累,促进内质网应激和免疫检查点分子上调,抑制它们抗肿瘤能力。代谢紊乱可以调节癌细胞如何利用脂质,因此影响邻近的T细胞。在皮下结直肠癌的HFD喂养小鼠模型中,由于与肥胖相关的肿瘤代谢重塑,CD8+ T细胞活性受损,其中肿瘤细胞增加FFA的使用以维持它们的生长,导致TME中FFA的耗竭,从而减弱了CD8+ T细胞的浸润和抗肿瘤功能。
巨噬细胞和T细胞的crosstalk
乳酸可以影响巨噬细胞极化为再生表型,并诱导巨噬细胞程序性死亡配体1(PD-L1)的表达,通过与PD-1结合来抑制T细胞活性;犬尿氨酸,一种在肥胖中增加的色氨酸代谢产物,上调TAMs上的CD39表达,通过产生具有免疫抑制特性的腺苷来抑制T细胞。这些发现共同表明,治疗性调节巨噬细胞亚群可能增强与代谢紊乱相关癌症的抗肿瘤免疫。巨噬细胞还可以在TME中促进代谢失调,影响T细胞功能。
鉴于巨噬细胞可以产生犬尿氨酸,这可能是代谢紊乱相关癌症中另一种代谢物介导的和巨噬细胞介导的免疫抑制机制,仍需进一步研究。在MASH患者和MASLD临床前模型中,肝巨噬细胞中上调的代谢物衣康酸,通过表观遗传调控在HCC中诱导CD8+ T细胞功能障碍。因此, 巨噬细胞在代谢紊乱相关癌症的T细胞反应形成中的作用,以及代谢紊乱诱导的局部和系统性代谢物变化是否影响这种交流 ,仍有待进一步探索。在 有发展癌症高风险的代谢紊乱患者中,治疗性调节巨噬细胞的招募和含量可能是有用的。
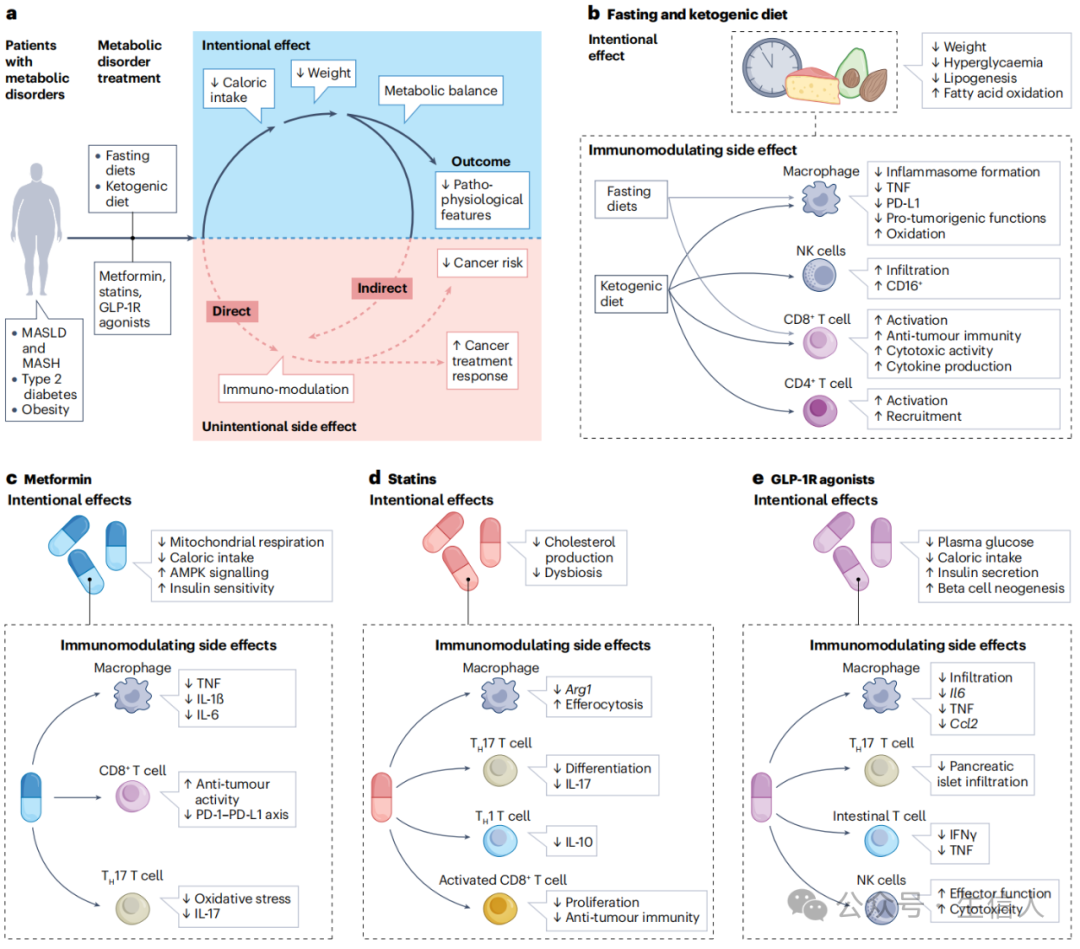 图3 代谢紊乱靶向治疗以免疫代谢依赖的方式干扰癌症的发生和进展
图3 代谢紊乱靶向治疗以免疫代谢依赖的方式干扰癌症的发生和进展
饮食和治疗干预措施对治疗代谢紊乱均有益处,可以降低患者热量摄取和体重,恢复代谢平衡和代谢紊乱造成的其他病理生理特征;同时这些干预还会改变免疫表型,这可能降低癌症风险或改善癌症患者的治疗反应。通过禁食饮食和生酮饮食干预,会导致体重降低、高血脂降低脂肪生成减少,同时增加脂肪酸氧化,饮食引起的代谢变化会影响免疫系统的改变。二甲双胍用于治疗T2D,不仅是因为它能够增加胰岛素敏感性,而且还会降低热量摄入,此外二甲双胍还具有免疫调节功能,降低髓样细胞(包括巨噬细胞)促炎倾向,降低TH17下拨产生氧化应激和白介素17,增加CD8+ T细胞的抗肿瘤能力。他汀类药物用于治疗高胆固醇血症,不仅能够降低心血管疾病风险,而且具有免疫调节特性,可以改变巨噬细胞、TH17细胞、TH1细胞的分化并激活CD8+ T细胞增殖。胰高血糖素样肽1受体(GLP-1R)原本用于治疗T2D,但是目前发现其可改变巨噬细胞、肠道T细胞、TH17细胞和NK细胞的促炎表型。
第二篇文章发表在 Trends in cancer(IF = 14.3) 杂志上,题为“ Metabolic interplay: tumor macrophages and regulatory T cells 代谢相互作用:肿瘤巨噬细胞和调节性T细胞 ” 的文章,本文系统描述了代谢物如何影响肿瘤相关巨噬细胞(TAM)和调节性T细胞(Tregs)的免疫抑制表型,讨论了TAMs和Tregs如何利用代谢机制来抑制CD8+ T细胞的活性,最后基于已有的研究结果,提出:进行代谢干预,有望改善当前癌症治疗的效果。
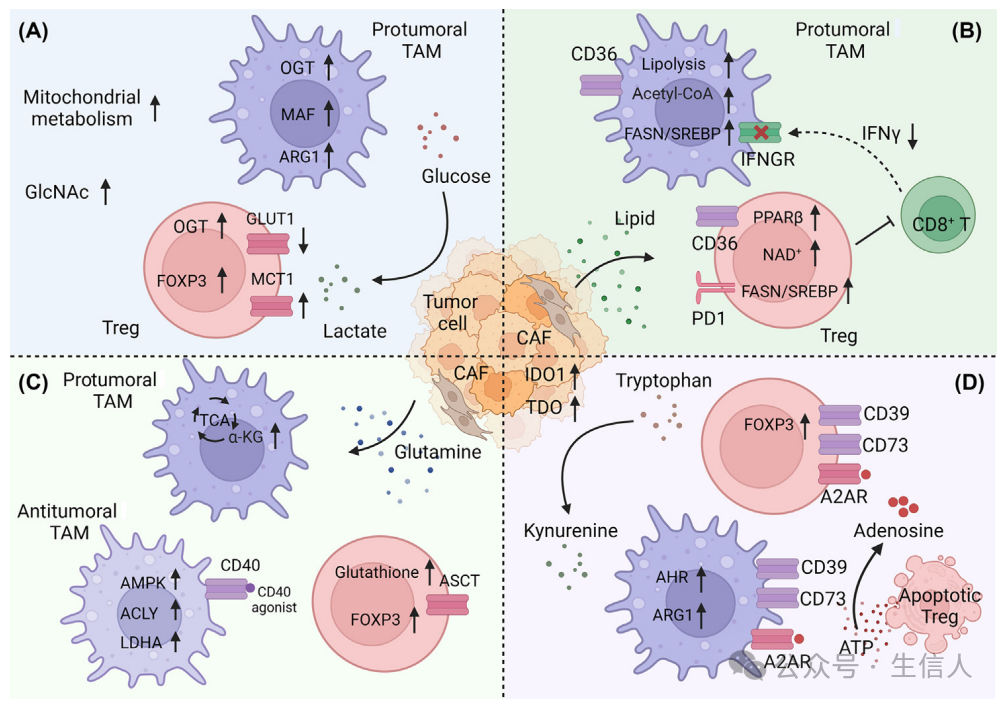 图1 TME中代谢物引导TAM和Tregs的极化
图1 TME中代谢物引导TAM和Tregs的极化
版权声明:本文为“乐问号”作者或机构在乐问医学上传并发布,仅代表该作者或机构观点,不代表乐问医学的观点或立场,不能作为个体诊疗依据,如有不适,请结合自身情况寻求医生的针对性治疗。
链接:http://www.lewenyixue.com/2024/11/21/%E4%BB%A3%E8%B0%A2%E5%A4%B1%E8%A1%A1%E4%B8%8E%E5%85%8D%E7%96%AB%E7%9A%84%E5%8F%8C%E9%87%8D%E5%A5%8F%E2%80%94%E2%80%94%E7%99%8C%E7%97%87%E4%BA%A7%E7%94%9F%E5%92%8C%E5%8F%91%E5%B1%95/
THE END
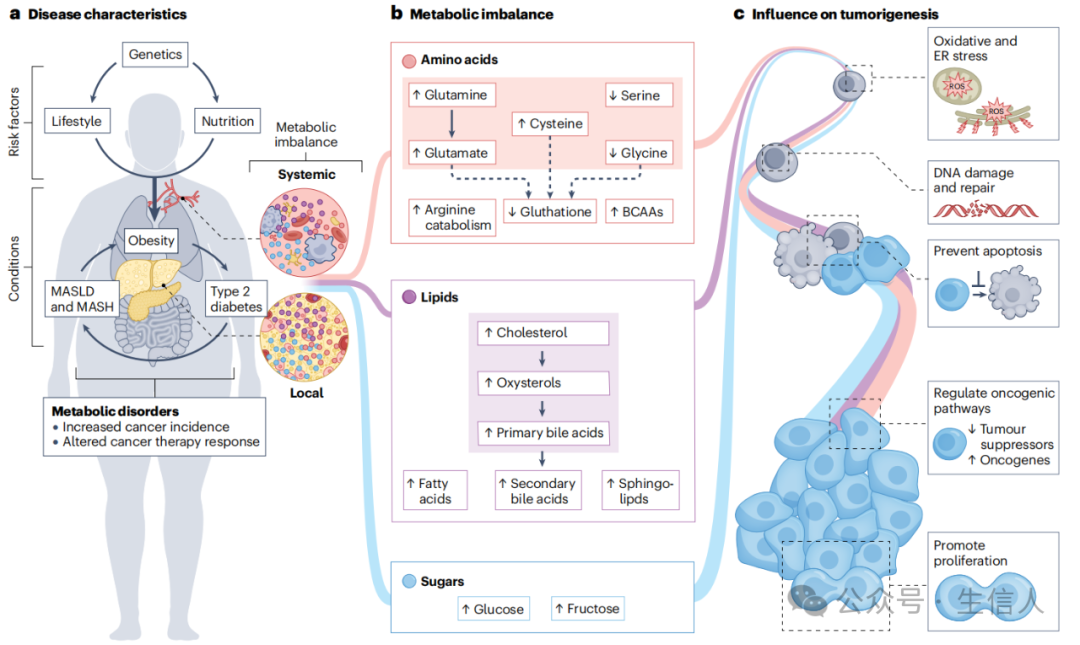
 图3 代谢紊乱靶向治疗以免疫代谢依赖的方式干扰癌症的发生和进展
图3 代谢紊乱靶向治疗以免疫代谢依赖的方式干扰癌症的发生和进展 
 图1 TME中代谢物引导TAM和Tregs的极化
图1 TME中代谢物引导TAM和Tregs的极化 





 知道|国家药品不良反应监测年度报告(2024年)
知道|国家药品不良反应监测年度报告(2024年)
赶快来坐沙发