【DCR专区 | 每月精选文章】结直肠癌主动脉旁淋巴结转移手术切除后的长期疗效:一项多中心回顾性研究
翻译: 唐彬 湖南省湘潭市中心医院,杨辉 山东第一医科大学第一附属医院
审校: 池诏丞 吉林省肿瘤医院
摘要
背景: 结直肠癌主动脉旁淋巴结转移手术切除的意义存在争议。
目的: 明确结直肠癌主动脉旁淋巴结转移手术切除的预后。
设计: 多中心回顾性研究。
设定: 日本 36家机构参与本研究。
病人: 2010年至2015年间进行手术切除并病理确诊为主动脉旁淋巴结转移的结直肠癌病人。
数据来源: 各机构的数据库和病历资料。
主要结局指标: 主动脉旁淋巴结转移切除后的总体生存率,主动脉旁淋巴结转移 R0切除术后的无复发生存率、复发方式。
结果: 本研究的主要分析人群共纳入 133名病人。5年总体生存率为41.0%[95% CI:32.0~49.8],中位生存期为4.1年( 95%CI : 3.4~4.7)。影响总体生存的独立预后因素包括病理T分期[pT4 vs. pT1-3,调整后风险比 ( aHR ) : 1.91, P =0.006]、其他脏器转移(有转移 vs. 无转移,aHR:1.98, P =0.005)、转移时间(同时性转移 vs. 异时性转移,aHR:2.02, P =0.02)以及主动脉旁淋巴结转移数量(≥3 vs. <3,aHR:2.13, P =0.001)。5年无复发生存率为21.1%( 95%CI : 13.5~29.7),中位时间为1.2年( 95%CI : 0.9~1.4)。无复发生存的独立预后因素包括原发肿瘤位置(左半结肠 vs. 右半结肠,aHR:4.77, P =0.01;直肠 vs. 右半结肠,aHR:5.27, P =0.006)、其他脏器转移(有转移 vs. 无转移,aHR:1.90, P =0.03)、主动脉旁淋巴结转移数量(≥3 vs. <3,aHR:2.20, P =0.001)以及医院病例数(<10 vs. ≥10,aHR:2.18, P =0.02)。主动脉旁淋巴结复发最为常见,发生率为33.3%。
局限性: 由于研究的回顾性特征,不排除存在选择偏倚。
结论: 主动脉旁 淋巴结转移数少于 3个是总体生存率和无复发生存率的有利预后因素。然而,主动脉旁淋巴结转移被认为是一种全身性疾病,其手术意义仍有限。
关键词: 腺癌;结直肠癌;结直肠外科;淋巴结清扫;主动脉旁淋巴结转移
结直肠癌( CRC)是一种在全球范围内发病率和死亡率均较高的恶性疾病,而且至少2%的结直肠癌病例存在主动脉旁淋巴结转移(paraaortic lymph node metastases,PALNM)。PALNM通常被视为一种全身性疾病,因为腹主动脉区域是腹盆腔脏器淋巴液汇入胸导管的位置。根据日本结直肠癌学会(Japanese Society for Cancer of the Colon and Rectum,JSCCR)和美国癌症联合委员会的分类,PALNM被视同远处转移。
结直肠癌的远处转移如果可以完全切除,外科手术是治疗的首选方法。主动脉旁淋巴结清扫( Paraaortic lymph node dissection,PALND)是一种高风险手术,需沿自主神经表面将腹主动脉和下腔静脉周围的脂肪组织进行整块切除。尽管在1990年前后日本许多中心对左半结肠癌和直肠癌常规开展了预防性或治疗性PALND,但目前主要开展治疗性清扫,并且适应证受到限制。
虽然 PALND的重要性以及适合人群仍不明确,但近年来有些研究指出,对于转移局限于肾静脉水平以下的病人,手术切除可能改善预后。但是,所有相关研究都是回顾性的,并且是在单个中心或少数中心进行的。在本研究中,我们收集了来自多个中心的病例,其数量远多于既往研究。我们的目标是明确结直肠癌中PALNM的临床病理特征以及手术切除的预后。
病人选择
由 JSCCR设立的PALNM研究组中的36个医院参与了本研究,其中包括综合医院、大型医疗中心和学术中心。纳入此回顾性研究的病例为2011年1月至2015年12月期间确诊为原发性结直肠腺癌伴PALNM并接受了PALNM切除的病人,且病理诊断明确。复发性PALNM也被纳入研究。诊断标准为至少满足以下一项:(1)术前CT显示主动脉淋巴结(paraaortic lymph node,PALN)肿大;(2)术前PET-CT显示PALN中氟-18-脱氧葡萄糖( fluorine 18 fluorodeoxyglucose,FDG)摄取;(3)术中发现PALN肿大。手术方式包括解剖性切除和选择性切除。手术切除PALN但没有发现病理性转移的病例、有其他盆腹部恶性肿瘤治疗史的病例、原发肿瘤为阑尾的病例被排除在外。此外,缺失后文所述评估因素的病例也被排除。本回顾性调查于2021年4月至2022年3月期间进行。
本研究获得了 JSCCR(95-1)和东京医科齿科大学(M2020-357)伦理审查委员会的批准。本研究的知情同意书源于研究机构网站上发布的选择退出方式。
评估因素
研究的终点包括 PALNM切除后的总体生存率(overall survival,OS),R0切除后的无复发生存率(recurrence-free survival,RFS)及复发部位。收集的评估因素包括年龄、性别、原发肿瘤位置、组织学类型、肿瘤病理浸润深度、病理性淋巴结(lymph node,LN)转移、是否存在盆腔侧方淋巴结转移或其他脏器转移、治疗前的癌胚抗原(carcinoembryonic antigen,CEA)水平和糖类抗原19-9(carbohydrate antigen 19-9,CA19-9)水平、转移时间(同时性或异时性)、PALN的手术方式(解剖性切除和选择性切除)、手术根治性、是否进行术前或术后化疗、PALN的清扫数量、PALNM的数量、复发情况和复发部位。这些因素均通过各参与机构的数据库、病历资料和影像数据回顾性收集。评估因素缺失的病例被排除在研究外。
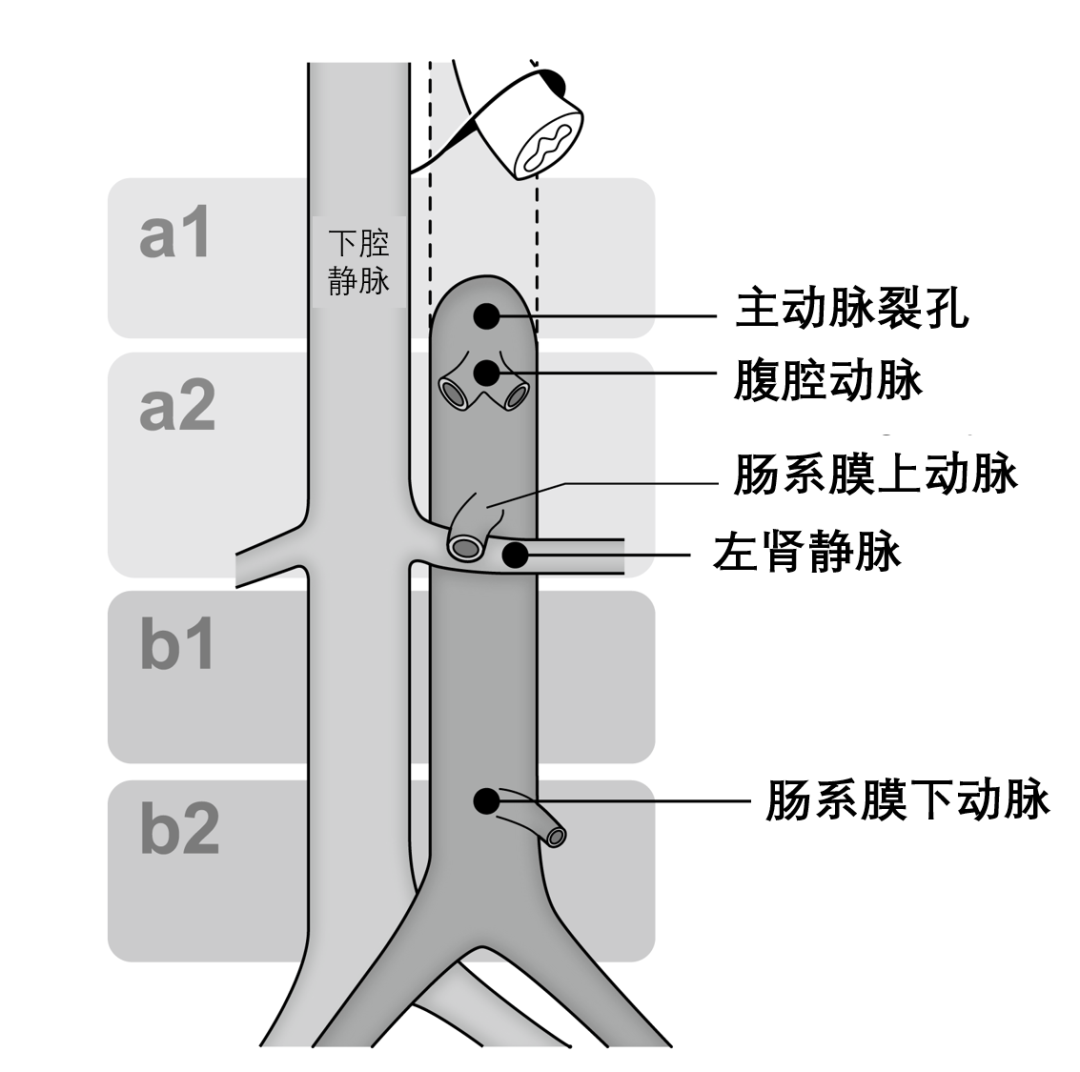
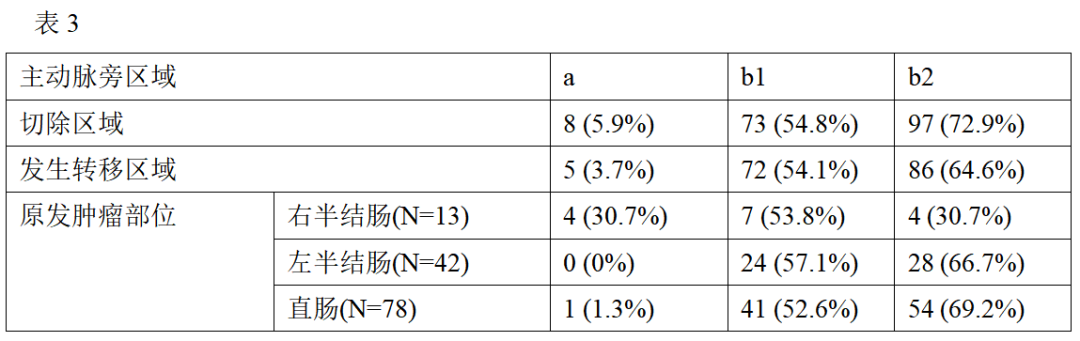
根据病理标本确定原发肿瘤分期。若原发肿瘤位于盲肠、升结肠和横结肠,则定义为右半结肠;若位于降结肠、乙状结肠和直肠,则定义为左半结肠。肿瘤的分期和手术根治性根据 JSCCR的分类进行描述。确诊为原发肿瘤后不足2个月内发现的转移被定义为同时性转移,而超过2个月后发现的则定义为异时性转移。术前化疗定义为在PALNM诊断和外科切除之间进行的化疗,无论其目的如何(如新辅助或转化治疗)。PALN的定位基于日本临床肿瘤学会的分类:位于腹主动脉和下腔静脉周围的淋巴结可分为以下四组;a1组,淋巴结位于主动脉裂孔区域;a2组,淋巴结位于腹腔干最上部到左肾静脉下缘之间的区域;b1组,淋巴结位于左肾静脉与肠系膜动脉下起始部之间的区域; b2组,淋巴结位于肠系膜动脉下起始部与主动脉分叉之间的区域(见图1)。盆腔侧方淋巴结指的是髂内淋巴结、髂总淋巴结和闭孔淋巴结。根据JSCCR的定义,侧方淋巴结转移分期为N3。淋巴结切除方式分为解剖性切除和选择性切除。解剖性切除是指清扫a、b1和b2区域内所有脂肪组织,而选择性切除则仅切除肿大的淋巴结。
随访
根据 JSCCR的指南进行随访。病人每3个月接受一次体格检查和血液检验,每6个月进行一次CT检查,每1-2年进行一次结肠镜检查,持续至少5年。
统计分析
本研究的主要分析人群中排除了评估因素变量数据存在缺失的病人。的人口学及临床的连续变量以均数(标准差)和中位数(四分位数范围、最小值和最大值)表示。人口学及临床的分类变量以频率(百分比)表示。使用 Mann–Whitney检验比较不同手术方式(选择性切除与解剖性切除)获取的主动脉旁淋巴结的数量和转移数量。使用Kaplan–Meier方法估计OS和RFS的生存函数。基于人口学和基础临床特征使用双侧log-rank检验比较OS和RFS随时间的变化。为了解影响PALNM切除后的OS和R0切除后RFS的预后因素,我们进行了单变量和多变量Cox回归分析,计算每个终点的风险比(hazard ratio,HR)及其对应的95%置信区间(confidence interval,CI)。在考量变量之间的临床相关性时,我们从所有评估因素中选出14个变量进行分析(称为评估变量),但不包括盆腔侧方淋巴结转移、手术根治性、本研究5年期间医院的病例数(≥10或<10)。在多变量Cox回归分析中,采用前向逐步选择法选择预后因素,模型中纳入因素所需的显著性水平为0.05,剔除因素所需的显著性水平为0.05。使用敏感性分析评估多变量Cox回归分析中排除评估变量数据缺失病人后对分析人群的影响。具体来说,我们使用多重插补法为多变量Cox回归分析中选择的评估变量填补缺失数据,并通过结合分析结果用Rubin规则评估每个变量对OS和RFS的影响。此外,我们对于RFS进行了竞争风险分析,将死亡事件视为复发的竞争风险。通过Kaplan–Meier程序计算复发的累积发生率曲线,并使用双侧Gray检验(考虑竞争风险的修正log-rank检验)和Fine和Gray亚分布风险模型比较协变量(即人口学和基线临床特征)的影响。该竞争风险分析评估了协变量对复发的亚分布风险的影响,而不是对复发的特定原因风险的影响。双侧 P <0.05被视为具有统计学意义。所有统计分析均使用SAS软件进行(版本9.4;SAS Institute Inc.,Cary,NC,USA)。
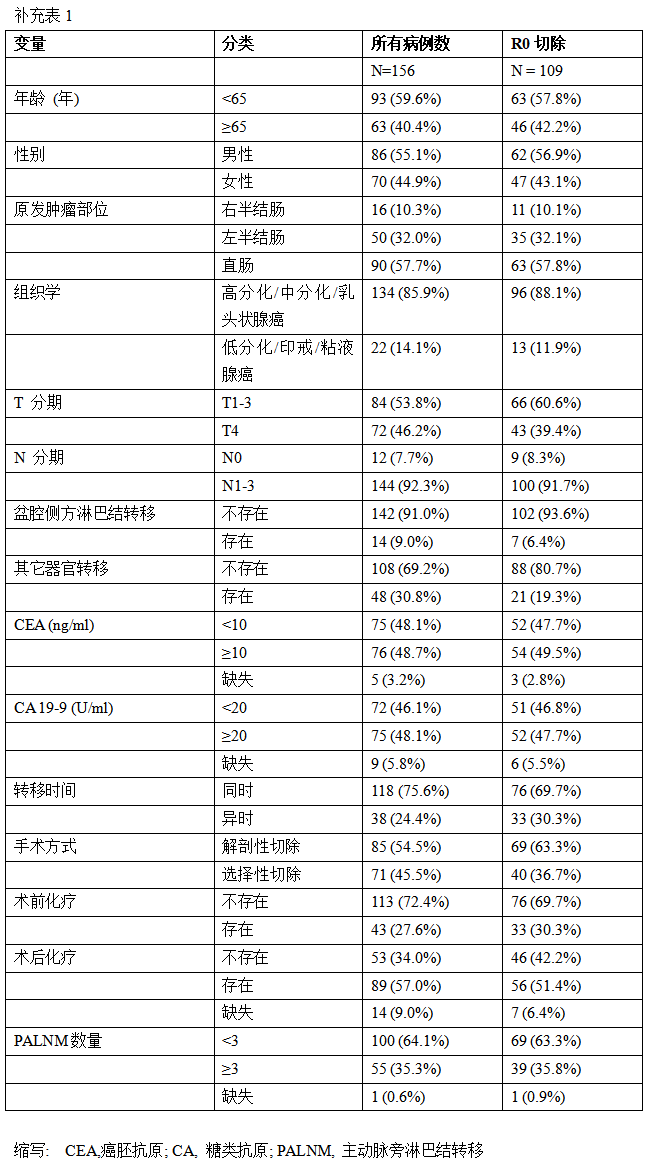
156例病人经过临床明确诊断后,行原发性结直肠癌PALNM切除术,并经组织病理学诊断为淋巴结转移阳性。研究排除了23例评估因素缺失的病人(其中包含CEA 5例,CA19-9 9例,术后化疗14例,PALNM 1例),最终将133例病人纳入主要分析人群(见补充表1) 。整个队列的中位随访期(最短,最长)为3.4(0.04 , 9.4)年,R0切除病人的中位随访期为4.1(0.04 , 9.4)年。
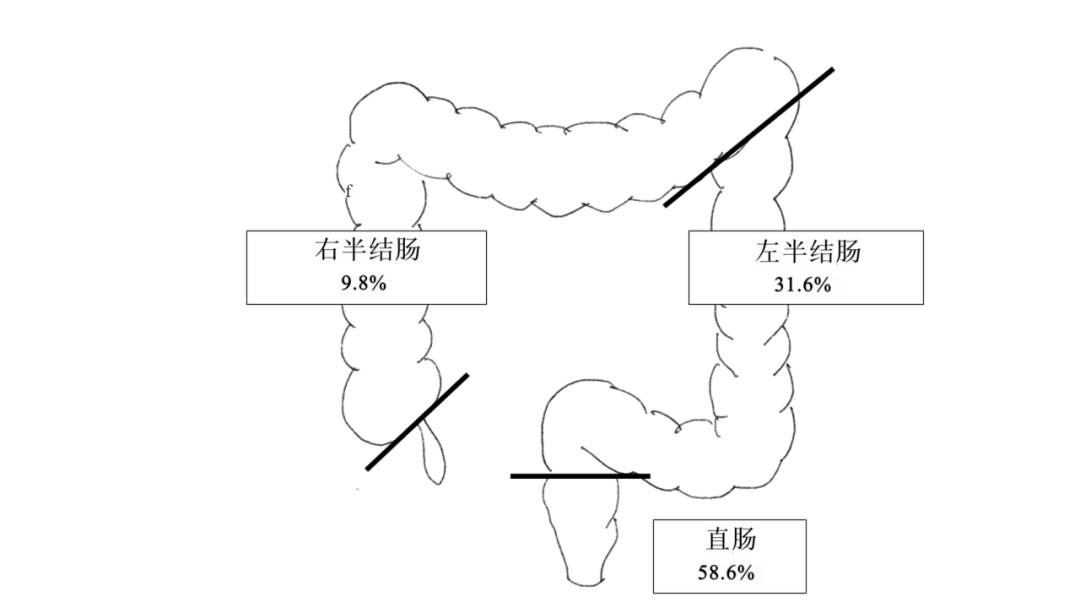
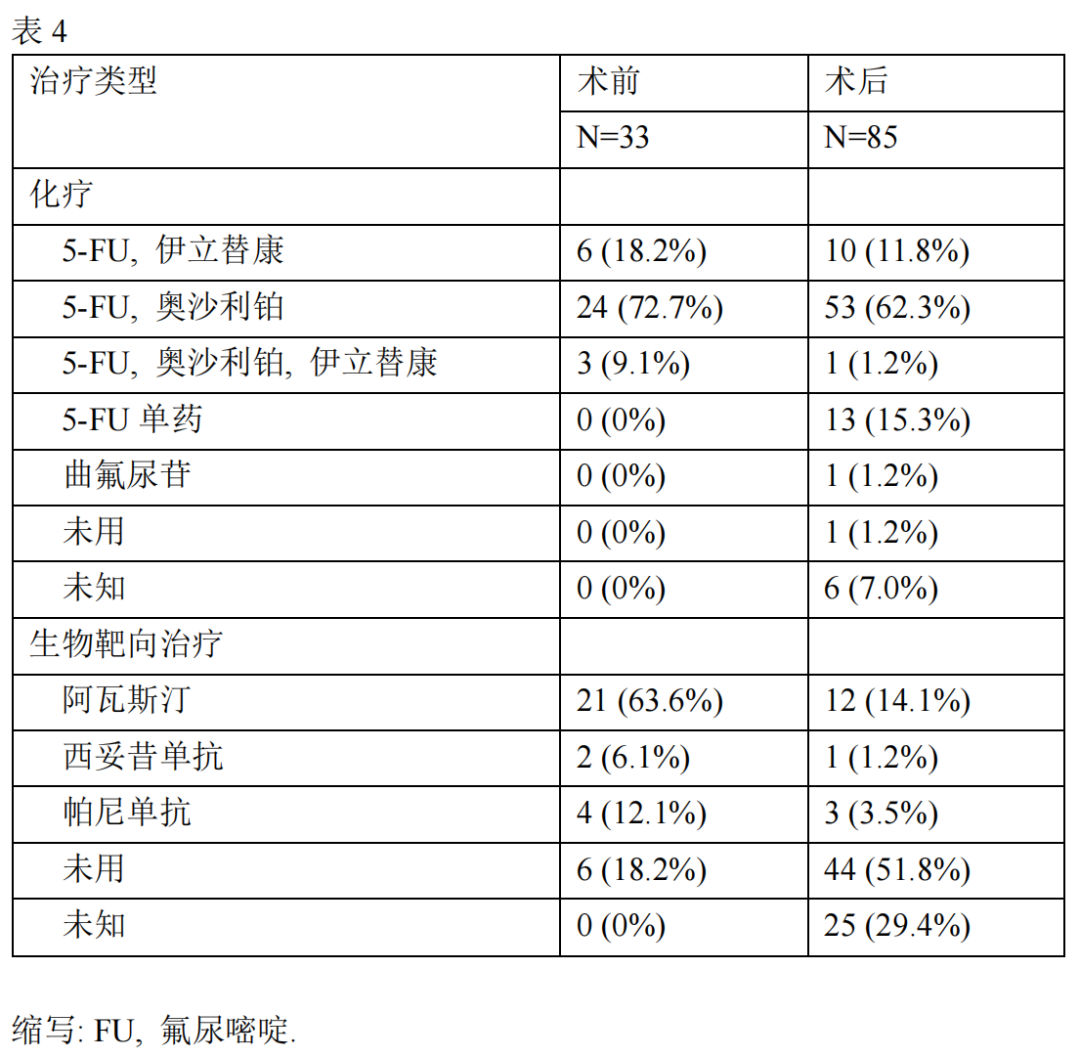
临床病理特征见表 1。原发肿瘤位于右半结肠者13例(9.8%),位于左半结肠者42例(31.6%),位于直肠78例(58.6%)(见图2)。发生同时性转移者102例(76.7%),发生异时性转移者31例(23.3%)。所有病人的PALNM手术和原发肿瘤手术均同时进行。其中,71例(53.4%)病人行解剖性淋巴结切除,62例(46.6%)病人行选择性淋巴结切除。术后并发症见表2,除1例病人出现盆腔脓肿外,其余病人并发症均发生在手术后。18例病人中有10例(55.6%)接受了术后化疗。
术前疑似 PALNM的中位数(最小,最大)为1(0 , 14)。术中9例病人发现疑似PALNM。肿大的PALN短径中位值为9(4 , 23)mm。73例病人行PET-CT检查,其中64例病人PALN上有FDG的代谢增加。解剖性淋巴结切险组获得的PALN数量中位数(最小值、最大值)显著高于选择性淋巴结切除组[10.0(1 , 48) vs. 1.5(1 , 7), P <0.001],并且PALNM的中位数(最小值,最大值)也高于选择性淋巴结切除组[2(1 , 44) vs. 1(1 , 6), P <0.001]。
PALN转移部位分布如表3所示:发生b2组转移者86例(64.6%),b1组转移者72例(54.1%),a组转移者5例(3.7%)。发现其他器官转移者36例,共44个器官发生转移,其中肝脏25例,腹膜8例,肺6例,远处淋巴结4例,卵巢1例。术前及术后化疗方案详见表4。
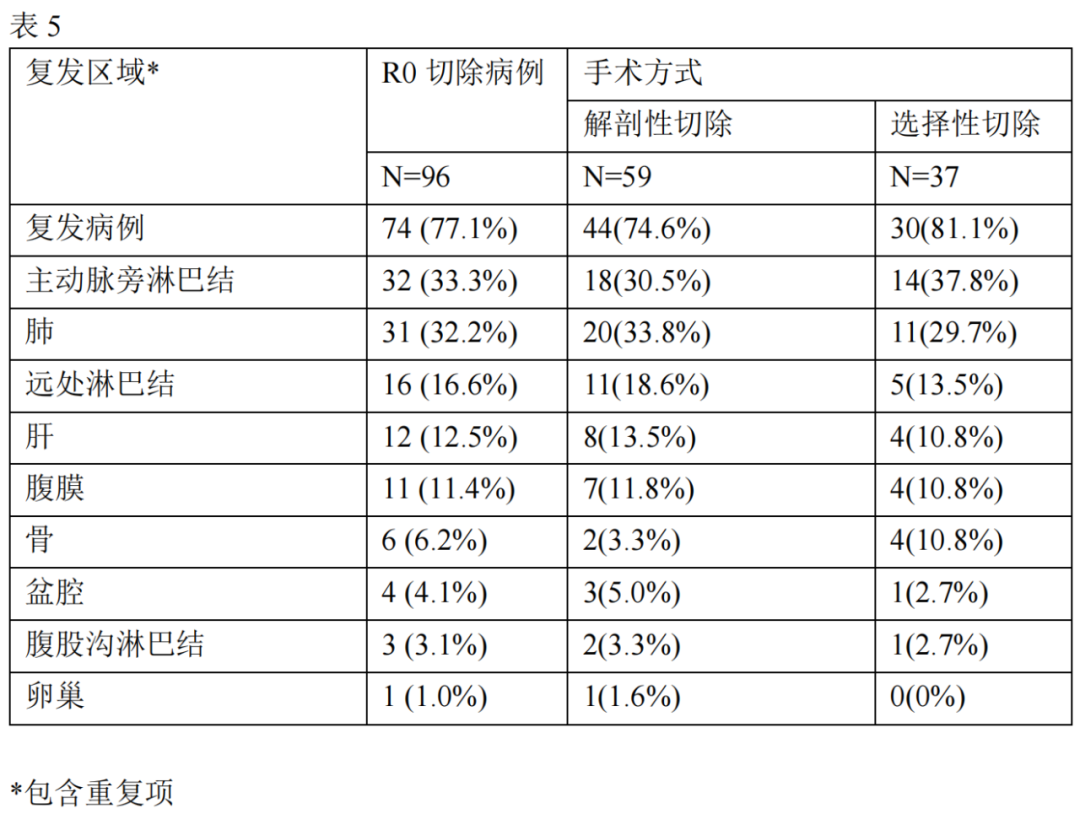
133例病人中,78例在观察期内死亡,且均出现肿瘤复发或进展。在其余55例病人中,26例出现肿瘤复发或进展。在96例行R0切除的病人中,74例肿瘤复发,3例病人死亡。在32例病人中PALN为最常见的复发部位(33.3%)。肺转移和其他远处淋巴结转移是其次常见的复发部位(表5)。
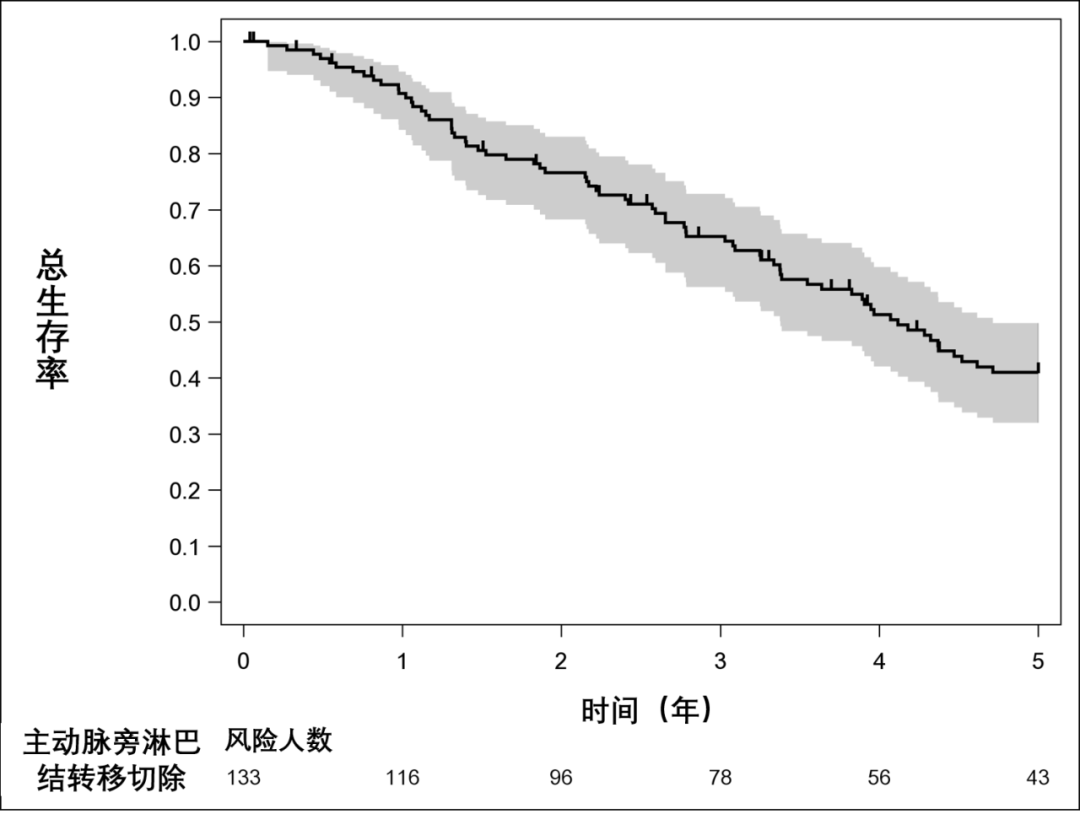
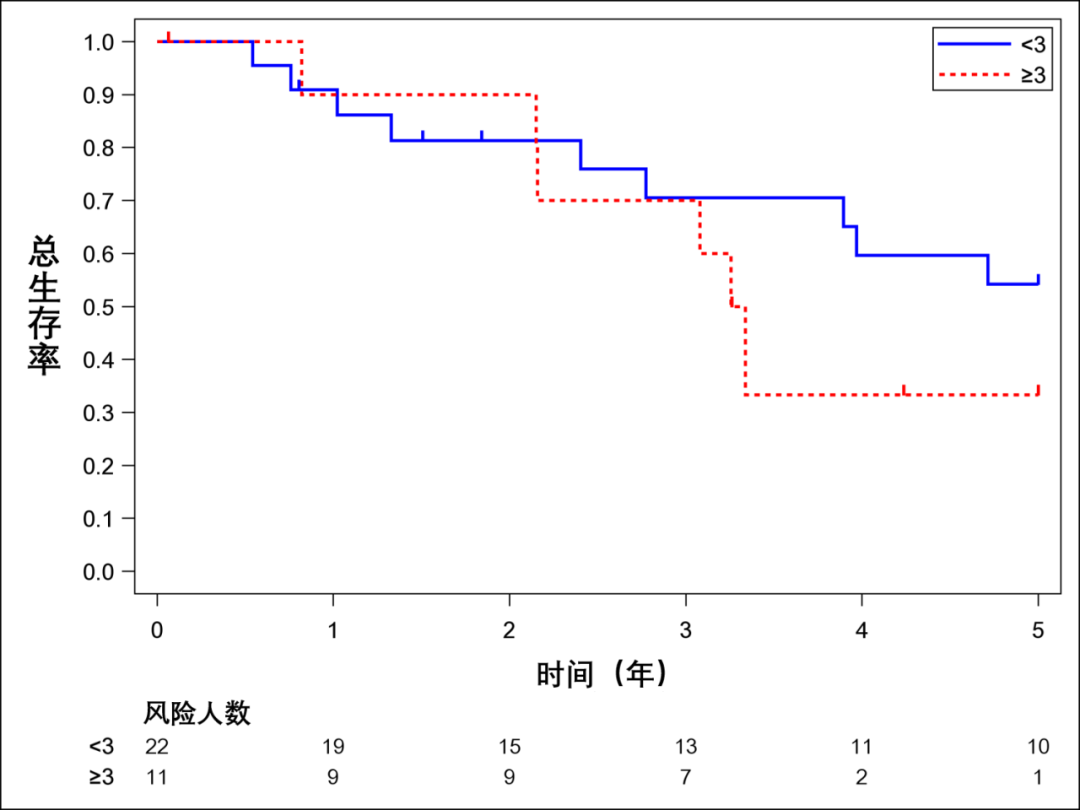
133例PALNM病人的5年OS率(95%CI)和中位OS率(95%CI)分别为41.0%(32.0 ~ 49.8)和4.1(3.4 ~ 4.7)年(图3A)。96例病人行R0切除后的5年RFS率(95%CI)和中位RFS(95%CI)分别为21.1%(13.5 ~ 29.7)和1.2(0.9 ~ 1.4)年(图3B)。行R0/1切除后分别为22.0%和1.2(0.9 ~ 1.5)年。在96例行R0切除后RFS病人的竞争风险分析中,5年累积复发发生率(95%CI)为75.8%(65.7 ~ 83.3)(图3C)。
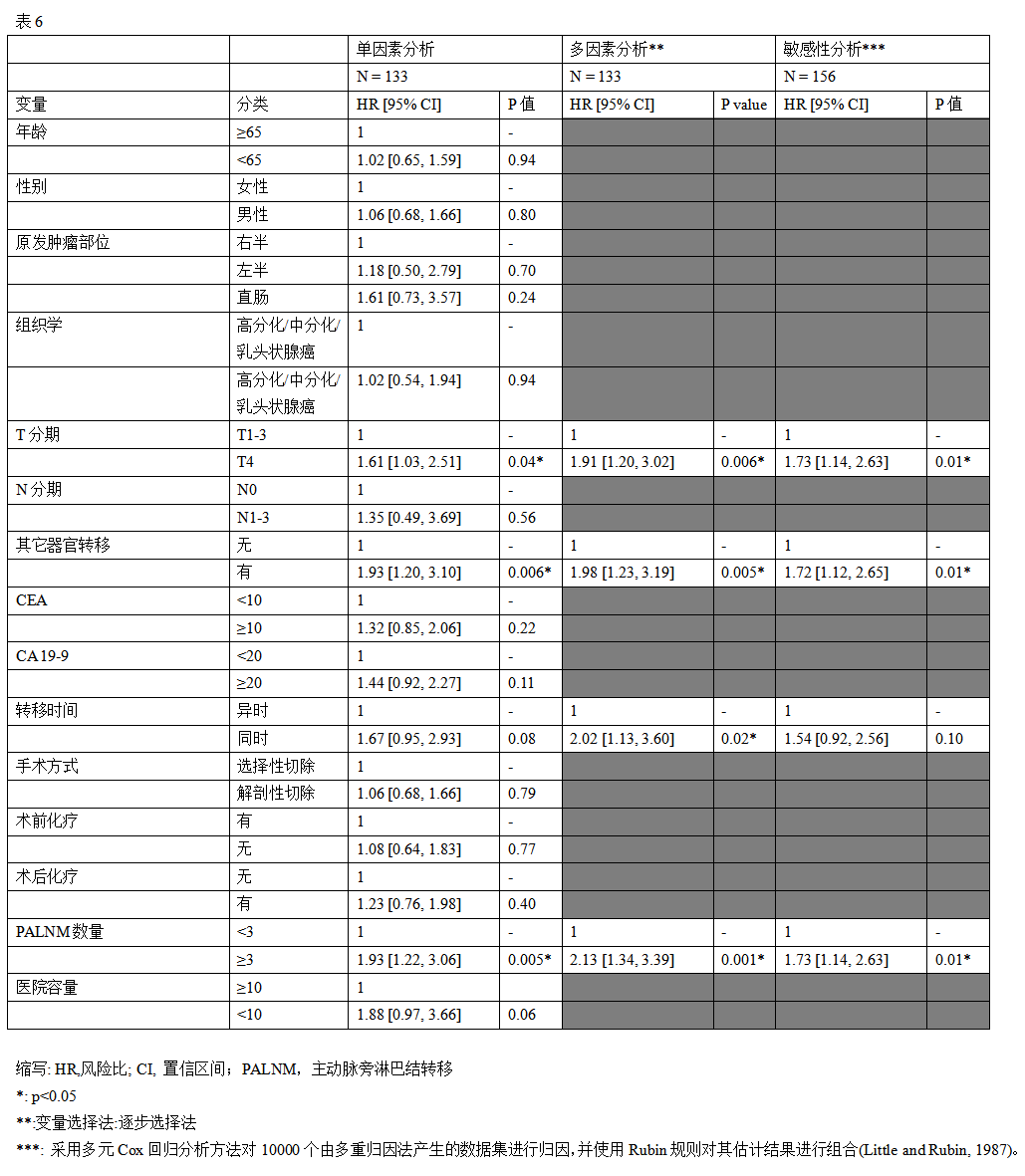
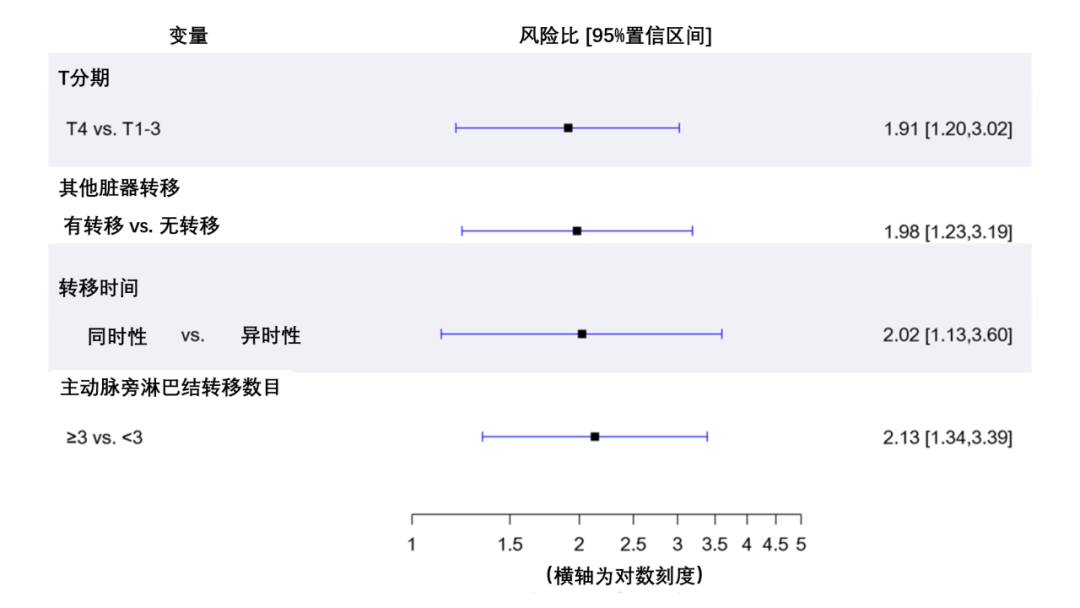
对于行 PALNM切除术后的OS,识别预后因素的Cox回归分析结果如表6所示。在多因素分析中,病理T分期(pT4 vs. pT1-3)(校正风险比[aHR]:1.91,95%CI:1.20 ~ 3.02, P =0.006),其他器官转移(存在 vs. 不存在)(aHR:1.98,95%CI : 1.23 ~ 3.19, P =0.005)、转移时间(同时 vs. 异时)(aHR:2.02,95%CI:1.13 ~ 3.60, P =0.02)和PALNM 数量(≥3 vs. <3)(aHR:2.13,95%CI:1.34 ~ 3.39, P <0.001)是OS的独立预后因素(图4A)。
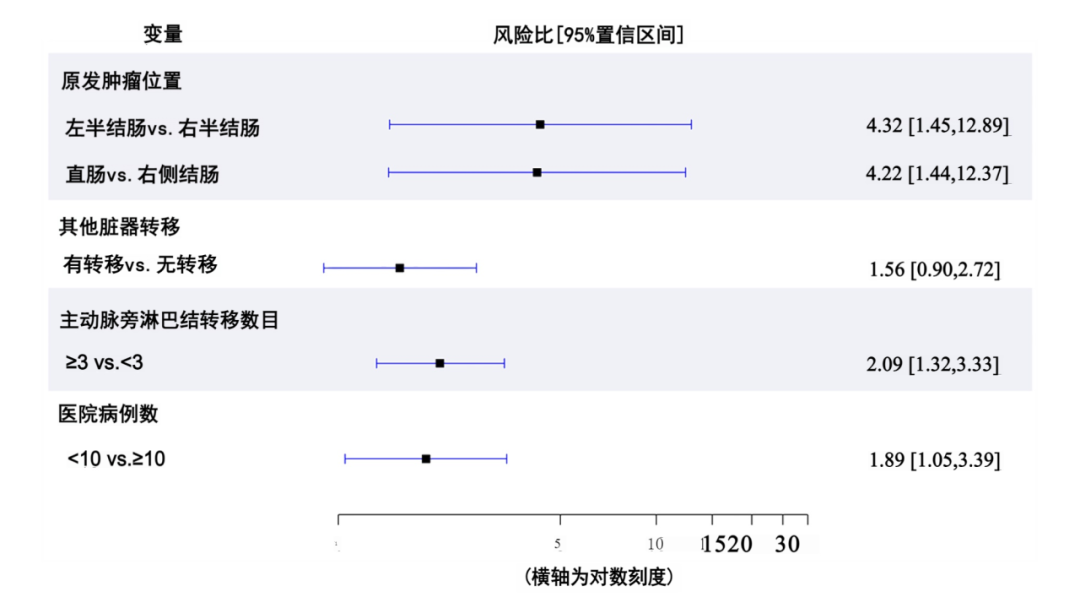
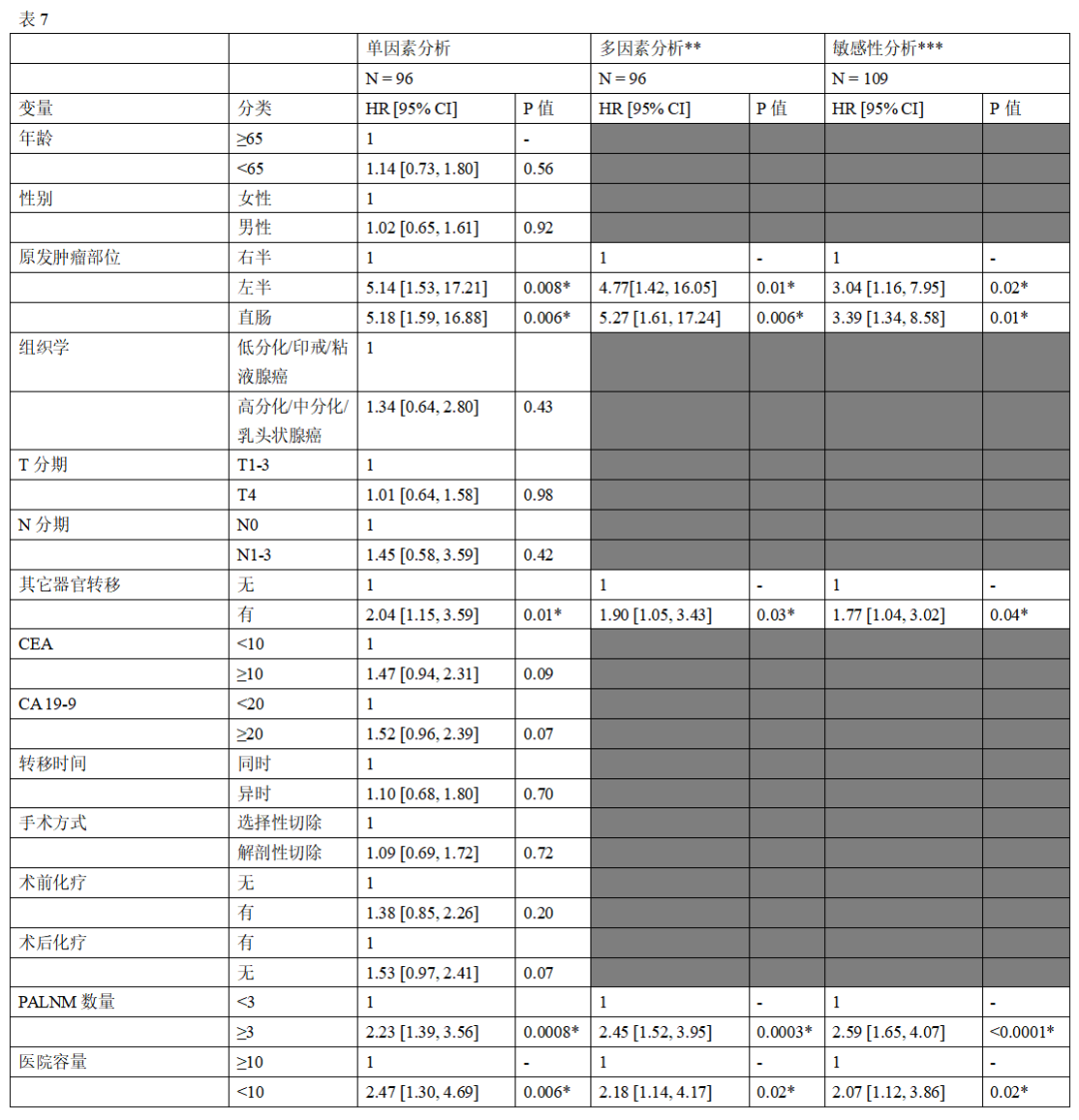
对于行 R0切除后的RFS,表7显示了Cox回归分析的结果,用来确定预后因素。多因素Cox回归分析显示,以下因素与病人RFS显著相关:原发肿瘤位置(左半结肠vs右半结肠,aHR:4.77,95%CI:1.41 ~ 16.05, P =0.01;直肠与右半结肠,aHR:5.27,95%CI:1.61 ~ 17.24, P =0.006),其他器官转移(存在 vs . 不存在)( aHR:1.90,95%CI:1.05 ~ 3.43, P =0.03) , PALNM数量(≥3 vs . <3)(aHR:2.20,95%CI:1.37 ~ 3.54, P =0.001),医院容积(<10 vs . ≥10)(aHR:2.18,95%CI:1.14 ~ 4.17, P =0.02)(图4B)。在RFS的竞争风 险分析中,除其他器官转移外,所有这些变量对复发率在统计学上也存在显著的影响(表8和图4C)。在评估排除23例数据缺失病人对评估变量影响的敏感性分析中,转移时间对OS不再有统计学意义的影响,在RFS的竞争风险分析中,医院容量对复发率没有存在统计学意义的影响,但所有其他因素对OS和RFS的影响均存在统计学意义(表6、7和8)。
这是在日本 36个研究中心中对133例病理学证实PALNM阳性的病人开展的第一项广泛、多中心的回顾性研究。先前报道的PALN切除术后的5年OS率19.5 %~ 54.0%,5年RFS率22.2 %~ 25.0%。本研究的结果与既往报道的结果相似。
PALNM的数量被确定为OS和RFS的预后因素。既往多项研究表明,PALNM的数目是主动脉旁淋巴结切除术后的预后因素。Sahara等人报道,在左侧结直肠癌中PALNM数量≥4是OS的不良预后因素;Yamada等人报道,发生同步转移的PALNM数量≥3是OS的不良预后因素。Bae等人报道,发生孤立性转移的PALNM数量≤7也与OS显著相关。
在淋巴结切除方式方面,清扫组的淋巴结检出数量和转移阳性淋巴结检出数量高于切除组。如果将 PALNM看作是一种局部疾病,手术方式的差异将会影响预后。Ichikawa等人报道了清扫术比切除术的RFS更好。然而,在本研究中两者RFS和OS没有差异。这表明PALNM可能是一种全身性疾病。
右侧肿瘤的 RFS优于左侧肿瘤,可能是由于选择偏倚。Lee等也报道了PALN切除术后右侧肿瘤的RFS较好,其中右侧结肠的比例为17.8%。其他关于PALN切除术与右半结肠癌相关性的报道很少。右半结肠癌在本研究中仅占10.0%,提示在手术适应证的选择上更为谨慎。
在本研究中,异时转移病人的 OS明显优于同时转移病人。Zhao等人报道了PALND对同时和异时PALNM同样有效。对于转移性结直肠癌,有报道称发生同时转移和发生异时转移病人的OS无差异,并且还有报道称异时转移的OS优于同步转移。关于转移时间对疾病的影响可能需要进一步的研究才能得出可靠的结论。
本研究中仅 25%的病人接受了术前化疗。虽然CRC的多模式治疗在欧洲和美国很常见,但在日本历来倾向于前期进行手术治疗。JSCCR指南中建议,原发性和转移性的IV期CRC,都是可进行手术切除的。对于可切除的复发性结直肠癌,由于其疗效和安全性尚不明确,术前化疗的适应证应慎重考虑。术前化疗的预期获益包括治疗微转移、确定药物反应、缩小肿瘤以确保手术切缘以及筛选手术病人。另一方面,也有人担心对化疗无应答者的肿瘤可能进一步发展变得不可切除,并有产生围手术期并发症的风险。有报道中接受术前化疗病人的亚组分析显示,根据PALNM的数量来看,RFS和OS无差异(≥3 vs . <3;RFS HR:1.21,95%CI:0.55 ~ 2.67,p=0.63;OS HR:1.85,95%CI:0.69 ~ 4.93, P =0.21;补充材料图1)。需要注意的是,本研究未纳入病理学转移阴性的病例,因此并未纳入术前化疗后肿瘤细胞转阴的病例。
本研究中相对较多的病人( 26.3%)未接受任何围手术期化疗。由于手术创伤大、术后并发症多,导致术后化疗依从性普遍较低;但在本研究中,术后并发症并未降低术后化疗率(55.6% vs. 62.9%)。可能需要更积极的术前化疗来改善病人远期结局。
医院容量是 RFS的预后因素,而不是OS的预后因素。PALNM切除的频数有限,完全切除需要医生的经验和技能。我们的研究结果表明,PALNM的外科治疗应在大容量中心进行。
本研究也存在部分局限性。由于本研究是回顾性的,因此不能排除潜在的选择偏倚。首先,本研究在单一组中进行,没有对照组。其次,各中心对于 PALNM的诊断标准和手术指征的决定存在差异。第三,在研究期间,许多机构只有个位数的PALNM切除病例,因此在研究队列中,手术方式和围手术期多学科医疗存在异质性。第四,本研究中PALN阳性可能包括术中局部LN与腹膜后LN无法区分而被判定为阳性。另外,我们没有收集术后放疗和基因状态的相关数据,如RAS、BRAF和微卫星不稳定性(MSI)。在纳入病人的治疗期间,MSI检测并不普遍。部分预后因素是病理学参数,不能用于决定手术指征。因此,需要前瞻性的比较研究来进一步明确PALNM切除的意义、最佳切除范围和适应证。
结论
PALNM切除术后通过病理学证实小于3个PALNM是病人OS和RFS的有利预后因素。然而,PALNM目前被认为是一种全身性疾病,切除的意义可能有限。
滑动阅读参考文献
链接:http://www.lewenyixue.com/2024/11/20/%E3%80%90DCR%E4%B8%93%E5%8C%BA%20%7C%20%E6%AF%8F%E6%9C%88%E7%B2%BE%E9%80%89%E6%96%87%E7%AB%A0%E3%80%91%E7%BB%93%E7%9B%B4%E8%82%A0%E7%99%8C/

















赶快来坐沙发