Small丨华中科技大学陈瑞等团队合作研究制备白藜芦醇仿生纳米药调节肿瘤干细胞活性以抑制结直肠癌转移
结直肠癌(CRC)是全球第三大最常见的恶性肿瘤。大约21%-26%的患者发展为转移性疾病,这也是死亡的主要原因,接受完全手术切除的早期CRC患者的5年生存率为30%至57%。然而,转移性CRC(mCRC)患者的5年生存率为<5%。肿瘤干性是转移的主要驱动因素。因此,开发有效抑制肿瘤干性的CRC疗法至关重要。 然而,目前的生物治疗药物存在组织相容性低、特异性不足等问题,迫切需要制定新型干预措施,精确靶向和抑制肿瘤干性,并克服现有疗法的固有局限性。
在mCRC研究中,深入了解肿瘤干性的调控机制至关重要。 该调控涉及细胞内分子机制和外部信号通路的协同作用,包括Wnt/β-catenin、Notch和Hedgehog途径,以及相关的表观遗传修饰,转录因子的激活或抑制,和细胞周期调节。 这些机制在维持肿瘤干性方面起着至关重要的作用,并可能导致异常激活,驱动肿瘤生长和扩散,并直接影响肿瘤细胞的存活和增殖。 肿瘤干性的表型异质性是一个独特的特征,表现为肿瘤内存在多个亚群,每个亚群具有不同的功能和特征。 不同的亚组可能表现出不同的反应,这种异质性使肿瘤的治疗反应极为复杂化。 治疗干预对肿瘤干性的影响是mCRC研究的另一方面。 不同的治疗策略可能对肿瘤干性产生不同程度的影响,包括抑制增殖和降低耐药性。化疗、靶向治疗和免疫治疗等方法可以通过破坏肿瘤干性的分子机制来达到治疗效果。 当前研究关注针对副作用、耐药性、药物靶向特异性差和肿瘤组织特异性等问题的新型抗肿瘤干性疗法。
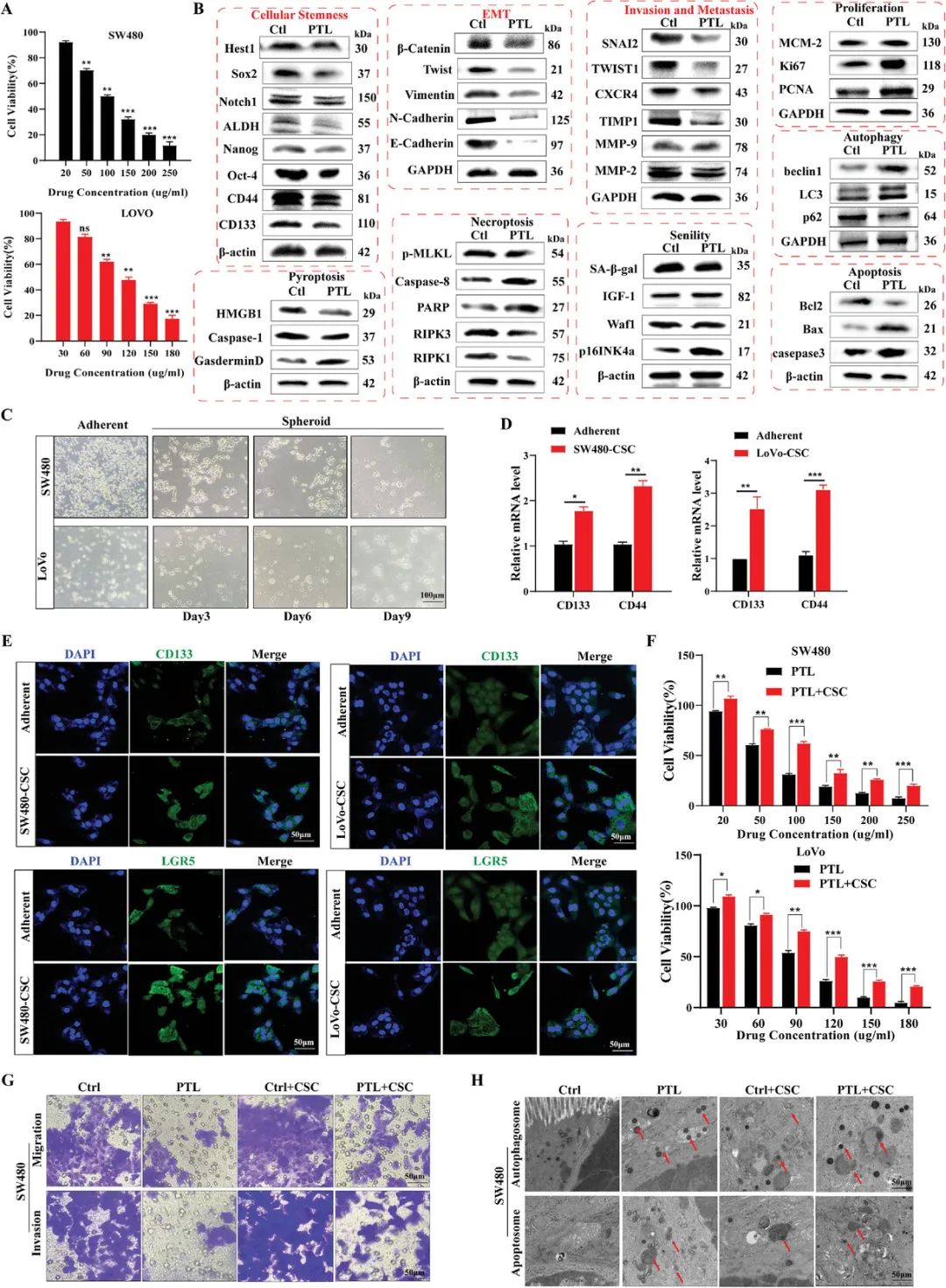
图1 干性抑制是PTL抑制CRC的主要机制(摘自 Small )
从中药中提取的单体化合物白皮杉醇(PTL)引起了广泛关注,尤其是在CRC和抑制肿瘤干性方面。 PTL是一种广泛使用的抗癌剂,可治疗胃癌、胰腺癌、非小细胞肺癌和直肠癌等各种恶性肿瘤,作用机制包括增强微管稳定性、诱导细胞周期停滞、启动细胞凋亡、增强免疫反应、抑制血管生成和破坏细胞间信号通路等。 PTL是一种天然产物,具有显著的抗癌潜力,尤其是在抑制肿瘤干性方面,但仍存在一定问题。 首先,需要更深入地了解PTL抑制CRC和调节肿瘤干性的分子机制,因此需要进行详细的分子水平研究以阐明其确切途径。其次,尽管表现出相对较好的生物活性,但与PTL生物利用度和药代动力学相关的问题需要进一步探索。最后,对PTL体内分布和代谢过程的理解仍然有限,需深入研究以推动抗癌药物的开发。 为应对上述挑战,作者期望全面探索PTL分子水平机制,同时解决其生物利用度和药代动力学问题。对PTL体内代谢和分布的透彻了解将为其在抗癌方面的应用奠定坚实基础。
该研究制备了一种新型pH响应性仿生纳米递送系统,以提高单体药物PTL的局部递送功效。 CMD-BHQ3-PTL/DOX@RBCM利用羧甲基葡聚糖(CMD)和淬灭基团Black Hole Quencher 3(BHQ3)包埋阿霉素(DOX)和PTL,随后用红细胞膜(RBCM)包裹以提高生物相容性。作者通过免疫印迹证明了PTL对肿瘤干细胞的干预作用,以克服在CRC的高需氧量和低pH值环境中存在的不足。 通过纳米材料表征、分子生物学实验、质粒构建和高通量测序,在细胞水平上研究了仿生纳米给药系统关于肿瘤干细胞相关转移的分子机制。 随后,构建人源和鼠源的皮下肿瘤和转移模型,将研究扩展到更复杂的组织水平,更深入地阐明仿生纳米给药系统的分子机制。
参考消息:
https://onlinelibrary.wiley.com/doi/10.1002/smll.202407191
— END—
链接:http://www.lewenyixue.com/2024/11/19/Small%E4%B8%A8%E5%8D%8E%E4%B8%AD%E7%A7%91%E6%8A%80%E5%A4%A7%E5%AD%A6%E9%99%88%E7%91%9E%E7%AD%89%E5%9B%A2%E9%98%9F%E5%90%88%E4%BD%9C%E7%A0%94/






 时事|政策速递|山东省医疗机构院外调配处方管理规定(试行)
时事|政策速递|山东省医疗机构院外调配处方管理规定(试行)
赶快来坐沙发