J Clin Invest丨任国胜/李洪忠/万敬员团队揭示IGF2在成纤维细胞介导的肿瘤免疫逃逸及免疫治疗耐药中的关键作用
CD8 + T细胞杀伤肿瘤细胞,对于抗肿瘤免疫至关重要,但其常无法有效浸润到癌组织中,这是导致肿瘤免疫逃逸及免疫治疗耐药的重要原因,而详细机制不明。此外,肿瘤相关成纤维细胞 (Cancer-associated fibroblasts, CAFs) 是肿瘤微环境 (Tumor microenvironment, TME) 的重要组成成分,在肿瘤免疫逃逸和免疫治疗耐药中常扮演关键角色,但具体机制仍不清晰。
近日,来自重庆医科大学附属第一医院的 任国胜/李洪忠/万敬员 团队在The Journal of Clinical Investigation 上在线发表题为 Insulin-like growth factor 2 drives fibroblast-mediated tumor immunoevasion and confers resistance to immunotherapy 的文章,结合转录组测序、单细胞RNA测序 (scRNA-seq) 以及空间转录组测序 (stRNA-seq) 技术, 发现CAFs来源的胰岛素样生长因子2(Insulin-like growth factor 2,IGF2)通过调控CAFs促癌功能构建物理和化学屏障,抑制CD8 +T细胞浸润及抗肿瘤活性,促进肿瘤免疫逃逸与免疫治疗耐药,为肿瘤治疗提供了潜在的分子标志物和治疗靶点。
研究团队首先对临床三阴性乳腺癌与结肠癌组织进行转录组测序分析,发现免疫排除型肿瘤组织中高表达IGF2基因。结合单细胞测序分析、流式细胞术、Western blot及免疫荧光等技术证实IGF2主要表达于CAFs。为研究IGF2在成纤维细胞上的功能,研究团队利用IGF2全敲基因鼠 (IGF2 -/- ) 及成纤维细胞IGF2条件性敲除基因鼠 (IGF2 cKO) ,并结合流式细胞术、质谱流式技术 (CyTOF) 及单细胞测序分析,在多种小鼠肿瘤模型中证实IGF2敲除能够显著促进TME中CD8 + T细胞浸润,并增强其肿瘤杀伤功能,从而抑制肿瘤生长。
随后,结合转录组测序分析及相关分子生物学技术,研究团队发现IGF2敲除能够显著减少TME中胶原形成、降低CAFs中CXCL12及PD-L1的表达水平。单细胞及空间转录组测序分析也显示,CAFs与CD8 + T细胞之间存在显著的CXCL及PD-L1信号交互,而IGF2缺失可明显抑制这种信号联系。进一步机制研究表明,CAFs自分泌的IGF2通过与其自身IGF1R受体结合,激活PI3K/AKT信号通路,促进CAFs增殖、释放细胞因子CXCL12及表达免疫拮抗点分子PD-L1。CAFs增殖及CXCL12的释放将显著阻滞TME中CD8 + T细胞的浸润,而PD-L1的高表达则会明显抑制CD8 + T细胞的抗肿瘤活性。此外,研究团队在小鼠肿瘤模型中评估了IGF2敲除及IGF2/IGF1R抑制剂Linsitinib联合免疫拮抗点阻断疗法 (immune checkpoint blockade,ICB) 在肿瘤治疗中的作用,发现IGF2信号阻断可显著增强ICB疗效,抑制肿瘤生长,延长荷瘤小鼠生存时间。更值得一提的是,在接受ICB治疗的临床肿瘤患者中,与治疗有反应者相比,治疗无反应者具有更高的血浆IGF2水平,提示血浆IGF2水平可作为肿瘤患者免疫治疗疗效判断的有效标志物。
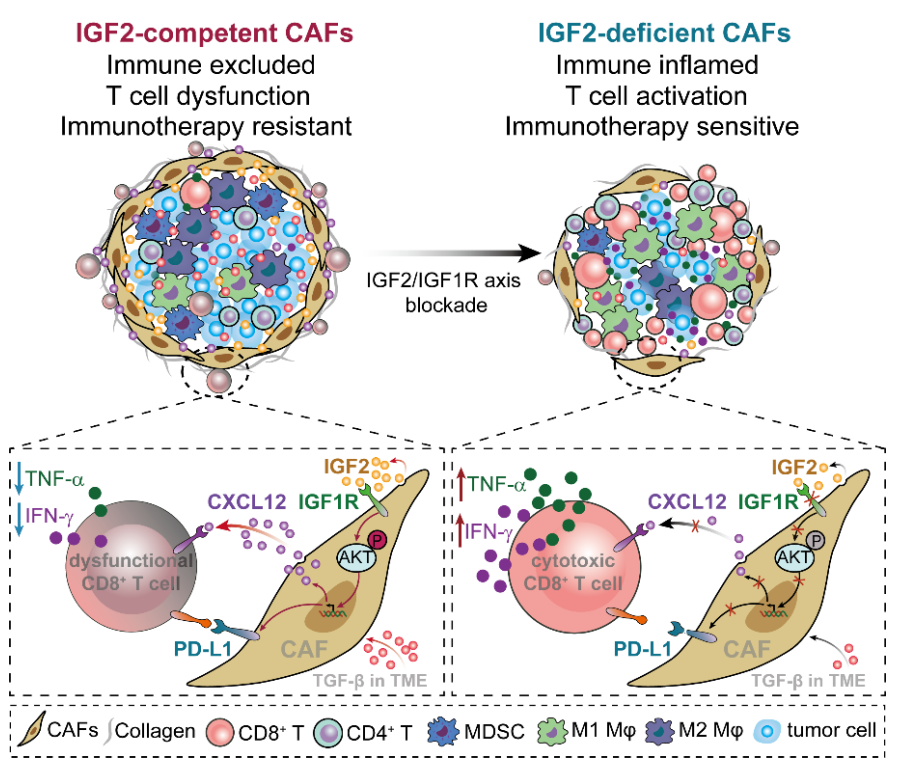
总而言之,该研究首次揭示了IGF2作为关键上游因子调控CAFs功能介导肿瘤免疫逃逸的分子机制。此外,研究还表明IGF2有作为液体活检生物标志物的潜力,可用于评估临床免疫治疗疗效。
重庆医科大学附属第一医院博士后宋大强、伍煜燊、刘家洲及李杰博士为论文共同第一作者。重庆医科大学附属第一医院任国胜教授、李洪忠研究员及重庆医科大学药学院万敬员教授为本文共同通讯作者。
原文链接:https://www.jci.org/articles/view/183366
制版人:十一
版权声明:本文为“乐问号”作者或机构在乐问医学上传并发布,仅代表该作者或机构观点,不代表乐问医学的观点或立场,不能作为个体诊疗依据,如有不适,请结合自身情况寻求医生的针对性治疗。
链接:http://www.lewenyixue.com/2024/11/19/J%20Clin%20Invest%E4%B8%A8%E4%BB%BB%E5%9B%BD%E8%83%9C-%E6%9D%8E%E6%B4%AA/
THE END



