在肿瘤治疗中,对细胞周期 G1检查点的抑制效率是影响疗效的关键因素之一,尤其是在激素受体阳性 (HR+) 乳腺癌的治疗中,细胞周期CDK4/6激酶特异性抑制剂 (CDK4/6i) 已成为最有效的治疗策略之一 【1】 。CDK4/6i会通过阻断细胞周期进程,阻止细胞从G1期向S期转变,使肿瘤细胞停滞在G1期 【2】 。然而,尽管这类药物能够有效延缓细胞增殖,但 不同细胞在G1期停滞后会经历多种细胞命运,包括细胞凋亡、衰老或重新进入细胞周期等 【3】 。
CDK4/6i使用后,肿瘤细胞若重新进入细胞周期会限制药物的长期疗效,原因在于当细胞再次进入细胞周期时,肿瘤细胞会重新激活其增殖能力,这不仅会恢复肿瘤的生长,还可能导致进一步的基因突变,增加肿瘤的异质性,从而增强耐药性 【2】 。因此, CDK4/6i治疗后,肿瘤细胞未发生死亡,反而重新进入细胞周期是许多患者对CDK4/6i产生耐药并导致肿瘤复发的重要原因 。相比之下,诱导一种不可逆的细胞状态,如细胞衰老或程序性死亡,使细胞无法重新进入细胞周期,则可以有效减少肿瘤细胞数量,降低复发风险,从而实现更持久的疾病控制。
临床上,CDK4/6i已广泛用于HR+乳腺癌的标准治疗,并在延长无复发生存期 (PFS) 和总体生存率 (OS) 方面取得了显著成效。然而,患者对CDK4/6i的反应时间存在显著差异:一些患者的疾病控制时间仅为数月,而另一些患者则可持续超过5年 【4】 ;该差异引发了对CDK4/6i长期疗效的关注。尽管这些药物能够通过抑制细胞周期调控蛋白 (如Cyclin D1和Rb) 的活性有效阻止G1期的进程,但随着治疗的持续,细胞增殖活性标志物Ki67水平开始反弹,提示某些肿瘤细胞可能逐渐逃逸药物的G1期停滞并重新进入细胞周期 【5】 。这种现象被认为是部分患者对CDK4/6i产生耐药并最终导致复发的关键原因。因此,探明与CDK4/6i治疗相关的细胞周期阻滞的逃逸机制及长期疾病控制 (long-term disease control) 的实现策略,是肿瘤治疗中面临的重要挑战。
近期,纪念斯隆凯特琳癌症中心 Sarat Chandarlapaty 实验室领衔在 Cancer Cell 杂志发表了题为 Long-term breast cancer response to CDK4/6 inhibition defined by TP53-mediated geroconversion 的研究文章, 通过探究与CDK4/6i治疗相关的细胞周期阻滞逃逸机制以及肿瘤长期控制过程中的基因组特征和信号通路,作者揭示了HR+乳腺癌患者中,TP53缺失和MDM2扩增是HR+乳腺癌长期控制失效的重要原因。TP53缺失会通过作用于CDK2促进p130磷酸化,导致肿瘤细胞重新进入细胞周期,从而推动肿瘤进展。通过联合CDK2抑制剂可以克服这种机制,诱导肿瘤细胞进入衰老状态。因此,联合抑制CDK4/6和CDK2是治疗TP53突变型HR+乳腺癌及抑制药物耐受性的潜在策略 。
为了确定影响乳腺癌患者临床治疗后的基因组模式,作者对467名接受了CDK4/6抑制剂联合内分泌治疗的转移性激素受体阳性 (HR+) 且人类表皮生长因子受体2阴性 (HER2-) 乳腺癌患者进行了基因组分析。结果表明, TP53功能丧失和MDM2扩增与较差的长期治疗反应密切相关 。这些基因变异在多个独立的患者队列中得到了验证,进一步说明 TP53功能丧失显著缩短了无进展生存期(PFS),并且预示着更差的预后 。
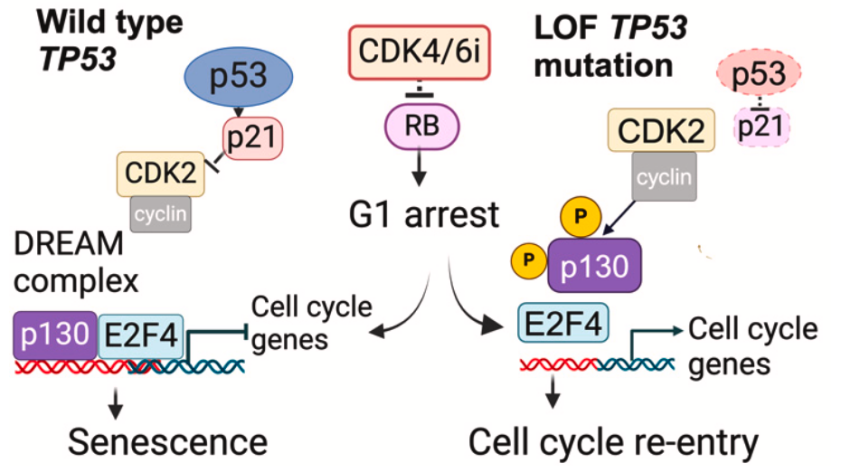
尽管CDK4/6i能够在短期内有效抑制细胞周期进程并阻止肿瘤生长,但 p53失活会通过阻断DREAM复合体的组装,使肿瘤细胞逃逸G1期阻滞,进而在长期治疗后重新进入细胞周期并恢复增殖 。不仅如此,p53缺失或MDM2过度表达的细胞系及异种移植肿瘤在长期CDK4/6i治疗中表现出明显的耐药性,而具有正常p53功能的细胞则保持对CDK4/6i的敏感性。
作者进一步探究了p53缺失和MDM2过表达在CDK4/6抑制剂治疗后导致耐药性的机制。结果表明, p53功能缺失或MDM2过表达的细胞无法有效启动衰老程序 ,导致肿瘤细胞重新进入细胞周期并恢复增殖。这一过程与衰老标志物的缺失及基因表达的变化密切相关,表明p53在长期抑制肿瘤增殖中的重要作用。
为了鉴定因p53缺失而影响乳腺癌细胞对CDK4/6i响应的分子通路,作者分析了母本细胞与p53敲除 (p53KO) 细胞在不同时间点的RNA测序数据。结果显示,p53缺失通过影响DREAM复合物的功能,使细胞逃脱G1期阻滞并重新进入细胞周期。通过恢复p21的表达,部分可以逆转p53缺失的效应,但如果p130也缺失,细胞仍会逃脱生长抑制。这表明 DREAM复合物在CDK4/6i长期疗效中发挥了关键作用,尤其是在p53功能丧失的细胞中 。
在p53野生型细胞中,CDK4/6i能够部分将p21从CDK4重新分配到CDK2,有效抑制CDK2的功能,同时CDK2还会磷酸化p130。基于此,作者假设联合CDK2和CDK4/6抑制剂可以有效阻止p53缺失细胞中的p130磷酸化。研究结果表明, CDK2抑制剂与 CDK4/6i联合使用能够在p53KO细胞中抑制p130磷酸化,阻止细胞周期的重新进入,并显著诱导衰老标志物的表达 。另一方面,联合使用CDK2抑制剂能够克服由于p53缺失引起的耐药性,诱导细胞进入衰老状态,从而实现对肿瘤的长期抑制。因此, 联合抑制CDK4/6和CDK2是治疗TP53突变型HR+乳腺癌及抑制药物耐受性的潜在策略 。
为了评估这些发现在人类乳腺癌样本中的适用性,研究人员进一步分析了TP53状态对FELINE 2期临床试验中接受新辅助CDK4/6i治疗患者的影响。结果表明, p53功能丧失的患者难以在CDK4/6i治疗后实现持久的细胞周期停滞,而TP53野生型患者则能够保持较低的细胞增殖活性 。这进一步说明了p53丧失可能限制了CDK4/6i的治疗效果。
综上所述,本研究揭示了 在激素受体阳性(HR+)乳腺癌患者中,TP53缺失和MDM2扩增与较差的长期疾病控制密切相关 。 虽然p53缺失不会直接影响CDK4/6i的活性或G1期停滞,但会通过CDK2介导p130磷酸化,促使肿瘤细胞重新进入细胞周期并加速肿瘤进展。通过联合使用CDK2抑制剂诱导细胞衰老,能够有效克服这一障碍。因此,联合抑制CDK4/6和CDK2可能是保证乳腺癌长期治疗效果的关键。
https://doi.org/10.1016/j.ccell.2024.09.009
制版人:十一
1. Watt, A.C., et al. Cellular mechanisms underlying response and resistance to CDK4/6 inhibitors in the treatment of hormone receptor-positive breast cancer. Breast Cancer Res. 2022; 24:17.
2. Klein, M.E., et al. CDK4/6 Inhibitors: The Mechanism of Action May Not Be as Simple as Once Thought. Cancer Cell. 2018; 34:9-20.
3. Otto, T, et al. Cell cycle proteins as promising targets in cancer therapy. Nat. Rev. Cancer. 2017; 17:93-115.
4. Finn, R.S., et al. Palbociclib and Letrozole in Advanced Breast Cancer. N. Engl. J. Med. 2016; 375:1925-1936.
5. Griffiths, J.I., et al. Serial single-cell genomics reveals convergent subclonal evolution of resistance as early-stage breast cancer patients progress on endocrine plus CDK4/6 therapy. Nat. Cancer. 2021; 2:658-671.
版权声明:本文为“乐问号”作者或机构在乐问医学上传并发布,仅代表该作者或机构观点,不代表乐问医学的观点或立场,不能作为个体诊疗依据,如有不适,请结合自身情况寻求医生的针对性治疗。
链接:http://www.lewenyixue.com/2024/11/19/Cancer%20Cell%E4%B8%A8TP53%20%E7%BC%BA%E5%A4%B1%E4%BB%8B/






赶快来坐沙发