Cancer Cell:铁死亡在癌症中的作用
在癌症治疗中,通过传统治疗方法诱导细胞凋亡的挑战反复发生,往往因耐药性而受挫,这强调了探索其他细胞死亡途径的迫切需要。铁死亡是一种铁依赖形式的调节性细胞死亡,由细胞膜上脂质过氧化物的致死性积累引发。现已成为肿瘤学中一个有前景的前沿领域。诱导铁死亡不仅能抑制肿瘤生长,还能增强免疫治疗应答,克服现有癌症疗法的抗药性。今天和大家一起学习一篇重量级的综述, 3月 发表在 Cancer Cell (IF=50.3) 上,这篇综述探讨了铁死亡在肿瘤抑制中的作用,并深入探讨了铁死亡在肿瘤微环境中的复杂作用及其与抗肿瘤免疫的相互作用,为靶向铁死亡作为癌症治疗策略的前景提供启示。
The roles of ferroptosis in cancer: Tumor suppression, tumor microenvironment, and therapeutic interventions
铁突变在癌症中的作用:肿瘤抑制、肿瘤微环境和治疗干预
一、引言
鉴于癌症作为主要致死原因对全球的持续影响,在肿瘤学领域寻求新的治疗策略仍然势在必行。虽然传统方法能诱导常规细胞死亡,特别是细胞凋亡,但大量恶性肿瘤对诱导细胞凋亡的治疗方法表现出耐药性,因此有必要探索诱导细胞死亡的替代模式。铁死亡的调控取决于产生脂质过氧化物的促铁死亡细胞活动和解毒这些过氧化物的铁死亡反应防御系统之间的微妙平衡。当促铁死亡活动压倒铁死亡防御机制时,细胞膜上脂质过氧化物的过度积累会破坏膜的完整性,最终导致铁死亡(图 1)。
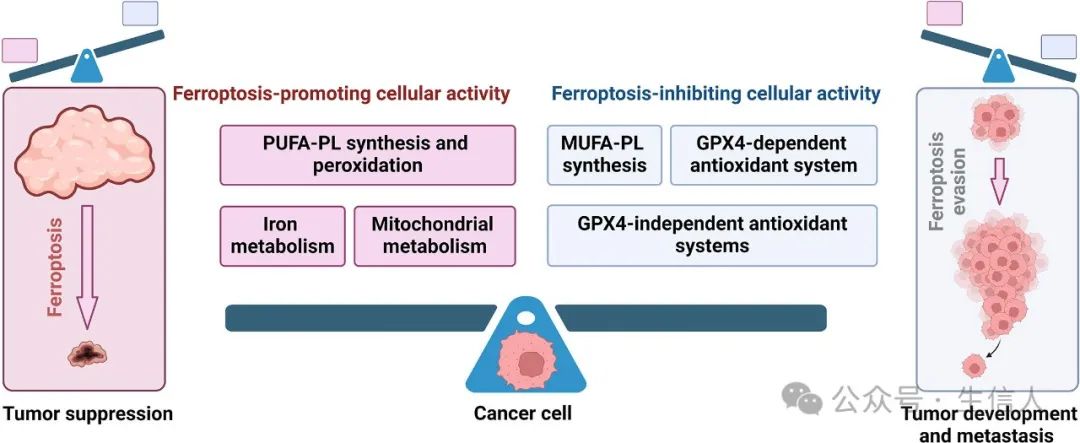
图1 影响肿瘤结局的促铁死亡活动和铁死亡防御活动之间的动态变化
从机理上讲,细胞程序性死亡途径涉及独特的细胞级联信号,并由孔形成蛋白和/或细胞死亡执行蛋白的激活触发。相反,铁死亡是由细胞代谢失衡导致的含有多不饱和脂肪酸(PUFA-PLs)的氧化磷脂的致命积累引发的,没有这两类蛋白的明确参与, 因此,以诱导铁死亡为目标的肿瘤疗法有可能克服传统疗法的耐药性。
这篇综述中深入探讨了铁死亡在肿瘤抑制中的作用,并探讨了它在肿瘤微环境(TME)中的复杂参与,特别强调了它对抗肿瘤免疫的影响。此外,还深入探讨了在癌症治疗中针对铁死亡的策略及其治疗意义。最后,强调了未来研究工作中值得关注的几个关键挑战。
二、铁死亡在肿瘤抑制中的作用
越来越多的证据支持,铁死亡是一种天然的抗肿瘤机制,通过与各种肿瘤抑制基因的相互作用发挥抑制肿瘤的作用,如P53等(图 2)。耐人寻味的是,特定癌基因的突变似乎赋予了癌细胞逃避铁死亡的独特优势,如RAS家族、PI3K通路、FLT3等。此外,癌症的淋巴转移过程和肿瘤干细胞(CSCs)驱动的肿瘤进展与铁死亡抑制密切相关。此外,铁死亡在抗肿瘤免疫中发挥着关键而复杂的作用。文章综述了大量各个机制相关的基因或通路,有兴趣的同学可以详细阅读一下。
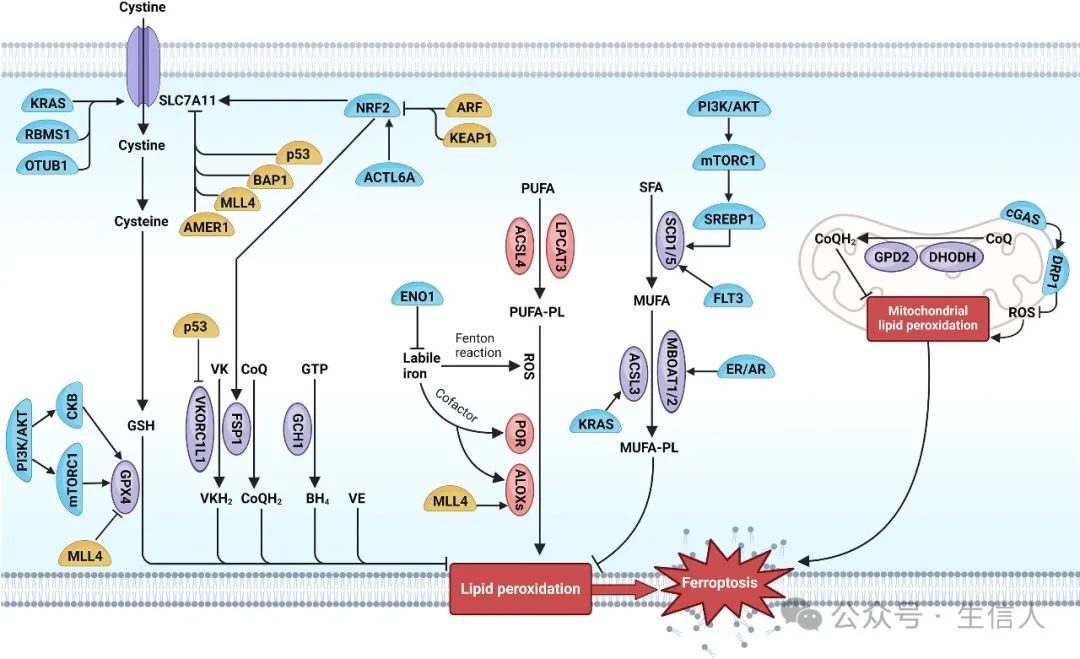 图 2 铁死亡调控网络中的抑癌基因和癌基因
图 2 铁死亡调控网络中的抑癌基因和癌基因
三、铁死亡在肿瘤微环境中的作用
一方面,癌细胞中的铁死亡可能会激发或调节 TME 中的免疫反应;另一方面,TME 中的免疫细胞对铁死亡的敏感性差异很大,不同类型的免疫细胞可以增强或抑制癌细胞的铁凋亡。
3.1铁死亡癌细胞的免疫原性
铁死亡癌细胞,尤其是接受铁死亡诱导剂(FIN)治疗后的早期细胞会释放多种免疫刺激信号,这些信号有助于树突状细胞的成熟,并提高巨噬细胞吞噬嗜铁死亡癌细胞的效率。这些相互作用不仅推动巨噬细胞向 M1型极化,还促进 T 细胞在肿瘤内的浸润和活性,甚至能引发类似疫苗的反应,激活抗肿瘤免疫。相反,抑制铁死亡会导致 TME 中 T 细胞浸润和活性降低,最终抑制 T 细胞介导的抗肿瘤反应。然而,一些研究表明铁死亡细胞可能会阻碍树突状细胞的成熟,从而影响树突状细胞交叉呈递抗原的能力,这可能会对适应性免疫反应产生负面影响。研究表明,在铁死亡的早期阶段,癌细胞可触发树突状细胞成熟;但在铁凋亡的晚期阶段,促成熟的能力减弱,尽管这些晚期铁死亡细胞仍可被树突状细胞有效吞噬。总体而言,铁死亡癌细胞对免疫原性的影响似乎取决于具体情况,因此成为铁死亡研究中一个颇具争议的课题。
3.2 TME成分在铁死亡调节中的作用
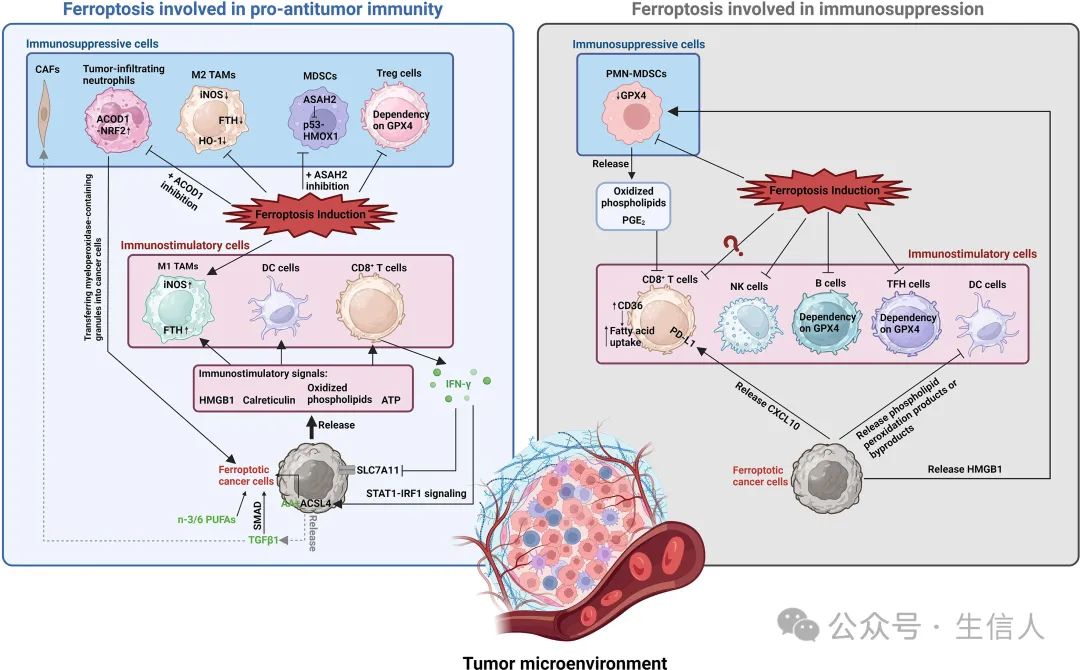
TME 中的各种细胞成分可通过增强或抑制铁死亡影响癌细胞对铁死亡的敏感性(图 3)。其中一个例子涉及 CD8 + T 细胞,它们分泌的干扰素γ(IFNγ)在一定程度上促进了癌细胞的铁死亡,而IFNγ不仅能抑制细胞对铁死亡的防御,还能增强驱动这一过程的代谢活动,从而促进脂质过氧化并诱导癌细胞中的铁死亡。肿瘤相关成纤维细胞(CAFs)是TME的另一个重要组成部分,对固有免疫和适应性免疫都有深远影响。CAFs通过上调长链非编码RNA DLEU1 或分泌 miR-522 在发挥抑制癌细胞的铁死亡作用。其他研究发现CAFs可阻碍 CD8 + T 细胞介导的抗肿瘤免疫,导致肿瘤对免疫疗法产生耐药性。这些研究强调了癌细胞、CAFs 和免疫细胞在调控铁死亡过程中复杂的相互作用。
3.3 TME中的铁死亡和固有免疫:抗肿瘤免疫的微妙平衡
在 M2 肿瘤相关巨噬细胞(TAMs) 中观察到的铁死亡敏感性增高,表明诱导死亡的疗法有可能选择性地靶向和消除 M2 TAMs,而不影响 M1 TAMs。这种疗法可以有效地将 M2 TAMs 重编程为 M1 表型,从而为克服免疫抑制性 TME 和提高癌症免疫疗法的疗效提供了一种有前景的策略。然而,也有研究显示铁死亡与TAMs之间存在更复杂的相互作用。
髓源性抑制细胞(MDSCs)是TME中另一种相关的免疫细胞类型,以其强大的免疫抑制功能而闻名。已证实抑制 N-酰基鞘氨醇酰胺水解酶 2(ASAH2)可诱导 MDSCs 的铁死亡,从而增强 CD8 + T 细胞的肿瘤浸润能力,进而加强其对肿瘤生长的抑制作用。此外,最近的另一项研究表明,具有免疫抑制特性的肿瘤浸润性中性粒细胞对铁死亡具有明显的抵抗力。NK 细胞在 TME 中的功能障碍与脂质过氧化驱动的氧化应激有关,铁死亡抑制剂可挽救 NK 细胞的功能和抗肿瘤活性。
3.4 铁死亡是肿瘤组织中适应性免疫的双刃剑
固有类 B 细胞(包括 B1 和边缘区 B 细胞)表现出活跃的脂质代谢,谷胱甘肽过氧化物酶4(GPX4) 对维持这些细胞的抗体反应和整体功能至关重要,使它们对 GPX4 缺乏诱导的铁死亡敏感。多项研究表明,在各种模型中,T 细胞对铁死亡具有相对抵抗力,从而支持了在癌细胞中选择性地诱导铁死亡,而不会明显损害 T 细胞介导的抗肿瘤免疫。研究发现通过各种方法诱导铁死亡对 T 细胞无害;相反,至少在某些情况下,它似乎能加强 T 细胞对肿瘤的免疫反应。然而,其他研究发现,T 细胞很容易受到 GPX4 抑制诱导的铁死亡影响。调节性 T(Treg)细胞是一个具有免疫抑制活性的亚群,它阻碍了针对肿瘤的保护性免疫监视,在 Treg 细胞中特异性地抑制 Gpx4 会增强抗肿瘤免疫反应。而滤泡辅助性 T(T FH )细胞表现出对铁死亡的易感性。
四、癌症治疗中靶向铁死亡
目前已发现多种 FINs,其中一些已成为成熟的临床药物,近年来人们对利用FINs 的潜力进行癌症治疗产生了浓厚的兴趣。在本节中,我们将深入探讨这些治疗方法的各个方面,包括战略性地研究某些癌症中的铁死亡漏洞以阻碍肿瘤生长、将铁死亡纳入免疫疗法以提高癌症疗法的整体疗效,以及应用铁死亡诱导克服现有疗法的耐药性。
4.1 靶向癌细胞中的铁死亡漏洞
这种方法旨在利用癌细胞对铁死亡的高度易感性,选择性地消灭癌细胞,同时保护正常细胞,从而提高疗效,减少不良反应。一些肿瘤抑制基因的功能突变主要通过重编程脂质代谢,使癌细胞更容易受到铁死亡的影响。例如,肿瘤抑制基因视网膜母细胞瘤 1(RB1)的缺失会激活 E2F 通路,导致酰基辅酶 A (CoA) 合酶 4 (ACSL4) 表达增加和 PUFA-PL 水平升高。这使 RB1 缺失的癌细胞对铁死亡敏感。除了脂质代谢的重编程外,其他肿瘤抑制基因的基因突变也会通过破坏铁平衡和扩大 ROS 生成等机制使癌细胞易受铁死亡的影响。癌细胞中的一些致癌改变也可以通过加强对半胱氨酸-GPX4途径的依赖,揭示出对铁死亡的易感性。即使没有与铁死亡敏感性直接相关的突变,某些类型的癌细胞也会表现出使其易受铁死亡影响的代谢特征。间质型癌细胞和顽固耐药性癌细胞就是这种易感性的例证。除了癌细胞的间充质状态外,其他一些代谢特征也使某些癌细胞易受铁死亡诱导。这种易感性源于三阴乳腺癌(TNBC) 细胞固有的独特代谢特征,包括丰富的 PUFAs、升高的易失铁池和受损的 GPX4-GSH 轴。
4.2 免疫治疗中靶向铁死亡
最近的研究表明,诱导肿瘤铁死亡或使肿瘤对铁死亡敏感可显著提高免疫疗法的疗效;反之,对铁死亡产生抗性的肿瘤也会表现出对免疫疗法的抗性。最近的临床前研究发现, GPX4 靶向 FINs 可以使肿瘤对免疫疗法敏感;将这些 GPX4 抑制剂与抗 PD-1/PD-L1 疗法结合使用,可以增强抗肿瘤免疫反应和肿瘤抑制效果。SLC7A11 或其伴侣蛋白 SLC3A2 的低表达或 ACSL4 的高表达已成为潜在的预测生物标志物,用于改善接受免疫疗法患者的临床疗效。总之,这些发现强调了靶向铁死亡增强免疫疗法疗效的潜力,为在癌症治疗中结合免疫疗法和铁死亡诱导剂提供了令人信服的证据。这些研究还表明,SLC7A11、GPX4 或 ACSL4 等铁死亡调节因子的表达水平或信号状态可用作生物标记物,以确定哪些患者群体可从免疫疗法中获得更有利的疗效。
4.3 靶向铁死亡克服治疗抵抗
事实证明,诱导铁死亡的方法可以有效克服对标准疗法(包括各种靶向疗法、化疗和放疗)的耐药性。通过金属硫蛋白1G(MT1G)抑制剂、SLC7A11抑制剂、或者脂质运载蛋白2(LCN2)抗体增强铁死亡,克服肝癌或肾癌细胞对索拉非尼的耐药性。最近的一项研究发现磷酸丝氨酰tRNA激酶(PSTK)是肝癌细胞对索拉非尼耐药的关键介质,该研究表明,PSTK 抑制剂通过破坏GSH代谢和GPX4失活来增强化疗的疗效。在 HER2 阳性乳腺癌中,选择性成纤维细胞生长因子受体 4(FGFR4)抑制剂通过下调 SLC7A11 和铁输出蛋白 ferroportin 1 有效对抗了耐药性,从而缓解了HER2 疗法的内在和获得性耐药性。细胞周期蛋白依赖性激酶 1(CDK1)抑制剂通过铁死亡依赖机制改善结肠癌中的奥沙利铂耐药性。
放疗通过各种机制诱导铁死亡,包括过度产生 ROS、上调 ACSL4 和消耗 GSH 水平。使用抑制 SLC7A11 或 GPX4 的 FINs 靶向这些适应性,可增强放疗诱导的铁死亡,提高肿瘤的放射敏感性。SLC7A11或GPX4抑制剂可以对抗获得性放射抵抗癌细胞中SLC7A11或GPX4的上调,从而克服放射抵抗。此外靶向铁死亡也成为克服肿瘤激素治疗耐药性的一种有前途的策略。
五、总结
近年来,铁死亡在癌症生物学和肿瘤学中引起了极大的关注,因为它在抑制肿瘤方面发挥着关键作用,并有可能成为肿瘤耐药性的致命弱点。有针对性地调节铁死亡为提高免疫疗法的疗效和克服既有癌症治疗方法的耐药性提供了一条前景广阔的途径。此外,临床前模型显示,FINs与传统癌症疗法联合使用可产生协同效应,且耐受性良好。
揭示不同细胞类型中铁死亡的复杂性仍是完善基于铁死亡的癌症疗法的关键一步,针对特定类型癌症或突变情况有针对性地提供铁死亡疗法。将以铁死亡为靶点的治疗策略从实验室推进到临床仍然是一项关键而艰巨的任务,还需要进行更多严格的临床试验,以证实这些药物对患者的疗效,确定它们使用时的安全性。此外,仍需确定和验证对铁死亡敏感的患者群体,开发可靠的生物标记物或代谢组学特征,用于预测和监测肿瘤对 FINs的反应性。为了应对这些挑战,整合单细胞组学、空间转录组学、蛋白质组学和代谢组学的多维评估可能会提供更有效的策略,对适合接受基于铁死亡疗法的患者进行分层。
这篇文章提供了对铁死亡在癌症治疗中作用的全面概述,从机制到治疗潜能,并强调了进一步研究这一领域的重要性。研究铁死亡的小伙伴可以详细认真学习一下,不仅可以帮助梳理相关研究思路,文章还提出了许多亟待解决的问题供大家深入研究、探讨。
Lei G, Zhuang L, Gan B. The roles of ferroptosis in cancer: Tumor suppression, tumor microenvironment, and therapeutic interventions . Cancer Cell 2024; 42 :513-34.
链接:http://www.lewenyixue.com/2024/11/18/Cancer%20Cell%EF%BC%9A%E9%93%81%E6%AD%BB%E4%BA%A1%E5%9C%A8%E7%99%8C%E7%97%87%E4%B8%AD%E7%9A%84/