《自然》:精准锁定肿瘤细胞!新晋诺奖得主合作开发新技术,免疫疗法有望再升级
抗击肿瘤时,如果杀敌一千自损八百,那显然不是最佳方案。然而无论是传统的化疗药物还是新兴的免疫疗法,都可能在靶向肿瘤细胞的同时影响到体内的健康细胞,脱靶造成“误伤”,引起不良反应。
如何更精准地区分肿瘤细胞和健康细胞? 对于开发CAR-T细胞疗法的研究者来说,这是一项关键挑战。CAR-T细胞是通过基因工程改造的免疫细胞,细胞上的工程化受体CAR(嵌合抗原受体)靶向肿瘤细胞表面的特异性抗原,是这些免疫细胞能够识别并消除肿瘤细胞的关键。但是,非肿瘤组织也可能表达同样的抗原,导致患者出现非肿瘤靶向毒性。
日前,在《自然》杂志上,加州大学旧金山分校(UCSF)的Kole Roibal博士与2024年诺贝尔化学奖得主David Baker教授合作,描述了他们开发的 一种可定制化受体:合成膜内蛋白水解受体(简称SNIPR) ,可以确保CAR-T细胞仅在特定环境——例如肿瘤附近被激活,从而精准锁定癌细胞,减少靶向非肿瘤毒性 。
作者指出,这一技术有望带来更精准更安全的抗癌疗法,同样的方法还可以用来开发治疗其他类型疾病的新型靶向疗法。
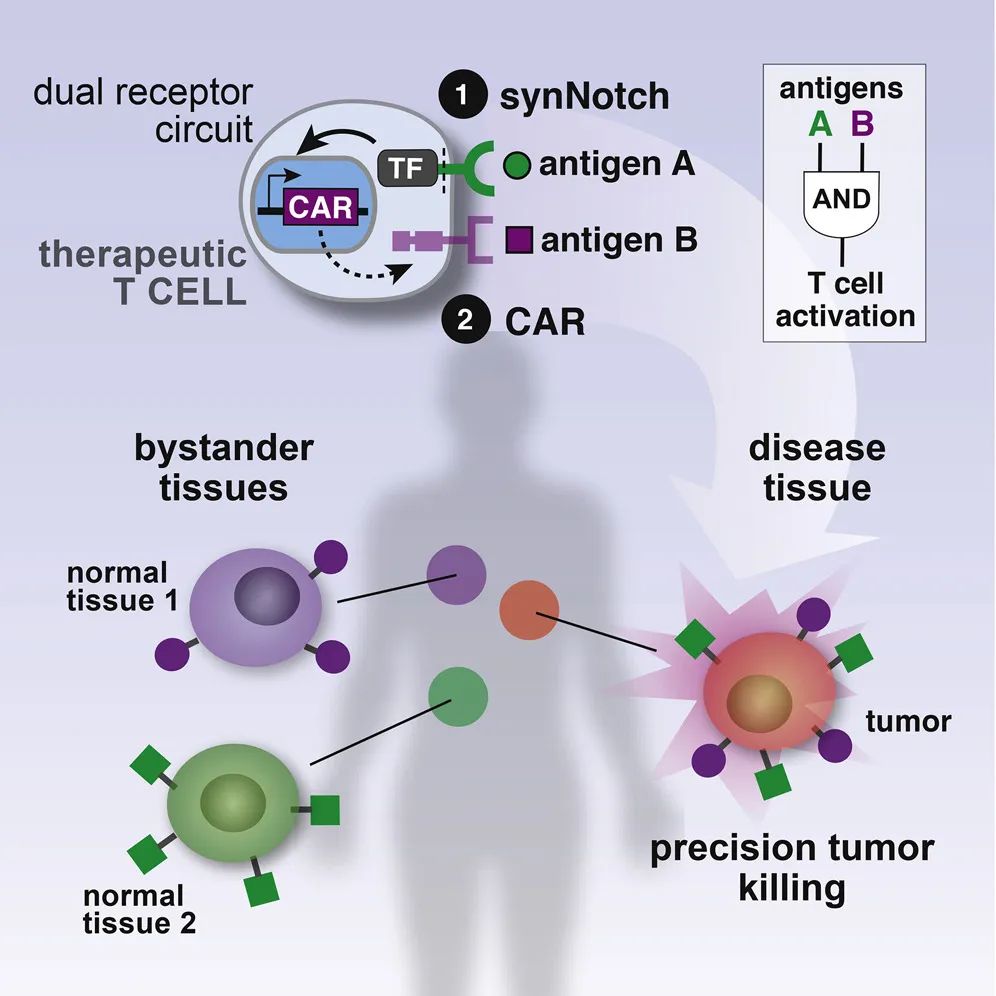
早在2016年,论文的共同通讯作者Kole Roibal博士与同事开发了一类名为 synNotch受体 的传感器,这种受体可以插入细胞并控制细胞的行为和功能,比如指导T细胞执行这样一个任务:找到具有肿瘤抗原A的细胞,但只有在肿瘤抗原B也存在时才激活T细胞的杀伤程序。从原理上来讲,synNotch受体是天然受体Notch的一种工程化版本,它的一部分伸到细胞外用于识别特定的目标——例如肿瘤特异性抗原;一部分在细胞内,当受体被激活时,胞内部分被释放进入细胞核,打开或关闭特定的基因——例如表达CAR的基因。这种方式可以在很大程度上降低脱靶效应。
▲ synNotch示意图(图片来源:参考资料[3])
此次新研究的SNIPR则是synNotch受体的“升级版”,经过工程改造,胞外部分不止能被细胞表面标志物激活,还具有了 被可溶性配体激活的额外能力 ,也就是能够检测出细胞周围环境中任何感兴趣的自由漂浮分子,比如肿瘤环境中的免疫信号分子。SNIPR与特定的分子相结合后,多个受体会聚集并发生内吞,翻转到细胞内部,发生pH依赖性切割。插入一个细胞内的多个SNIPR可以影响不同的基因,也可以以不同的方式影响同一个基因,改变基因的活性。
基于上述原理, 定制化的SNIPR可以确保细胞在身处特定环境中时执行特定任务,例如释放药物、激活免疫反应或是向其他细胞发送信号分子等 。
在《自然》的这篇论文中,研究团队把新设计的SNIPR插入到CAR-T细胞中,并规定SNIPR由可溶性免疫分子TGF-β和VEGF激活。这两种免疫分子的含量通常在肿瘤周围很高。 配备SNIPR的CAR-T细胞只有在TGF-β和VEGF存在时才会开启抗肿瘤活性,也就意味着它们不会在没有癌细胞的身体区域启动免疫反应 。
研究作者在人源肿瘤小鼠模型中做了初步验证,观察到配备SNIPR的CAR-T细胞精准地向肿瘤发起攻击, 在肿瘤缩小的同时,没有引起体重减轻、器官损伤等常见的CAR-T不良反应 。
接下来,研究团队表示他们计划开展CAR-T细胞临床试验,同时还将探索在不同细胞类型中使用SNIPR,介导不同细胞类型之间的通讯以及与环境的相互作用,带来更广泛的应用。
版权声明:本文为“乐问号”作者或机构在乐问医学上传并发布,仅代表该作者或机构观点,不代表乐问医学的观点或立场,不能作为个体诊疗依据,如有不适,请结合自身情况寻求医生的针对性治疗。
链接:http://www.lewenyixue.com/2024/11/18/%E3%80%8A%E8%87%AA%E7%84%B6%E3%80%8B%EF%BC%9A%E7%B2%BE%E5%87%86%E9%94%81%E5%AE%9A%E8%82%BF%E7%98%A4%E7%BB%86%E8%83%9E%EF%BC%81%E6%96%B0%E6%99%8B%E8%AF%BA%E5%A5%96%E5%BE%97%E4%B8%BB/
THE END