肺癌专栏 | 卢铀教授:适应性免疫放疗非小细胞肺癌的潜力与疗效

专家论坛
适应性免疫放疗非小细胞肺癌的潜力与疗效
姚卓然, 罗忍, 康凯, 薛建新, 卢铀
(四川大学华西医院)
摘要
以免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)为主的药物联合治疗,为驱动基因阴性晚期非小细胞肺癌(non-small cell lung cancer,NSCLC)带来了突破性进展,但目前仍然面临未满足临床需求的挑战。近期放疗免疫基础与临床转化研究成果,为迎接该挑战带来了希望。适应性免疫放疗(adaptive immunotherapy radiotherapy,AIRT)是一种具有潜能的治疗模式。AIRT的适用性与普及性,能够为大多数免疫化疗的患者带来可及性,以及潜在更好的临床疗效。但这也是放疗医师面对的挑战:需要更多的基础研究与临床试验加以证明。

专家介绍
卢铀 教授
四川大学华西医院
教授,主任医师,博士研究生导师。现任四川大学华西医院肿瘤中心副主任、胸部肿瘤科主任兼临床细胞治疗研究室主任。国家卫生健康突出贡献中青年专家,四川省有突出贡献专家。兼任国家食品药品监督管理总局药物审评咨询专家委员会委员,中国临床肿瘤学会非小细胞肺癌专家委员会副主任委员,中国临床肿瘤学会(CSCO)老年肿瘤防治专家委员会副主任委员,CSCO肿瘤支持与康复治疗专家委员会副主任委员,中国抗癌协会肿瘤多学科诊疗专业委员会常委,中国抗癌协会放射肿瘤专业委员会委员,中华医学会肿瘤学分会委员,中华医学会放射肿瘤治疗学分会免疫放疗学组副组长,四川省医师协会肿瘤医师专科委员会会长。四川省卫生健康委员会首席专家。参与编写美国国立综合癌症网络(NCCN)亚洲NSCLC诊治共识、中国《原发性肺癌诊疗规范》《CSCO非小细胞肺癌指南》《CSCO小细胞肺癌指南》、国家药品监督管理局药审中心《晚期NSCLC临床试验终点技术指导原则》、中国《放射治疗疼痛全程管理指南》等。
01
免疫检查点抑制剂治疗驱动基因阴性晚期非小细胞肺癌主要进展与问题
免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)治疗进展伴随两个重要问题: ICI治疗获益人群有限[1],与效应CD8+T细胞未被最佳激活[2]。 统计显示ICI治疗适合人群占比低于45%,其中晚期非小细胞肺癌(non-small cell lung cancer,NSCLC)占比21.5%,临床获益仅7.09%[1]。在接受ICI治疗患者中,存在超进展或微小获益的情况,表现在生存曲线中,ICI治疗组对比化疗或靶向治疗组的早期曲线交叉现象[3]。进一步对Ⅲ期临床试验生存曲线进行亚组分析,可观察到单药治疗中程序性死亡受体配体(PD-L1)高表达[肿瘤细胞阳性比例分数(tumor proportion score,TPS)≥50%]和低表达(TPS 1%~49%)人群,其无进展生存(progression-free survival,PFS)曲线与化疗组分别重叠4个月后以及6个月后分离或交叉超越[4-5]。对于PD-L1 TPS<1%亚组,ICI联合化疗组和化疗组PFS曲线明显重叠,于5~7.5个月后开始分离[6-9]。这种现象也见于总生存(overall survival,OS)曲线[10-11]。总结以上试验数据见图1,可见70%(单药ICI临床试验)及35%~55%(ICI联合化疗临床试验)人群PFS显示疗效微弱或不佳。约持续6个月后PFS曲线才会分离,显示其ICI特征性的免疫维持效应(图2)。OS曲线中,在持续3~12个月跌落10%~40%后曲线分离。 尽管多种因素影响ICI试验组与对照组曲线交叉分离现象,但免疫反应的早期阶段启动效应不足,或存在免疫治疗原发耐药是其重要原因[2,12-13],这在PD-L1 TPS<1%亚组人群尤为明显(图2)。 故单纯依赖于目前同质化的免疫化疗药物方案,难以满足临床需求[14]。
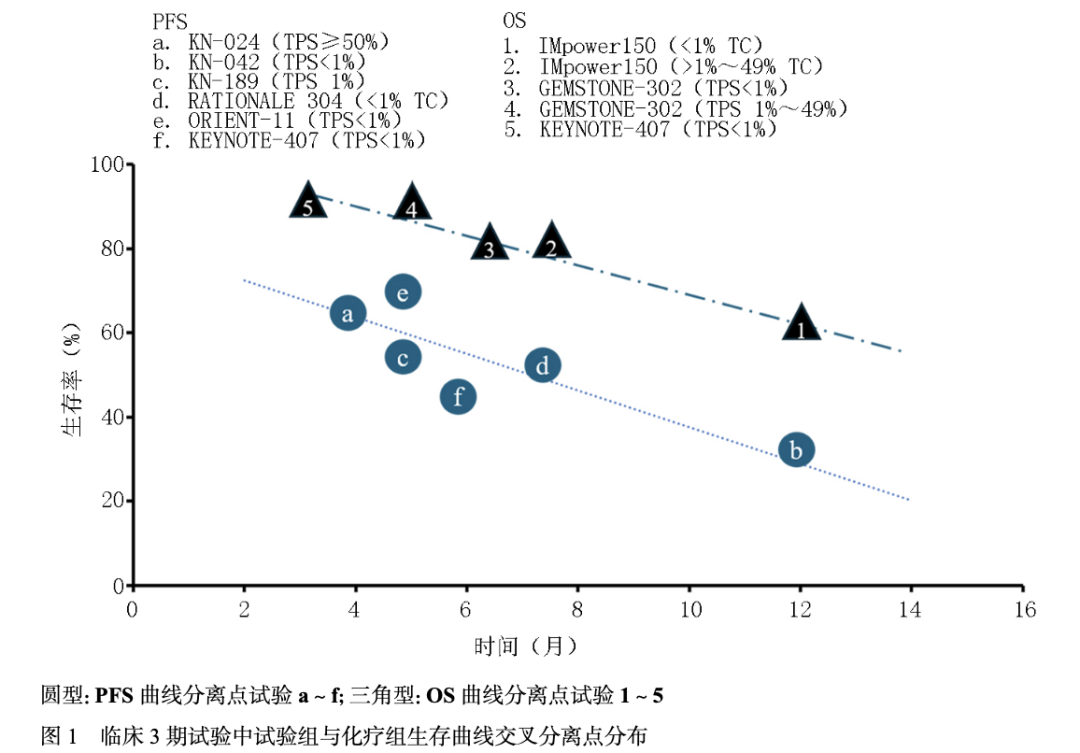
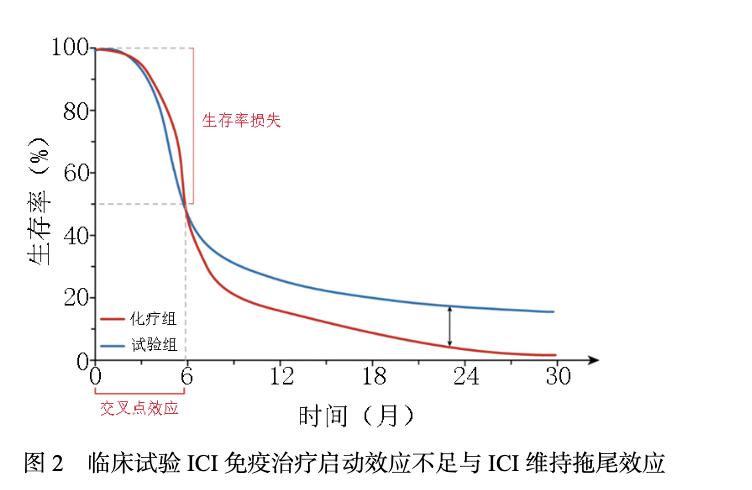
02
肿瘤免疫微环境的异质性、复杂性及其对免疫治疗的影响
ICI治疗本质是T细胞依赖性,与肿瘤微环境(tumor microenvironment,TME)免疫状态密切相关 [15-16]。为此,分别定义TME免疫炎症(热肿瘤)、免疫排斥和免疫沙漠型(冷肿瘤),其中免疫炎症型TME对ICI治疗有良好响应,而大多数“冷肿瘤”局部肿瘤免疫原性较低、免疫抑制性较强、CD8+T细胞浸润少、对ICI疗效不佳。 依据肿瘤免疫反应全过程[16],肿瘤抗原释放、树突状细胞(dendritic cell, DC)呈递抗原并激活T细胞是一个关键的免疫启动阶段;活化T细胞回到肿瘤病灶,识别并杀灭癌细胞是免疫效应阶段[15]。 ICI在效应阶段发挥作用,免疫效应强弱又极大的取决于肿瘤的实体特征[17-18],而免疫启动对后期效应发挥具有基础性作用。尽管免疫化疗效应具有一定的时空性与异质性而非线性表现,但临床试验中, 早期PFS的KM曲线延迟性分离特征,提示免疫效应在启动阶段存在不足。 如何重塑TME,使“冷肿瘤”变为“热肿瘤”是临床亟待解决的问题。
目前, 有研究表明TME存在生物性与物理性屏障[17-18],这有利于肿瘤的发生发展和免疫逃避,但对ICI免疫效应启动及其疗效发挥,构成了综合性的阻碍效应。 有研究发现TME内驻留T细胞,实质是表观遗传锁定而难以改变的衰竭CD8+T(Tex)细胞[2,19]。迄今尚无证据表明,ICI能使TME内功能失调的肿瘤反应性CD8+ T(Teff)细胞恢复功能,ICI的疗效是源自TME外部的正常邻近组织新鲜的、未衰竭的T细胞替代补充,并克隆性扩增与活化而产生[20]。与免疫沙漠或“冷肿瘤”相比,免疫浸润或“热肿瘤”的ICI临床反应的改善,可能是由于有不断吸引新T细胞的内在能力,而不是重新激活TME预存的肿瘤浸润淋巴细胞[21]。活化的T细胞与干细胞样记忆CD8+T细胞相关[22],这些干样T细胞对免疫效应的维持具有关键性作用[23]。在进展期肿瘤大负荷时(最大径≥8 cm),ICI治疗是无法引发T细胞“活化或复苏”的免疫反应,或因T细胞和肿瘤负荷之间不平衡,使ICI疗效不佳[24]。同期,新生血管生成参与肿瘤微环境调控,构建有利于肿瘤细胞增殖的异常血管巢,并主要通过糖酵解[25],使得TME基质区域严重酸化,当pH≤5.5时,T细胞会转为快速非凋亡细胞死亡[26]。另一方面,TME的纤维状细胞外基质(extracellular matrix,ECM)成分如胶原蛋白和纤连蛋白沉积增加,以及蛋白质交联和线性化的增加,导致ECM刚度增加。这种具有平行的各向线性化和交联基质,构成了TME微结构物理性屏障[17-18,27]。以上因素的加成,共同构建了一个对T细胞等免疫细胞浸润和药物进入肿瘤癌巢的强大遏制活性屏障,而使ICI治疗或免疫化疗NSCLC变得复杂与低效[1,12,16]。
03
放疗进展与存在的挑战
基于放射生物学4R效应以及现代放射物理发展基础的临床放疗技术,是肿瘤治疗的支柱手段,20多年来在NSCLC综合治疗中兼有根治和姑息性治疗的目的,并取得了重要进展[28-31]。早期研究证实常规分割放疗(conventional fractionated radiotherapy,CFRT)同步化疗治疗局部晚期NSCLC疗效优于单纯CFRT。除CFRT外,基于生物有效剂量(biological effective dose,BED)和线性二次方程(LQ模型),设计并临床应用的非常规分割放疗方案(经典超分割放疗、加速分割放疗、连续加速超分割放疗方案)[28],被认为可以在满足在不增加晚期正常组织(晚反应组织)损伤条件下,增加单纯放疗或放化联合治疗晚期NSCLC的局部疗效。结果显示,非常规分割方案在局部控制率上提高并未转化为长期生存获益,并伴有更高的急性不良反应。而尝试增加CFRT靶区总剂量,也并未提高生存获益[32]。 目前,NSCLC中主要应用3种放疗方案:标准CFRT同步化疗局部晚期NSCLC[29];大分割短程姑息放疗[31];以及立体定向放疗(stereotactic body radiation therapy,SBRT)或立体定向消融放疗(stereotactic ablative radiotherapy,SABR)治疗早期NSCLC,或寡病灶小肿瘤(通常最大径≤3 cm)[30]。而随着近40年研究后终于迎来了肿瘤放疗与免疫治疗的科学革命交汇点[33]。 多项放疗联合ICIs治疗NSCLC的临床研究为放疗免疫联合提供了科学合理的可行性基础,包括在不可手术局部晚期NSCLC(locally advanced-NSCLC,LA-NSCLC)治疗中联合治疗的突破性进展,5年生存率达42.9%[29],ICI-SABR(ISABR)综合治疗临床Ⅱ期试验的成功[34],以及“夹心式”免疫放疗模式在PD-L1 TPS≥50%的LA-NSCLC患者中展示的疗效前景[35]。而对于临床关切的放射免疫性肺不良反应事件,大多数为低度或临床可接受的。尽管如此,面对临床中更多的晚期NSCLC,现有的免疫放疗方案仍无法满足临床需求。
放疗与免疫效应的密切关联,可以追溯于放疗远隔效应(abscopal effect,AE)。 即受照射肿瘤病灶消退后,非受照射病灶也产生了缩小,这是因放射诱导的T细胞免疫介导的对远处肿瘤抑制效应[36]。AE以个案报道为主,多见于CFRT后恶性黑色素瘤、肾癌、肺腺癌等肿瘤。SBRT产生AE的报道,见于1例接受胸壁转移灶联合ICI治疗的恶性黑色素瘤患者,其出现了肺门淋巴结和肝转移灶消退[37]。提示SBRT联合ICI,可通过增加放疗的全身效应而获得的临床疗效。结合上述放射免疫学机制,SABR或SBRT+ICI治疗模式(ISABR)[34,38],似乎为转移性NSCLC治疗带来了新希望。 PEMBRO-RT 是一个重要的标志性试验[39],拟回答SBRT治疗单个NSCLC病灶序贯帕博利珠单抗(联合组),能否增强AE及临床疗效。结果显示,联合组客观疗效(objective response rate,ORR)虽较对照组增加1倍,但并未达到试验预设有意义的临床获益终点。值得注意的是,在转移性头颈部鳞癌患者试验中[40],类似设计的试验研究显示,两组间PFS和OS无改善,也无证据表明有AE,由此带来了对ISABR模式的极大疑问与挑战[41]。SBRT或SABR在不可手术早期NSCLC,以及晚期NSCLC寡转移病灶(≤5个)治疗中被推荐应用[30],是具有根治与潜在根治或高姑息性疗效。于是ISABR治疗模式后改为主张对多个或所有病灶的放疗,以增加获得有意义临床结果的可能性[38]。这种试验设想取得了初步验证[34], I-SABR显著改善了早期或淋巴结阴性的NSCLC肺孤立性复发灶患者4年无事件生存期,并具有可耐受的不良反应。然而,该结果尚需谨慎解读AE。事实上,临床试验SABR-COMET也达到了试验主要终点[42]。这2个临床研究结果[34,42],推定为SABR对所有小病灶贡献了高姑息或潜在根治性疗效,而不是AE或其显性效应。但尚不能排除SBRT/SABR导致的AE,或仅是亚临床效应,这在实验研究中得到了一定的验证[43]。
SBRT/SABR辐射剂量学特点,以≤3 cm直径定义小射野,在满足临床治疗安全性前提下,给与一种消融性剂量[28,44]。 当单次照射剂量≥8 Gy时,会产生肿瘤细胞的直接杀灭效应,以及肿瘤微血管内皮细胞继发杀灭效应[45],并且在BED等效条件下,SBRT比CFRT有更好的肿瘤微血管正常化效应[46]。同样实验发现, 相同BED,SBRT激发TME的免疫效应优于CFRT,虽然联合ICI可显著增强局部疗效,但对远隔病灶无明显疗效[43],这似乎对应了临床研究结果[34],及其疑问[39,41],寄希望SBRT产生AE,在ICI协助下获得全身性疗效,可能是个案[37]。因此,以SBRT/SABR为主要放疗技术手段,试图解决大多数晚期NSCLC,特别是大体积肿瘤的生物学和物理性屏障问题,在临床上不现实。制定科学合理的适应性放疗联合免疫治疗新方案或策略[47-48],是亟待深入研究的。
04
创新适应性免疫放疗
适应性治疗概念于2009年提出[49],是基于肿瘤微环境的时间和空间异质性,以及癌症表型适应治疗扰动的进化能力,通过允许肿瘤化疗敏感细胞存活以稳定肿瘤负荷,进而抑制耐药亚群肿瘤细胞的增殖。计算机模拟表明,这种策略可以延长生存期。研究发现使用旨在杀死最大数量肿瘤细胞的传统策略来治疗无法治愈的转移性癌症,在进化上不合理,因为存在“竞争性释放”进化现象[50]。因此,适应性放疗不仅是物理技术概念,更是在放疗生物免疫效应基础上[47],强调使放疗适应免疫治疗,作为ICI的联合治疗伴侣[48]。 基于传统放疗理念的靶区设计与剂量分割[28,47],不足以调节或增强免疫效应,或可能导致TME强烈免疫抑制,避免不必要淋巴结的照射,改进放疗技术方案,是适应性放疗设计的关键[48,51]。目前,临床前模型研究及其转化性临床试验探索,已取得了初步有意义的结果。实验研究发现,大分割放疗(8 Gy/次×3次)靶病灶,远隔病灶低剂量放疗(low-dose radiotherapy,LDRT)2 Gy/次×1~3次,同期联合ICI,可以显著增强LDRT远隔病灶的疗效,这与LDRT免疫重塑有关,而非低剂量肿瘤细胞杀伤相关,以此放疗免疫模式,在探索性临床病例治疗中得以初步证实,LDRT远隔病灶消退28%[52]。这一有意义的结果,得到了同期相似放疗设计研究的互相验证[53]。进一步临床1期试验,采用SBRT小病灶加LDRT大病灶,同步ICI治疗晚期NSCLC,证实该治疗模式的安全有效与可行性[54]。 这种“去化疗”式试验设计,也初步验证了SBRT的消融剂量可激发局部免疫,LDRT重塑免疫微环境产生归巢效应,并通过ICI增强了全身效应机理。其中,LDRT对远隔大体积靶病灶,具有小且安全的积分体积剂量效应,扮演一个TME“加热器”,从而使潜在亚临床级的AE转化为显性临床疗效。此外研究表明, 2 Gy 照射TME能有效募集T细胞[55]。每2周进行1次LDRT(总剂量分别为6 Gy和13 Gy)联合ICI,能逆转卵巢癌免疫荒漠和免疫抵抗[56]。这有益于干样T细胞迁移,进入免疫重塑的TME进一步发挥ICI疗效[24,48,51]。当临床面对仅有单个大肿瘤病灶时,设计LDRT嵌合1个或2个SBRT照射(external radiotherapy,ERT)联合ICI治疗模式(iERT),显示出明确的空间组合TME免疫重塑效应,以及对此类患者群体治疗的安全有效与实用性[57]。 愈加清楚的是,在TME中具有细胞毒性、抗原性、佐剂性和适合的微环境条件,是取得免疫治疗疗效的四要素[58],否则极可能导致ICI治疗的原发性或继发性耐药性[12]。 而SBRT/SABR消融剂量诱发的肿瘤细胞免疫原性死亡(immunogenic cell death,ICD)是一个关键触发点[59],可产生类免疫佐剂效应,通过LDRT重塑TME并结合化疗细胞毒效应[60],是有利于更好发挥ICI效应。
05
结语
总之, AIRT具有短程治疗可行性和患者良好依从性,有益于破除晚期NSCLC免疫化疗获益人群有限和疗效天花板效应。随着对肿瘤免疫微环境的异质性与复杂性,及其对免疫治疗影响的认识加深,为临床放疗带来了新的希望,但也是巨大挑战:在免疫治疗时代,如何创新有效安全的放疗技术联合免疫/免疫化疗方案,来满足晚期非小细胞肺癌临床需求,具有重要的现实意义与研究价值,并亟需更多的临床试验验证。
End
链接:http://www.lewenyixue.com/2024/11/17/%E8%82%BA%E7%99%8C%E4%B8%93%E6%A0%8F%20%20%7C%20%E5%8D%A2%E9%93%80%E6%95%99%E6%8E%88%EF%BC%9A%E9%80%82%E5%BA%94%E6%80%A7%E5%85%8D%E7%96%AB%E6%94%BE%E7%96%97/





赶快来坐沙发