杨旭光/林玉丽团队在消化领域权威杂志Gut发文揭示胰腺癌起始发病新机制
胰腺导管腺癌 (Pancreatic ductal adenocarcinoma,PDAC) 恶性程度高 、 死亡率高,主要由于胰腺癌病人缺少早期诊断指标,确诊时大多已是进展晚期 1 。PDAC的早期发生涉及从癌前病变到侵袭性腺癌的复杂过程,其中腺泡导管化生 (Acinar-to-ductal metaplasia,ADM) 是胰腺癌进展早期重要恶性转变阶段 2 。 KRAS 突变和炎症信号被认为是介导的ADM发生的重要信号,但是其中详细的调控机制还需进一步阐明 3 。针对这一科学问题,上海中医药大学附属龙华医院杨旭光团队与复旦大学上海医学院免疫学系林玉丽团队、上海交通大学医学院附属仁济医院夏青等研究团队展开合作,在消化领域权威杂志 Gut 发表了题为 Pancreatic STAT5 activation promotes KrasG12D- and inflammation- induced acinar-to-ductal metaplasia and pancreatic cancer 的最新研究成果。 研究发现信号转导与转录激活因子5(Signal transducer and activator of transcription,STAT5)通过调控胰腺细胞能量代谢 和 ADM转化,在PDAC发生早期以及进展阶段发挥重要角色。
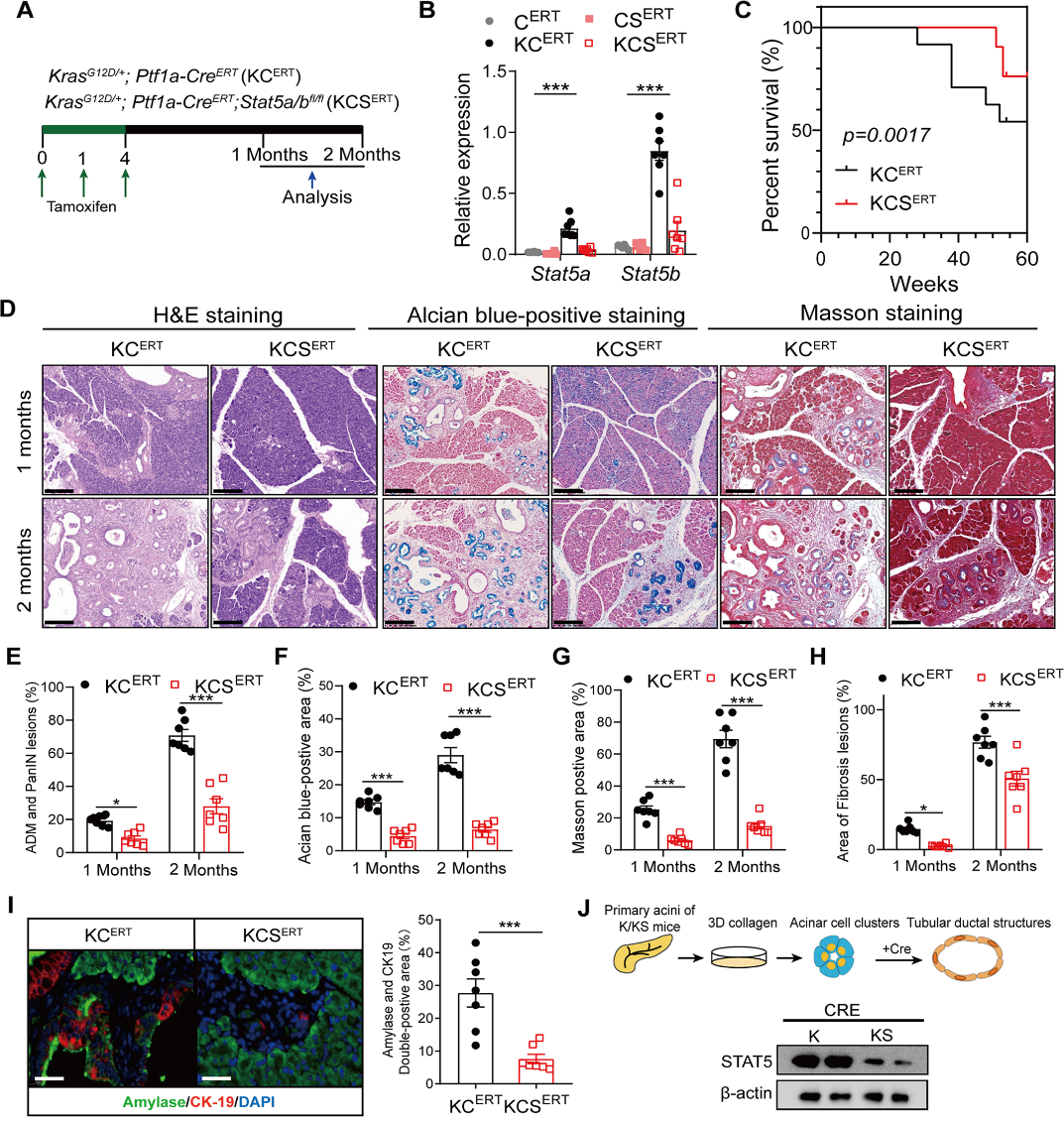
研究人员通过回顾性分析胰腺癌患者的样本,发现肿瘤细胞STAT5激活与胰腺癌的不良预后紧密相关。构建诱导两种自发胰腺癌小鼠模型,胰腺组织中STAT5的表达和磷酸化水平在癌变早期和进展期均显著增加,且这种增加在肿瘤细胞和基质细胞中均有体现。进一步通过构建基因敲除小鼠发现,胰腺细胞中STAT5缺失后ADM形成和胰腺癌进展均表现出显著的延迟,表明STAT5在ADM形成和胰腺癌进展中发挥着重要的促进作用。
研究人员进一步探究了STAT5在胰腺癌中的具体作用机制,发现STAT5缺失导致ADM进展中多个能量代谢相关的信号通路下调,包括脂质、谷胱甘肽和类固醇代谢过程。进一步验证了脂质代谢依赖的氧化磷酸化途径在ADM转化和胰腺癌细胞增殖中发挥重要作用,提示STAT5可能通过调控这一代谢过程影响胰腺癌细胞的增殖存活。机制研究发现,STAT5活化后通过转录编程调控转录因子HNF4。研究者还对STAT5上游激活因子进行探讨,发现炎症信号IL-22和 KRAS G12D 突变均能促进STAT5的激活。IL-22通过激活JAK1/2信号通路、 KRAS 突变通过PI3K途径影响STAT5的激活,并且二者存在协同作用。综上所述,本研究揭示了STAT5在胰腺癌进展中的关键作用。该研究从胰腺细胞的能量代谢这一全新视角,深入揭示了STAT5作为炎症损伤信号和 KRAS 突变下游分子参与促进胰腺腺泡细胞向导管细胞的异常转变以及后续的胰腺癌发生的机制,为靶向STAT5开发新的治疗策略提供了重要依据。
本研究得到了国家自然科学基金、科技部重大专项和上海市东方英才计划、启明星计划、上海市自然基金等多个国家级和省级基金项目的资助支持。
链接:http://www.lewenyixue.com/2024/11/13/%E6%9D%A8%E6%97%AD%E5%85%89-%E6%9E%97%E7%8E%89%E4%B8%BD%E5%9B%A2%E9%98%9F%E5%9C%A8%E6%B6%88%E5%8C%96%E9%A2%86%E5%9F%9F%E6%9D%83%E5%A8%81%E6%9D%82%E5%BF%97Gu/





 知道|国家药品不良反应监测年度报告(2024年)
知道|国家药品不良反应监测年度报告(2024年)
赶快来坐沙发