Nat Med | ctDNA基因组分析为实体瘤患者提供更精准的靶向治疗方案
撰文: M. B.
IF=58.7
推荐度: 
亮点:
1 、 ctDNA 基因分型方法尤其适用于那些需要快速治疗决策的患者。
2 、根据克隆性生物标志物来选择治疗的患者的临床获益更为明显。
3 、利用 ctDNA 进行基因组分析可以为实体瘤患者带来生存益处,并指导治疗选择。
近日,日本国立癌症中心的 Takayuki Yoshino 教授 团队在《 Nature medicine 》杂志上发表了名为“ Targeted therapy guided by circulating tumor DNAanalysis in advanced gastrointestinal tumors ”的文章。
综合基因组检测是治疗晚期实体瘤的常规方法。基于循环肿瘤 DNA ( ctDNA )的基因组检测由于微创性且结果快而被广泛使用,有助于找到适合靶向治疗的患者并提高生存率。尽管如此, ctDNA 检测并未广泛使用,通常只是作为组织检测的替代手段。
ctDNA 分析的另一个优势是能够揭示肿瘤内部的时间和空间异质性。这意味着 ctDNA 包含了所有肿瘤亚克隆释放的 DNA ,其中一些可能带有与原发肿瘤不同的基因变异,这些变异可能对选择最佳治疗方案有重要影响。然而,目前关于如何评估这种肿瘤内部的异质性以及它对治疗效果的影响的研究还不多。
为了填补对 ctDNA 指导治疗的了解不足,作者启动了 GOZILA 研究。这是一项覆盖全国的大型前瞻性研究,目的是分析晚期实体瘤患者血液中的 ctDNA 基因改变。超过 4000 名晚期癌症患者接受了根据 ctDNA 检测结果匹配的靶向治疗。这项研究不仅再次证实了 ctDNA 检测在筛选适合临床试验的患者方面优于传统组织检测,还进一步评估了这种治疗方式的有效性,为将来更多地将 ctDNA 检测应用于临床提供了依据。
1 、 ctDNA 基因分型指导的生物标志物匹配治疗
在这项研究中, TP53 是最常见的突变基因,紧随其后的是 APC 、 KRAS 和 EGFR 。 至数据截止日期,约有 952 名( 24% )患者接受了至少一次与 ctDNA 基因分型相匹配的靶向治疗。 结直肠癌患者最可能接受匹配治疗,而胰腺癌、食管癌和神经内分泌肿瘤患者接受的可能性较低。大多数匹配治疗被用作一线至三线治疗。胆道癌、神经内分泌肿瘤、食管癌、胃癌和肝细胞癌患者大多通过临床试验获得匹配治疗。
2 、 ctDNA 指导下的生物标志物匹配治疗的疗效
在研究中,作者根据诸如 RAS 野生型、 ERBB2 扩增和突变、 BRAF 突变和扩增等不同的分子生物标志物来定制治疗方案。 不同癌症的生物标志物差异表明,靶向治疗的适用性可能因肿瘤类型而异。 例如,微卫星不稳定性( MSI )高的患者更可能接受匹配的靶向治疗。使用的药物包括针对表皮生长因子受体( EGFR )、人表皮生长因子受体 2 ( HER2 )、 BRAF 、程序性细胞死亡 1 ( PD-1 )、程序性细胞死亡配体 1 ( PD-L1 )和 MEK 等靶点的治疗。
在癌症治疗的最新发展中,作者评估了 GOZILA 研究使用的药物类型,包括单克隆抗体、小分子抑制剂和抗体 - 药物偶联物( ADC )。研究发现, ADC 在靶向治疗中表现出最高的疗效 ,客观反应率( ORR )达到 57% ,单克隆抗体为 36% ,而小分子抑制剂只有 20% 。 ADC 和单克隆抗体的中位无进展生存期( PFS )分别为 6 个月和 5.6 个月,均显著优于小分子抑制剂。 这表明在精准医疗中, ADC 比传统治疗更有效。
GOZILA 研究的新分析显示,利用 ctDNA 进行基因分型,可为晚期实体瘤患者提供与组织基因分型相媲美或更优的治疗效果。研究发现,与组织分析相比,基于 ctDNA 基因分型的 MSI 或肿瘤突变负荷( TMB )高疾病的 HER2 靶向治疗的 ORR 显著增高。 这表明 ctDNA 基因分型在精准医疗和靶向治疗中是一种非常有效的方法,尤其适用于那些需要快速治疗决策的患者 。
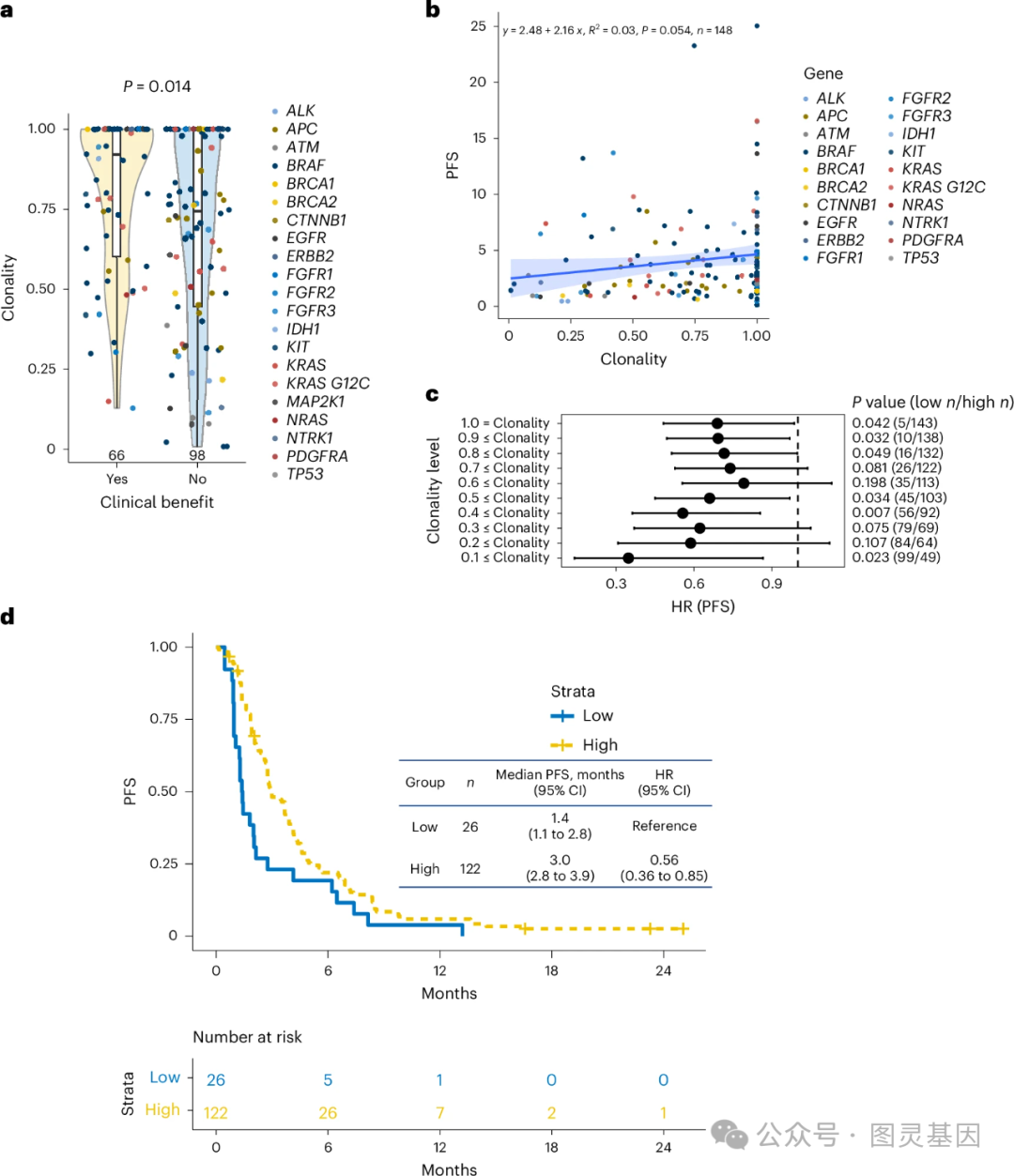
3 、 ctDNA 克隆性分析的疗效
作者分析了接受匹配治疗患者的 ctDNA ,特别关注了指导治疗的生物标志物的克隆性——也就是这些变异在患者体内存在的普遍程度。 作者发现,临床获益和 PFS 与这些生物标志物的克隆性有显著关联。 具体来说,显示出有临床反应的患者,其体内靶向变异的克隆性水平中位数( 92% )远高于无临床获益的患者( 74% )。此外,作者还观察到 PFS 与克隆性呈正相关。这些发现强调了在评估 ctDNA 结果和基于靶向生物标志物制定治疗决策时,考虑克隆性的重要性。
作者发现选择合适的临界值对制定治疗计划来说非常关键。作者观察了克隆性与患者从靶向治疗中获益之间的关系,并分析了这种关系如何随克隆性阈值的变化而变化。结果表明,无论如何设定阈值,患者 PFS 的风险比( HR )都保持在 1 以下,这意味着治疗是有效的。特别是当克隆性阈值设定在 0.4 以上时,治疗效果最为显著。 总之,那些根据克隆性生物标志物来选择治疗的患者的临床获益更为明显。
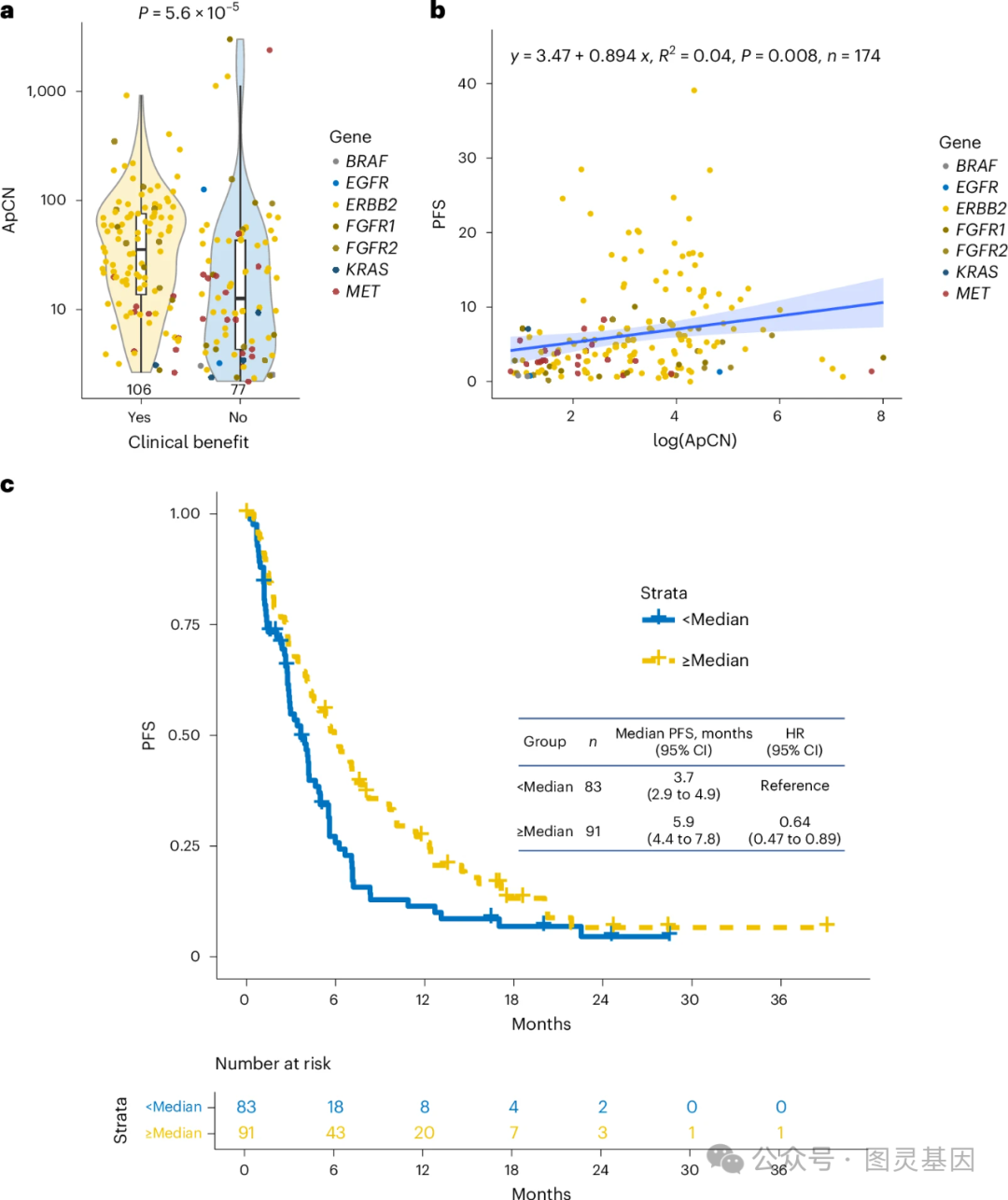
4 、通过血浆肿瘤 DNA 拷贝数评估治疗效能
研究发现,血浆中的肿瘤 DNA 拷贝数( pCN )在未调整肿瘤比例时,与治疗效果和 PFS 关系不大,且 pCN 较高可能预示较低的治疗效果。然而,当作者调整了肿瘤比例后, 发现调整后的 pCN ( ApCN )与治疗效果和 PFS 显著相关。临床获益的患者通常具有较高的 ApCN ,且这一现象在结直肠癌、胰腺癌和食管癌等五种主要癌症类型中得到了一致的观察。这意味着,通过考虑肿瘤比例调整后的 pCN ,医生可以更准确地预测患者的治疗反应。
作者特别分析了 ERBB2 基因扩增对癌症治疗的影响。 在 ERBB2 组中,临床获益的患者的 ApCN 显著高于无临床获益的患者。 虽然在其他基因的治疗中没有发现统计学上的显著差异,但 ApCN 较高的患者也显示出更好的治疗效果。 这些结果表明,在根据 ctDNA 结果选择治疗方案时,考虑克隆性和 ApCN 对于预测治疗反应是非常重要的。
总之,这些数据描述了利用 ctDNA 进行基因组分析可以为实体瘤患者带来生存益处,并指导治疗选择。 ctDNA 的克隆性预测能力有助于在面对具有治疗意义的亚克隆生物标志物时,做出更合理的临床决策。 本研究涉及 4000 多名不同肿瘤类型的晚期癌症患者,提供了基于生存率的证据,研究结果支持将 ctDNA 基因组分析作为晚期实体瘤患者标准治疗的一部分。
教授介绍
Takayuki Yoshino 教授 ,日本国立癌症研究中心东病院的著名专家。 Takayuki Yoshino 教授的研究主要集中在基因突变和精准医疗的应用上,特别是在 PARADIGM 试验中的贡献,这一试验证明了抗 EGFR 抗体与抗 VEGF 抗体联合标准双联化疗在特定类型的结直肠癌患者中的疗效。这一发现对于改善这些患者的生存期具有重要意义,并且已经被纳入主要临床指南中,成为该类型患者的标准一线联合治疗方案。
参考文献
Nakamura Y et al. “Targeted therapy guided by circulating tumor DNAanalysis in advanced gastrointestinal tumors” Nat Med. Sep 16 2024. doi: 10.1038/s41591-024-03244-8.
链接:http://www.lewenyixue.com/2024/11/06/Nat%20Med%20%7C%20ctDNA%E5%9F%BA%E5%9B%A0%E7%BB%84%E5%88%86%E6%9E%90/










赶快来坐沙发