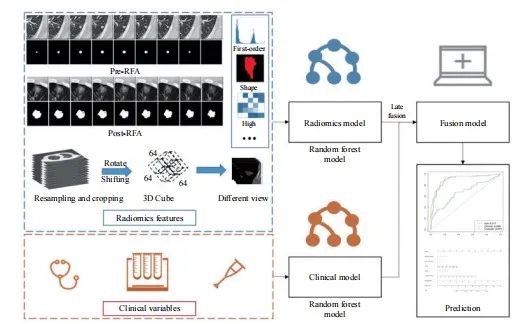
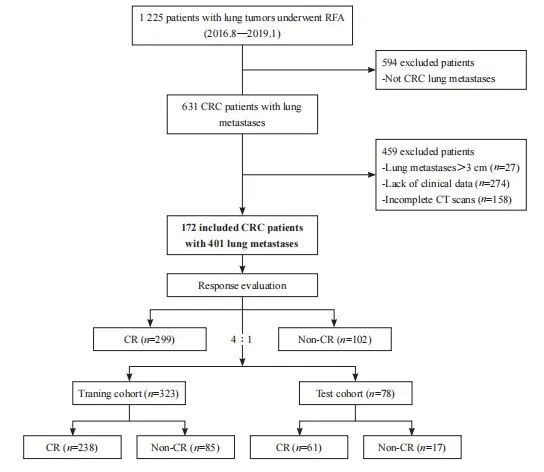
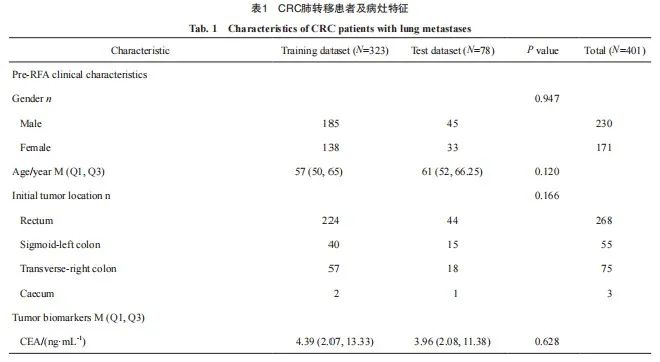
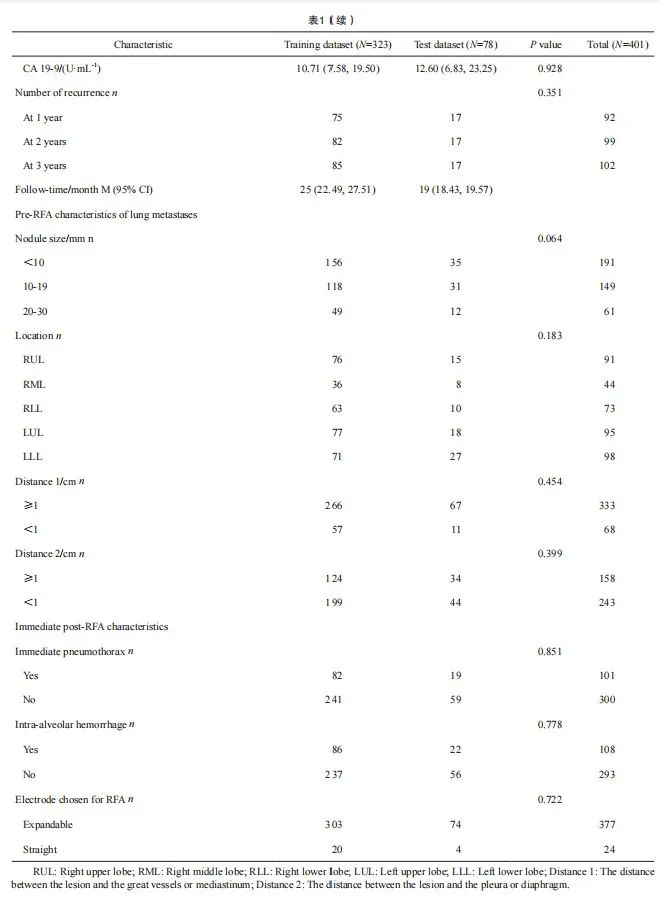
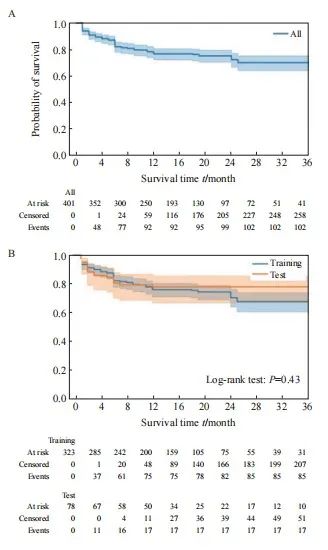
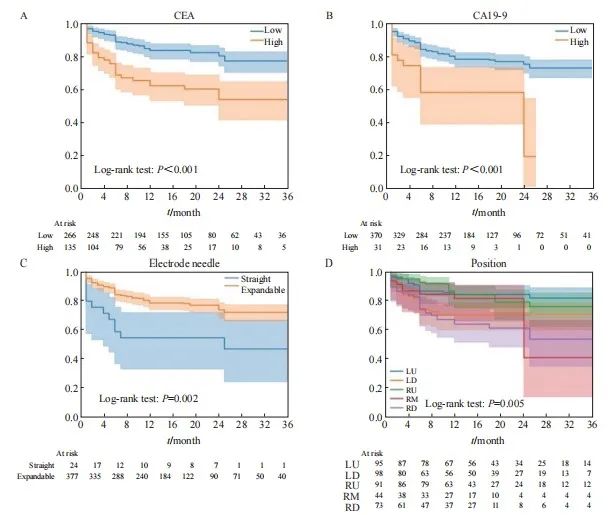
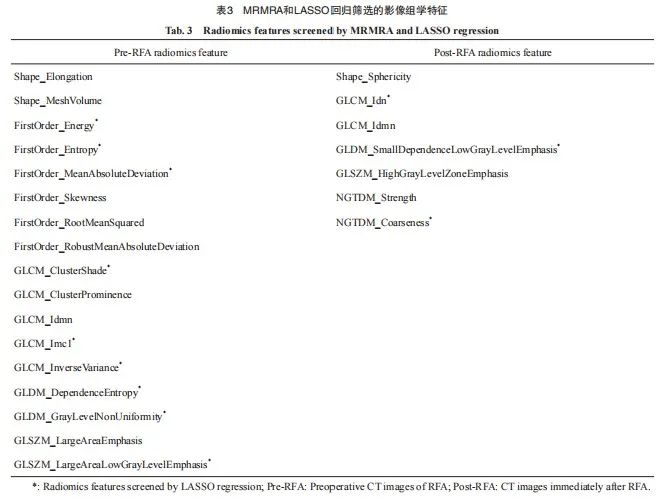
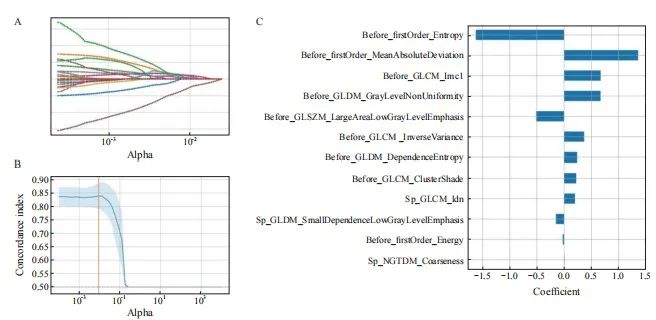
【论著】| 基于CT的影像组学诺模图预测结直肠癌肺转移射频消融后的局部肿瘤进展
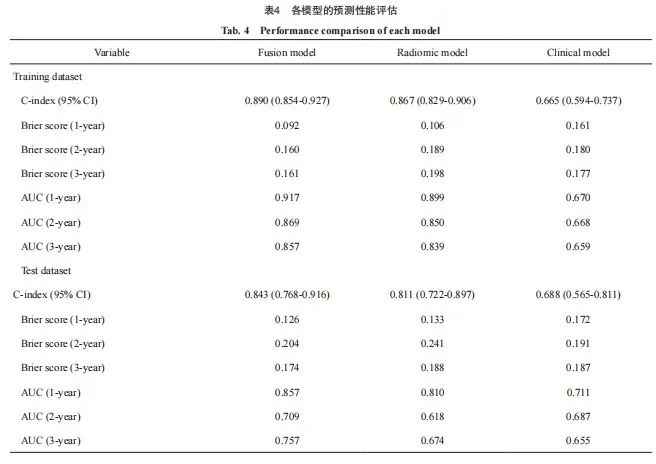
引用本文 黄浩哲,陈 红,郑德重,等. 基于CT的影像组学诺模图预测结直肠癌肺转移射频消融后的局部肿瘤进展[J]. 中国癌症杂志, 2024, 34 (9): 857-872. 基金项目:上海市抗癌协会“雏鹰”计划(SACA-CY23B03)。 第一作者:黄浩哲,博士,主治医师。 共同第一作者:陈红,博士在读,主治医师。 通信作者:李文涛,博士,主任医师,复旦大学附属肿瘤医院介入治疗科主任。 第一作者简介 黄浩哲,医学博士,复旦大学附属肿瘤医院介入治疗科主治医师。学术任职:中国医药教育协会介入微创治疗专委会委员,上海市医学会肿瘤介入专科分会青年委员,上海市抗癌协会实体肿瘤聚焦诊疗专业委员会常务委员,上海市抗癌协会实体肿瘤聚焦诊疗专委会血管通路专委会委员,上海市社会医疗机构协会肿瘤学分会乳腺多学科专委会委员,上海市抗癌协会影像专业委员会介入学组组员。共发表学术论文13篇,其中在SCI收录期刊上发表7篇。主持上海市抗癌协会雏鹰项目1项。获得2023年全国放射介入引流病例大赛上海赛区一等奖。 通信作者简介 李文涛,博士研究生导师,复旦大学附属肿瘤医院介入治疗科主任医师。学术任职:上海市抗癌协会实体肿瘤聚焦诊疗专业委员会主任委员;上海抗癌协会肿瘤影像专委会候任主委;世界冷冻外科协会执行委员;亚洲冷冻外科协会副主任委员;中国抗癌协会肿瘤介入学专业委员会副主任委员;中国抗癌协会肿瘤介入学专业委员会肝癌专家委员会副主任委员;上海抗癌协会肿瘤介入专业委员会常委;中华放射学会介入放射学组委员。《介入放射学杂志》《中国癌症杂志》编委。获得上海市抗癌科技奖一等奖一项、中国抗癌科技奖三等奖一项、上海市抗癌科技奖三等奖一项。 基于CT的影像组学诺模图预测结直肠癌肺转移射频消融后的局部肿瘤进展 黄浩哲 1 ,陈 红 2 ,郑德重 3 ,陈 超 1 ,王 英 1 ,许立超 1 ,王耀辉 1 ,何新红 1 ,杨媛媛 3 ,李文涛 1 1.复旦大学附属肿瘤医院介入治疗科,复旦大学上海医学院肿瘤学系,上海 200032; 2.上海交通大学医学院附属第六人民医院核医学科,上海 200233; 3.中国科学院上海技术物理研究所医学影像实验室,上海 200083 [摘要] 背景与目的:早期预测结直肠癌(colorectal cancer,CRC)肺转移瘤经过射频消融(radiofrequency ablation, RFA)治疗后的局部肿瘤无进展生存期(local tumor progression-free survival,LTPFS)具有重要的临床意义。影像组学在肿瘤预后预测方面已有一定的探索。本研究旨在构建基于影像组学的诺模图预测CRC肺转移患者RFA治疗后的LTPFS。 方法:本研究回顾性分析2016年8月—2019年1月复旦大学附属肿瘤医院介入治疗科收治的172例伴有401个肺转移病灶的CRC患者。本研究通过复旦大学附属肿瘤医院医学伦理委员会的审查(伦理编号:2402291-24)。将患者的RFA术前及术后即刻计算机体层成像(computed tomography,CT)图像通过数据增强后,人工分割靶病灶和RFA后区域后提取影像组学特征。采用最大相关最小冗余算法(maximum relevance and minimum redundancy algorithm,MRMRA)和最小绝对值收敛(least absolute shrinkage and selection operator,LASSO)回归模型进行特征筛选。基于筛选后的影像组学特征和多因素分析筛选的临床变量,分别构建临床模型、影像组学模型和融合模型。计算一致性指数(concordance index,C-index)和受试者工作特征(receiver operating characteristic,ROC)曲线的曲线下面积(area under curve,AUC)来评估3种模型的预测性能,最后绘制最佳模型对应的诺模图。 结果:在所有肺转移瘤中,最终复发的病灶有102个(25.4%),完全缓解(complete response,CR)的病灶有299个(74.6%)。中位随访时间为21个月(95% CI:19.466~22.534),RFA术后的1、2和3年的LTPFS率分别为76.5%(95% CI:72.0~80.4)、72.1%(95% CI:66.6~76.9)和69.9%(95% CI:64.0~75.1)。无论在训练集还是测试集中,基于LASSO回归模型最终筛选的12个影像组学特征和多因素分析筛选的4个临床变量而构建的融合模型预测LTPFS的AUC最高,C-index分别为0.890(95% CI:0.854~0.927)和0.843(95% CI:0.768~0.916)。 结论:基于影像组学特征和临床变量的融合模型预测CRC肺转移患者RFA治疗后的LTPFS是可行的,并且其性能优于单一影像组学模型和临床模型。同时,融合模型的诺模图可以更直观地预测CRC肺转移患者RFA治疗的预后,协助临床医师为患者制订个体化的随访复查方案,灵活地调整治疗策略。 [关键词]计算机断层扫描;影像组学;诺模图;结直肠癌;肺转移;射频消融 [Abstract] Background and Purpose:The early prediction of local tumor progression-free survival (LTPFS) after radiofrequency ablation (RFA) for colorectal cancer (CRC) lung metastases has significant clinical importance. The application of radiomics in the prediction of tumor prognosis has been explored. This study aimed to construct a radiomics-based nomogram for predicting LTPFS after RFA in CRC patients with lung metastases. Methods:This study retrospectively analyzed 172 CRC patients with 401 lung metastases admitted to Department of Interventional Radiology, Fudan University Shanghai Cancer Center from August 2016 to January 2019. This study was reviewed by the medical ethics committee of Fudan University Shanghai Cancer Center (ethics number: 2402291-24). After augmentation of pre-ablation and immediate post-ablation computed tomography (CT) images, the target metastases and ablation regions were segmented manually to extract the radiomic features. Maximum relevance and minimum redundancy algorithm (MRMRA) and least absolute shrinkage and selection operator (LASSO) regression models were applied for feature selection. The clinical model, the radiomics model, and the fusion model were constructed based on the selected radiomic features and clinical variables screened by the multivariate analysis. The Harrell concordance index (C-index) and area under receiver operating characteristic (ROC) curves (AUC) were calculated to evaluate the prediction performance. Finally, the corresponding nomogram of the best model was drawn. Results:Among all the lung metastases, 102 (25.4%) had final recurrence, and 299 (74.6%) had complete response (CR). The median follow-up time was 21 months (95% CI: 19.466-22.534), and the LTPFS rates at 1, 2, and 3 years after RFA were 76.5% (95% CI: 72.0-80.4), 72.1% (95% CI: 66.6-76.9) and 69.9% (95% CI: 64.0-75.1). In both the training and test dataset, the fusion model based on the final 12 radiomic features through the LASSO regression and 4 clinical variables screened by multivariate analysis achieved the highest AUC values for LTPFS, with C-index values of 0.890 (95% CI: 0.854-0.927) and 0.843 (95% CI: 0.768-0.916), respectively. Conclusion:The fusion model based on radiomic features and clinical variables is feasible for predicting LTPFS after RFA of CRC patients with lung metastases, whose performance is superior to the single radiomic and clinical model. At the same time, the nomogram of the fusion model can intuitively predict the prognosis of CRC patients with lung metastases after RFA, thus assisting clinicians in developing inpidualized follow-up review plans for patients and adjusting treatment strategies flexibly. [Key words]Computed tomography; Radiomics; Nomogram; Colorectal cancer; Lung metastases; Radiofrequency ablation 中国结直肠癌(colorectal cancer,CRC)的发病率和死亡率均位居所有恶性肿瘤的第5位 [1]。相比于结肠癌,直肠癌更容易发生肺转移 [2],且中国有近一半的CRC患者为直肠癌,显著高于欧美国家的30% [3]。目前对于肺转移的局部治疗主要包括手术切除、放疗及消融治疗。有研究 [4]证实,对于可切除的肺转移瘤,术后5年生存率为35%~70%。但若因为肿瘤部位、肺功能、耐受性及患者意愿等原因不适合接受手术切除,可以考虑放疗和消融治疗 [5]。临床上常采用的消融治疗主要包括射频消融(radiofrequency ablation,RFA)、微波消融及冷冻消融等 [6]。RFA可以延长寡转移患者的生存期,并减少因肺转移引起的症状和并发症 [7],表现出较高的安全性和有效性 [8]。然而,与手术切除不同,RFA治疗无法获得完全消融的病理组织学证据,因此,肺部肿瘤RFA术后的局部肿瘤进展(local tumor progression,LTP)较常见,会直接缩短患者的局部肿瘤无进展生存期(local tumor progression-free survival,LTPFS),从而间接影响总生存期(overall survival,OS) [9]。有研究 [10]表明,原发性和转移性肺肿瘤RFA术后LTP率分别高达52%和37%。所以,明确RFA术后局部复发因素以及早期预测LTPFS至关重要。 影像组学能够挖掘医学图像更深层次的高维量化影像学特征,将其解码为人眼不可见的定量特征,包括形状、大小、纹理和体素强度 [11],而这些特征包含与肿瘤异质性及肿瘤微环境相关的信息 [12]。将这些特征作为机器学习模型的输入信号,经过训练后,能够精准地量化表型特征、评估治疗反应和预测预后 [13],从而支持临床决策。影像组学特征分析方法主要包括靶病灶分割、影像组学特征提取、机器学习分类器训练和性能评价 [14]。既往研究 [8-9]已证实肿瘤大小、部位、消融范围、病灶与血管距离、RFA针类型、肿瘤标志物及系统性治疗都是影响RFA治疗的重要预后因素。然而,基于影像组学预后预测的相关研究较少。因此,本研究旨在构建基于影像组学的诺模图,从而预测CRC肺转移患者RFA治疗后的LTPFS。 1 资料和方法 1.1 研究对象和数据采集 回顾性分析2016年8月—2019年1月在复旦大学附属肿瘤医院介入治疗科接受肺RFA的CRC肺转移患者。本研究已通过复旦大学附属肿瘤医院医学伦理委员会的审查(伦理编号:2402291-24),免除患者知情同意。纳入标准:⑴ 病理学检查证实为CRC;⑵ 病理学检查或临床诊断为肺转移,且病灶最大直径<3 cm;⑶ 有完整的临床和影像学资料[消融术中计算机体层成像(computed tomography,CT)图像和术后随访图像];⑷ 技术性完全消融;⑸ 脏器功能正常。排除标准:⑴ 靶病灶既往接受过局部治疗,包括消融治疗、放疗等;⑵ 患者无法耐受RFA治疗;⑶ 除了CRC,同时伴有其他恶性肿瘤或肺外转移瘤。临床资料主要包括年龄、性别、原发肿瘤部位、初诊时淋巴结转移情况、同期是否行系统治疗和肿瘤标志物[癌胚抗原(carcinoembryonic antigen,CEA)和糖类抗原19-9(carbohydrate antigen 19-9,CA19-9)]。影像学资料主要包括肺转移瘤部位,是否靠近心脏、大血管(直径大于3 mm)及胸膜或膈肌(1 cm以内),消融探针类型,以及术中是否伴发肺内渗血或气胸。术中及术后CT检查均采用固定管电流200 mA,管电压120 kVp。像素间距为0.684~0.748 mm,层厚为1.0或1.5 mm。RFA术中及术后即刻图像采用固定管电流200 mA,管电压120 kVp,层厚为1.0或3.0 mm。影像学随访包括术后1、3、6、12个月和之后每6个月的胸部增强CT检查。 1.2 CT引导下经皮肺RFA、局部疗效评估及LTPFS计算 本研究所有RFA均在CT引导下局部麻醉操作,所采用的射频电极包括多针伸展型单极射频电极[迈德医疗科技(上海)有限公司]和单针冷循环型双极射频电极(德国Olympus公司)。根据病灶大小,选择合适的消融电极型号。根据病灶的位置,选取合适的体位,确保穿刺通道距离最短,且能够避开骨骼、叶间裂及血管等重要结构。乙醇消毒,铺洞巾,用2%利多卡因局部麻醉,直至胸膜。将射频电极按照预定方向和角度穿刺病灶,CT扫描确认电极处于病灶内后,进行消融,待阻抗升高,直至射频自动暂停,如此消融操作2~3次。术中患者若因疼痛不能配合时,给予适量酒石酸布托啡诺注射液静脉注射,待患者症状缓解后,继续消融。为尽可能保证完全消融,消融范围应超出病灶0.5~1.0 cm。病灶消融结束后,进行针道消融,从而减少肿瘤种植转移及出血。术后即刻行全胸CT扫描,观察病灶消融情况,有无气胸、出血等并发症,然后送返病房,心电监护2~4 h。术后12 h行胸部X线检查,再次明确是否有并发症发生。 局部疗效评估:RFA术后常规行胸部增强CT检查进行疗效评估,由2名对临床数据不知晓的医师(分别有5和10年胸部肿瘤诊断经验)根据改良版实体瘤疗效评价标准(modified Response Evaluation Criteria in Solid Tumors,mRECIST)对于术后随访复查的胸部增强CT图像进行评估 [15-16]。完全缓解(complete response,CR):CT显示出现下列任何一项表现,如病灶消失,空洞、结节或纤维化,且无强化。LTP:在常规随访中,连续两次CT检查显示病灶周围(1 cm以内)出现散在、结节状、不规则偏心性实性成分强化。如果患者接受过正电子发射计算机体层成像(positron emission tomography and computed tomography,PET/CT)检查,则CR的病灶表现为无高代谢,即标准摄取值(standard uptake value,SUV)低,反之为LTP。若评估疗效的2名医师出现分歧,将由另1名高年资医师(有20年胸部肿瘤诊断经验)确定最终疗效。 LTPFS定义为从RFA治疗开始至病灶发生复发或任何原因死亡的时间(以月为单位)。 1.3 CT图像预处理和靶区分割 为避免由于RFA术前CT图像和术后即刻CT图像扫描间距和层厚差异导致的数据偏差,本研究采用以下图像预处理:首先使用样条插值算法将CT图像分辨率归一化到1 mm×1 mm×1 mm,然后将窗宽调整在-1 350 ~ 250 Hu,再将重新采样的轴向CT图像缩放到0~255,把包含靶病灶的样本裁剪为64 mm×64 mm×64 mm的三维立方体。最后,将样本立方体灰度值标准化为0~1。研究流程详见图1。 为了客观精准地勾画RFA术前CT图像中的靶病灶及术后即刻消融区域,由2名放射学专业医师(分别有5和10年胸部肿瘤介入治疗经验)使用ITK-SNAP软件(http://www.itksnap.org)对感兴趣区(region of interest,ROI)进行逐层分割,同时注意避免勾画病灶相邻的支气管、大血管和淋巴结等结构。如果有分歧,将由1名高年资放射学专业医师(有20年胸部肿瘤介入治疗经验)复核确定。随机选取30例肺转移病灶的CT图像,由2名影像学专业医师独立勾画ROI,并采用组内相关性系数(intraclass correlation coefficient,ICC)进行观察者间和观察者内的一致性分析。ICC>0.75为一致性良好。 图1 研究流程图 Fig. 1 Workflow of the study 1.4 影像组学特征提取、筛选和数据划分 分别计算分割出来的术前病灶和RFA术后3D消融区域的1 252种影像组学特征 [17],主要包括13个直方图特征、39个高斯拉普拉斯(Laplacian of Gaussian,LoG)特征、39个Vessel特征、156个Gabor特征、39个局部二值模式(local binary pattern,LBP)特征、9个Orientation特征、39个Local phase特征、35个形状类特征、195个纹理类特征[144个灰度共生矩阵(gray level co-occurrence,GLCM)、16个灰度区域大小矩阵(gray level size zone matrix,GLSZM)、16个灰度运行长度矩阵(gray level run length matrix,GLRLM)、5个邻接灰度差分矩阵(neighboring gray-tone difference matrix,NGTDM)和14个灰度依赖矩阵(gray level dependence matrix,GLDM)]及688个小波特征。 本研究先采用最大相关最小冗余算法(maximum relevance and minimum redundancy algorithm,MRMRA)来进行特征筛选,再通过最小绝对值收敛(least absolute shrinkage and selection operator,LASSO)回归模型进一步筛选特征。 1.5 临床模型、影像组学模型、融合模型和诺模图的构建 随机森林是一种利用回归树技术的特征分类器,它包含多个决策树,输出结果由每个决策树的子类别决定,通过预测变量的自举聚合和随机化来实现较高的预测准确度 [18]。研究证实该算法在处理高维数据,特别是不平衡的医疗数据时,具有较强的抗干扰和抗过拟合能力,并采用合成少数类过采样技术(synthetic minority over-sampling technique,SMOTE) [20]来缓解数据分布不均衡对模型产生的偏倚影响。 临床模型:对所有临床变量和影像学特征进行单因素COX回归分析,然后把P<0.1的变量纳入多因素分析,最终筛选出P<0.05的独立危险因素构建临床模型。 影像组学模型:利用MRMRA和LASSO回归筛选冗长和不必要的特征,利用最终筛选出的特征构建影像组学模型。 融合模型:采用后融合技术 [21]将多因素分析筛选出的独立危险因素和LASSO回归模型筛选出的影像组学特征进行融合构建模型。该融合技术能够将不同表示形式的特征组合成相同的表示形式,从而具有更好的扩展性和灵活性 [22]。 诺模图:使用R语言的“rms”软件包绘制可视化的诺模图,预测1、2和3年的LTPFS率。 1.6 模型预测性能评估 为了评估模型的预测性能,本研究将在独立的测试数据集上进行验证和对比。利用模型获得的预测分数绘制受试者工作特征(receiver operating characteristic,ROC)曲线,并计算相应ROC曲线的曲线下面积(area under curve, AUC)及一致性指数(concordance index,C-index),用于评估各个模型预测LTPFS的准确度。C-index越大,模型的准确度越高(0.7~0.8表示可接受,0.8~0.9表示优秀,0.9~1.0表示杰出)。计算布里尔分数(Brier score)来评估预测概率与真实结果的差异。Brier score越低,表明概率预测的准确度越高。 1.7 统计学处理 采用SPSS 26.0软件和R语言(6.2.0)对数据进行统计分析。连续性变量使用M(Q1,Q3)表示,采用Man-Whitney U 检验;分类变量使用 n (%)表示,采用 χ 2 或Fisher检验;利用Kaplan-Meier法绘制生存曲线。LASSO回归是基于Python程序包scikit-survival运算的。R语言程序包Hmisc和compareC用于计算和比较各个模型的C-index。R语言程序包survivalROC用于绘制时间依赖性ROC曲线及计算时间依赖性AUC。此外,本研究还使用了rms、SimpleITK、PyTorch、scikit-learn、numpy、scipy、lifelines(0.25.10)等公开计算包。所有检验均为双侧检验, P <0.05为差异有统计学意义。医学图像处理和评估均在Python 3.6软件上进行。 2 结 果 2.1 患者及病灶特征与数据划分 本研究从1 225例接受RFA的肺肿瘤病例中最终筛选出伴有401个肺转移病灶的172例CRC患者。所有肺转移瘤经过RFA治疗后,最终发生LTP的病灶有102个(25.4%),CR的病灶有299个(74.6%)。对于肺部多发转移瘤,我们将单独分析每个病灶 [23]。按照4∶1的比例随机分配,323个病灶用于构建训练和验证数据集,剩余78个病灶用于构建独立的测试数据集(图2)。 CRC肺转移患者及病灶特征见表1,超半数(268,66.8%)的肺转移灶来源于直肠,且患者平均年龄在55岁以上,男性多见(230,57.4%)。近一半(191,47.6%)的病灶小于10 mm,并且大部分(333,83.0%)的病灶不靠近纵隔或大血管,但是靠近胸膜或膈肌(243,60.6%)。RFA术大多选择了多针伸展型单极射频电极(377, 94.0%),术中肺泡内渗血(108,26.9%)和气胸(101,25.2%)的发生率相对较低,且症状轻微。所有患者的中位随访时间为21个月(95% CI:19.466~22.534),RFA术后的1、2和3年的LTPFS率分别为76.5%(95% CI:72.0~80.4)、 72.1%(95% CI:66.6~76.9)和69.9%(95% CI:64.0~75.1),Kaplan-Meier曲线见图3。 单因素COX回归分析结果显示,CEA、CA19-9、肺转移灶部位(右肺下叶)和消融探针类型均与预后相关( P<0.1,表2)。多因素回归分析结果显示,CEA升高[风险比(hazard ratio,HR)=1.052,P=0.001]、CA19-9升高(HR=1.047, P=0.019)、肺转移灶部位[包括右肺下叶(HR=3.055, P=0.001)、左肺下叶(HR=2.236, P=0.012)]和爪型消融探针(HR=2.171, P=0.013)是病灶复发的独立危险因素(表2),Kaplan-Meier曲线显示,这4个独立危险因素能够将所有患者进行分层( P<0.01,图4)。因此,用这4个独立预后因素构建临床模型。 图2 患者入组流程图 Fig. 2 Flow diagram of the enrolment patients 图3 CRC肺转移患者RFA术后LTPFS的Kaplan-Meier曲线 Fig. 3 Kaplan-Meier curve of LTPFS after RFA in CRC patients with lung metastases A: Kaplan-Meier curve of tumor recurrence after RFA in all patients; B: Kaplan-Meier curves of tumor recurrence after RFA in patients in the training and test datasets. 图4 根据独立危险因素分层的Kaplan-Meier曲线 Fig. 4 Kaplan-Meier curves according to independent risk factors A: The risk stratification curves of CEA (optimal cutoff value was 6.28 ng/mL); B: The risk stratification curves of CA19-9 (optimal cutoff value was 74.72 U/mL); C: The risk stratification curves of ablation probe type; D: The risk stratification curves of position of lung metastases. 2.2 影像组学特征筛选 在勾画ROI方面,组间和组内ICC分别为0.891(95% CI:0.857~0.923)和0.874(95% CI:0.831~0.912),表现出良好的一致性。为了防止模型出现过拟合情况,本研究先采用MRMRA方法根据重要性评分筛选出24个影像组学特征,再使用LASSO回归模型进一步筛选,最终确定了12个影像组学特征(表3,图5),用于构建影像组学模型。 图5 LASSO回归筛选影像组学特征 Fig. 5 Radiomics features screened by LASSO regression A: The coefficient of radiomic features changes with α. B: The C-index of the model changes with α, and the yellow line represents the α value corresponding to the highest value of the C-index in the cross-validation results. C: The correlation coefficient of radiomic features screened by LASSO regression. The prefix “before_”: The radiomic features of the preoperative CT images of RFA; The prefix “sp_”: The radiomics features of the CT images immediately after RFA. 2.3 预测模型与诺模图的构建和评估 本研究共构建3个模型来预测1、2和3年的LTPFS率。 临床模型:以肿瘤标志物(CEA和CA19-9)、肺转移瘤部位和消融探针类型构建临床模型。 影像组学模型:以LASSO回归模型最终筛选出的12个影像组学特征构建影像组学模型。 融合模型:将以上临床模型的临床变量和影像组学模型的特征通过后融合构建融合模型。 3个模型的预测性能评估见表4和图6。数据显示,在训练集和测试集中,融合模型的AUC最高,其中预测1和3年的LTPFS率显著优于临床模型( P<0.05),C-index分别为0.890 (95% CI:0.854~0.927)和0.843(95% CI:0.768~0.916),均高于单一的影像组学模型(训练集: P=0.012;测试集: P=0.061)和临床模型(训练集: P<0.001;测试集: P=0.024)。此外,融合模型在测试集中的1和3年的Brier score均小于其他两个模型且小于0.2,2年的Brier score接近0.2且略大于临床模型,说明融合模型拥有良好的校准度。因此,综合考虑模型的区分度和校准度,融合模型具有最佳的预后预测表现,本研究构建了融合模型相应的诺模图,如图7所示。 图6 各模型预测LTPFS的ROC曲线图及AUC Fig. 6 ROC curves and AUC of each model for predicting LTPFS The ROC curves of each model predicted 1-year, 2-year, and 3-year LTPFS rates in the training set (A, C, E) and the test set (B, D, F), respectively. All: Fusion model; Omics: Radiomics model; Clinical: Clinical model. 图7 基于临床变量和影像组学特征构建的诺模图 Fig. 7 Nomogram based on clinical variables and radiomics features 3 讨 论 欧洲肿瘤内科学会(European Society for Medical Oncology,ESMO)重点强调了CRC寡转移局部消融治疗的临床价值 [9]。RFA治疗在众多热消融技术中临床应用范围最广、时间最长,且已被证实在治疗CRC肺转移方面安全有效 [24]。作为手术切除的替代治疗,RFA可以凭借微创、可重复操作、并发症轻微且少的优势延长寡转移患者的生存期 [7]。有研究 [25]表明, CRC肺转移患者经RFA治疗后的中位OS为62个月,4年的LTPFS率为44%,与手术切除的患者相 似。 肺部肿瘤经过消融治疗后会出现自然演变的转归过程:在早期(1周以内),消融区域会因为肿瘤凝固性坏死以及周围组织的充血、渗出等炎症反应变化表现为比病灶范围大,且内部呈现蜂窝状磨玻璃影;在中期(1周~2个月),消融区域变大,病灶周边炎症吸收而出现强化环;在晚期(2个月后),消融区域保持相对稳定或稍大,6个月后逐渐缩小或稳定,并出现多种表现形式(如消失、纤维化、结节及空洞等) [15, 26]。因此,若等待病灶稳定后再评估疗效可能会导致患者错失最佳补充治疗的机会,从而影响其生存获益。 影像组学能够以非侵袭性方式从医学图像中捕捉肿瘤内部可能与生存预后相关的信息 [23],从而实现个体化医疗的目标。虽然已有研究 [27]证实,影像组学可用于预测多种恶性肿瘤手术切除后的复发情况,但消融治疗是将肿瘤在原位灭活,其复发方式及概率与外科手术切除不同。目前临床上应用影像组学来预测CRC肺转移RFA治疗预后的探索性研究相对较少。与OS相比,LTPFS可以避免过长时间的随访,从而能够及早地为患者调整治疗方案。因此,本研究尝试利用影像组学特征联合临床相关因素构建预测CRC肺转移瘤RFA治疗后LTPFS的融合模型。 由于恶性肿瘤的复杂性以及在生物学过程中涉及到多种成分的相互作用,使用单一的高危因素很难进行预后评估。因此,本研究除了纳入主要的预后因素(病灶大小、病灶与血管的距离关系、消融探针特点及消融范围) [28-29]外,还综合了原发肿瘤部位、初诊时淋巴结转移情况、同期是否行系统治疗及术前肿瘤标志物等潜在临床变量。与既往研究 [2]数据一致,本研究有66.8%的肺转移瘤源于直肠癌。CRC患者若发生淋巴结转移,则会严重影响其生存预后和治疗方案的制定 [30]。对于已经发生肺转移的晚期患者,在接受局部治疗的同时,全身治疗也是必不可少的治疗手段,因此也会潜在影响患者的生存预后。在本研究中,以上因素的差异无统计学意义,可能是样本量不足和数据偏倚所致。此外,有研究 [10]证实,如果病灶靠近大血管导致血流带走部分热量的热沉效应也被认为是复发的高危因素。然而本研究结果显示,病灶与血管相关的变量差异无统计学意义,可能因为对于较小的病灶,热沉效应的影响并非十分明显。在临床实践中,CEA和CA19-9是CRC诊断、复发及生存预后的重要标志物 [31]。本研究结果显示,肺转移瘤的部位是独立危险因素,尤其是两肺下叶的HR均大于2。主要原因考虑是位于肺下叶的病灶更容易受到患者呼吸运动的影响,从而降低操作者穿刺病灶的精准度。此外,多针型消融电极在单因素分析中的HR为0.480,然而在多因素分析中的HR却为2.171,被认定为影响LTPFS的独立危险因素。目前,对于消融针类型的选择尚无统一共识,大多取决于临床医师的手术经验和操作习惯。本研究入组的单针型射频电极病例数较少,有待后续更大数据证实不同消融针型对疗效及预后的影响。最终,多因素分析显示,CEA、CA19-9、肺转移瘤部位(两肺下叶)和消融电极类型被证实是重要的预后因素,与既往研究 [31]结果一致。所有患者的中位随访时间为21个月,最终发生复发的病灶是102例,复发率为25.4%(102/401)。RFA术后的1、2和3年的LTP数分别为92、99和102,表明大部分病例是在1年内发生复发,与之对应的LTPFS率分别为76.5%(95% CI:72.0~80.4)、72.1%(95% CI:66.6~76.9)和69.9%(95% CI:64.0~75.1)。 在影像组学特征方面,本研究不仅提取RFA术前CT图像中病灶的特征,还提取了RFA术后即刻CT图像消融区域中包含潜在预后信息的特征,充分挖掘和整合同一靶区不同时期的影像组学特征。通过MRMRA和LASSO回归模型筛选后,最终选取了9个术前特征[包含3个直方图特征(firstOrder_Energy、firstOrder_Entropy和firstOrder_MeanAbsoluteDeviation)和6个纹理特征(3个GLCM、2个GLDM和1个GLSZM)]及3个术后纹理特征(1个GLCM、1个GLDM和1个NGTDM)。一阶直方图特征是描述图像区域内的体素强度分布,如Energy是衡量体素值的大小;Entropy,即熵,是图像值中的不确定性或随机性,从而测量编码图像值所需的平均信息量。在纹理特征中,GLCM是二阶灰度直方图,研究图像中一定距离和方向的两点灰度之间的空间相关特性,从而反映图像的方向、间隔、变化幅度及快慢等纹理信息。GLDM反映了中心像素或体素与其邻域之间的灰度关系,GLSZM提供了关于相同灰度级的互连相邻像素或体素的空间分布信息,NGTDM的粗糙性反映了中心像素或体素与其邻域之间的灰度差异,从而捕捉灰度强度变化的空间速率。 有研究 [32]利用CT的影像组学特征回顾性分析肺部肿瘤微波消融后瘤内密度异质性的瞬时变化,并预测治疗反应和LTP。然而,该研究仅包含了39例原发性肺癌和11例转移性肺癌,不能保证足够的样本量和疾病的同质性。因此,本研究利用临床变量和影像组学特征,构建并对比了3个预测LTPFS的预测模型:临床模型、影像组学模型和融合模型。通过ROC曲线可以看出,融合模型的预测性能(训练集:C-index=0.890;测试集:C-index=0.843)比单一的影像组学模型(训练集:C-index=0.867;测试集:C-index=0.811)和临床模型(训练集:C-index=0.665;测试集:C-index=0.688)更好。此外,融合模型的Brier score更小,显示其良好的校准度。所以,本研究结果不仅充分证实了预后分子标志物与临床危险因素可以预测预后,影像组学特征还可以进一步提高预测性能。 本研究也存在局限性。首先,由于严格的影像学随访排除标准,样本量相对较少,这可能会直接影响模型的预测性能。其次,本研究是单中心回顾性研究,因此无法避免会存在数据偏倚。因此,有待于后期多中心的大样本数据来避免偏倚并验证结果。 综上所述,影像组学特征可以作为CRC肺转移患者接受RFA治疗后预测LTPFS的影像标志物,体现其对临床危险因素的递增补充价值。可视化的诺模图可以更直观、客观和精准地预测肺消融术后的预后情况,从而指导临床医师为患者制订个体化的术后随访诊疗方案。 利益冲突声明:所有作者均声明不存在利益冲突。 作者贡献声明: 黄浩哲:设计研究方案,实施研究过程,收集和分析数据,起草并修订文章; 陈红:研究方案可行性调查分析,确定研究对象范围,参与撰写和修订文章; 郑德重:影像组学相关数据处理和模型构建; 王耀辉,许立超,何新红:临床手术操作; 陈超,王英:数据收集; 李文涛,杨媛媛:提出研究方向,设计文章框架,审核文章,文章最终版本修订。 [参考文献]




本文责任编辑:李广涛
链接:http://www.lewenyixue.com/2024/10/31/%E3%80%90%E8%AE%BA%E8%91%97%E3%80%91%7C%20%E5%9F%BA%E4%BA%8ECT%E7%9A%84%E5%BD%B1%E5%83%8F%E7%BB%84%E5%AD%A6%E8%AF%BA%E6%A8%A1%E5%9B%BE%E9%A2%84%E6%B5%8B/

