【Lancet子刊】瑞金医院刘炳亚团队发现SLC7A9抑制剂如何精准打击胃癌,开辟化疗新天地
【导读】SLC7A9负责二元氨基酸和胱氨酸(内流)与中性氨基酸(外排)的交换。胱氨酸/半胱氨酸转运与铁死亡有关。
2024年10月21日,上海交通大学医学院附属瑞金医院刘炳亚团队在期刊《eBioMedicine》上发表了题为“SLC7A9 suppression increases chemosensitivity by inducing ferroptosis via the inhibition of cystine transport in gastric cancer”的研究论文。研究结果表明, SLC7A9作为铁死亡抑制剂,独立于SLC7A11。因此,针对SLC7A9的治疗干预有望使胃癌细胞对铁死亡和化疗治疗敏感,并最终改善胃癌患者的预后。

https://www.thelancet.com/journals/ebiom/article/PIIS2352-3964(24)00411-0/fulltext
铁死亡与癌症
01
SLC7A11在铁死亡和癌症发展中起着关键作用。许多研究都集中在SLC7A9与慢性肾病之间的关系上,已发现SLC7A9突变可导致各种类型的胱氨酸尿症。此外,研究人员已经确定了SLC7A9表达水平与细胞内GSH水平之间的关系。这些发现表明,SLC7A9可能在铁死亡的调节中发挥作用。在团队之前对胃癌的差异调节网络(DRN)分析中,SLC7A9被确定为胃癌与癌旁组织之间最重要的差异调节基因(DRG)。
在这项研究中,团队证明SLC7A9表达在TP53缺陷型胃癌中上调,并且,SLC7A9的上调通过抑制铁死亡诱导化疗耐药,与SLC7A1无关, 表明SLC7A9充当铁死亡抑制因子。
SLC7A9抑制铁死亡并在PDO和PDX模型中,抵抗erastin的作用
02
PDO模型是使用胃癌组织建立的。为了进一步证实SLC7A9在人胃癌中的致癌作用,团队用erastin处理细胞并评估类器官的生长。PDO的生长速率表明,erastin抑制P2类器官(低SLC7A9表达水平)的活力,比P5类器官(高SLC7A9表达水平)更有效;SLC7A9表达水平较高的PDO,显示出更高的IC50erastin的值。erastin比P5/shNC类器官更有效地抑制P5/shSLC7A9类器官的活力,而erastin的抗肿瘤作用在P2/oeSLC7A9类器官中减弱。
团队发现,SLC7A9敲低或erastin治疗抑制肿瘤生长,双重治疗显示出最大的治疗效果。IHC分析显示,shSLC7A9和erastin治疗的肿瘤中ki67阳性细胞的数量少于对照肿瘤,ki67阳性细胞在shSLC7A9+erastin治疗的肿瘤中最少。GPX4阳性细胞,表现出与ki67阳性细胞相同的趋势。这些发现证实, SLC7A9驱动铁死亡耐药,SLC7A9敲除使胃癌细胞在体内对铁死亡敏感。
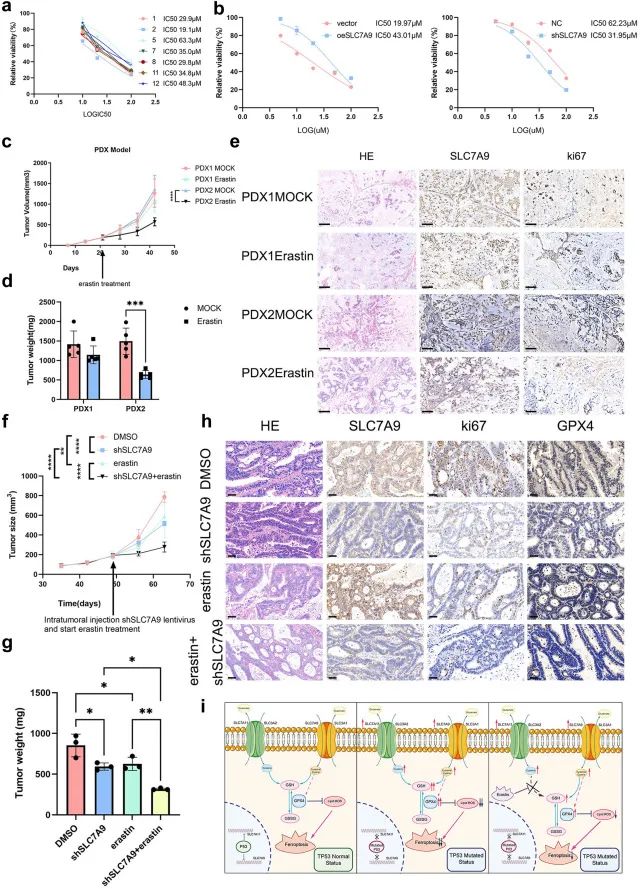
SLC7A9在PDO和PDX模型中逆转了erastin的肿瘤杀伤作用,shSLC7A9在体内使erastin致敏。
总结
03
1. SLC7A9的作用:SLC7A9通过促进胱氨酸的转运,增加GSH的产生,并促进GPX4蛋白的合成,从而抑制脂质过氧化物的积累和铁死亡。
2. SLC7A9与胃癌:SLC7A9的表达水平在TP53突变的胃癌中升高,且p53可以转录抑制SLC7A9。SLC7A9在胃癌中的作用,可能比SLC7A11更重要。
3. 铁死亡与化疗耐药性:铁死亡有助于癌细胞克服对化疗的耐药性,并可能逆转对放疗、免疫疗法和靶向治疗的耐药性。
4. SLC7A9作为治疗靶点:SLC7A9的表达介导了细胞对化疗的耐药性,敲低SLC7A9可以使胃癌细胞对化疗药物敏感。
5. 研究的未来方向:未来的研究方向包括设计siRNA药物和探索靶向SLC7A9的化合物。
参考资料:
1.Sung, H. ∙ Ferlay, J. ∙ Siegel, R.L. ∙ et al.
Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries
CA Cancer J Clin. 2021; 71:209-249
2.Joshi, S.S. ∙ Badgwell, B.D.
Current treatment and recent progress in gastric cancer
CA A Cancer J Clin. 2021; 71:264-279
链接:http://www.lewenyixue.com/2024/10/25/%E3%80%90Lancet%E5%AD%90%E5%88%8A%E3%80%91%E7%91%9E%E9%87%91%E5%8C%BB%E9%99%A2%E5%88%98%E7%82%B3%E4%BA%9A%E5%9B%A2%E9%98%9F%E5%8F%91/