【CTM】北京大学发文:胃癌治疗的有效靶点

【导读】 胃癌患者伴有腹膜转移(GCPM)的临床病程迅速恶化,表现为治疗抵抗和生存率极低,尤其是在恶性腹水出现后。然而,在治疗过程中腹膜微环境(PME)内部的复杂动态仍鲜为人知。
10月18日,北京大学研究团队在期刊《Clinical And Translational Medicine》上发表了题为“Single-cell characterization of differentiation trajectories and drug resistance features in gastric cancer with peritoneal metastasis”的研究论文,本研究中,研究人员追踪上皮细胞的进化轨迹揭示了具有高度上皮-间质转化潜力的终末分化的MUC1+癌细胞,它们与成纤维细胞和内皮细胞表现出空间邻近关系,与不良预后相关。与PT和PM相比,ASC中观察到了显著增多的具有最高促血管生成活性的巨噬细胞浸润。此外,在治疗失败病例中,研究人员观察到了与显著较低的GZMA+T淋巴细胞浸润相关的更高比例的C1Q+巨噬细胞浸润,这可能通过LGALS9-CD45和SPP1-CD44配体-受体相互作用介导。在化疗耐药组中,研究人员观察到了通过补体激活途径的C1Q+巨噬细胞与成纤维细胞的密切相互作用。在表现出免疫耐受的组中,检测到了MUC1+癌细胞中增强的TGF-β产生活性,它们通过GDF15-TGF-βR2轴倾向于与C1Q+巨噬细胞相互作用。最终的分析表明,对于在诊断时就患有GCPM的患者来说,同时靶向TGF-β和PDL1途径可能比单纯使用抗PD-1/PD-L1疗法带来更优越的临床益处。 本研究阐明了PME细胞的分化轨迹和关键的耐药特征,这有助于探索有效的GCPM治疗靶点。

https://onlinelibrary.wiley.com/doi/full/10.1002/ctm2.70054
背景信息
01
据全球癌症统计数据,胃癌(GC)在所有癌症的发病率和死亡率中均排名第五,在东亚地区疾病负担严重。令人担忧的是,大约有17%的GC患者在初次评估时会出现胃癌腹膜转移(GCPM)。此外,GCPM患者的预后仍然不容乐观,即使在最佳支持性治疗的情况下,其总体生存期也只有7个月。尽管在晚期GC治疗方面出现了创新疗法,如免疫检查点抑制剂(ICIs),但GCPM病例的治疗效果仍然受到很大限制。
深入探究GCPM临床进程恶化的根本原因,对相关机制的有限理解成为获得更好治疗方案的障碍。因此,全面调查GCPM的发病和发展有助于揭示调控途径并识别针对该疾病的新型有效治疗靶点。
在原发肿瘤(PT)的腹膜转移过程中,GC细胞必须在穿透胃壁后进入腹膜腔,并在腹膜上建立肿瘤病灶。腹膜微环境(PME)极为复杂,由多种类型的癌细胞和免疫细胞组成,这些细胞会随着GCPM发生动态变化。此外,靶向GCPM的治疗干预可能会驱动PME中细胞的进化适应,进而影响治疗效果。一些近期的研究揭示了腹膜转移的组织内异质性和细胞谱系的多样性。例如,研究人员报告了两种腹膜转移病灶的分子亚型,包括上皮样和间质样组。后者显示了更高的耗竭T淋巴细胞浸润和更高的TIM-3和甘露糖结合蛋白-9表达,这表明免疫治疗可能具有潜在的益处。此外,研究人员还研究了GCPM期间PME的异质性,观察了治疗干预下的细胞重构。然而,已有治疗信息的腹水样本数量有限(n=5),且样本不匹配。因此,不同GCPM相关组织间的动态异质性变化,以及由治疗驱动的多种细胞类型演变所带来的谜团,仍然没有得到解决。
治疗耐药型病例的PME特征
02
研究人员专注于基于9对预治疗基线和治疗进展样本的PME重构。观察到治疗进展样本中中性粒细胞显著扩张,而基线腹水样本中未观察到此类扩张。在化疗队列中,观察到癌细胞浸润呈下降趋势,这与治疗驱动的恶性细胞凋亡和坏死相一致,而巨噬细胞的浸润呈上升趋势。免疫治疗后,T淋巴细胞浸润显著扩张,这表明抗肿瘤免疫功能得到恢复。
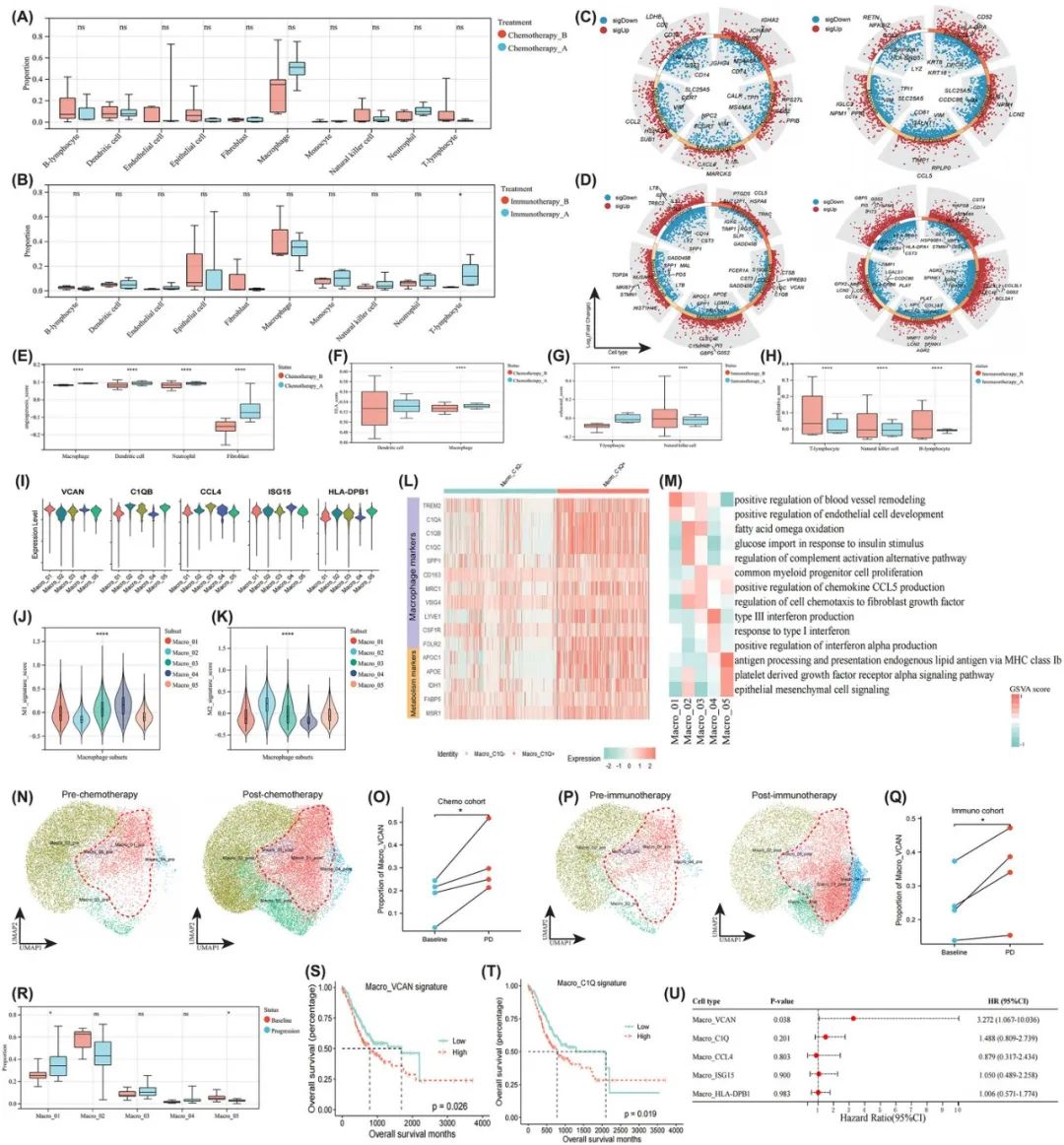
治疗诱导的恶性腹水重构及巨噬细胞亚群分析
接下来,研究人员分析了化疗/免疫治疗后DEGs及其相关通路活性的变化。观察到化疗抵抗组巨噬细胞中CXCL8和IL1B的显著上调以及中性粒细胞中NFKBIZ的上调,这表明髓源性抑制细胞(MDSC)的促炎功能增强。在免疫治疗组中,观察到T淋巴细胞对干扰素γ(IFN-γ)的应答上调。研究人员还评估了不同细胞类型的功能特征,发现进展样本中的MDSC在化疗后表现出更高的促血管生成活性。同时,DC和巨噬细胞的AP功能也增强,这可能归因于化疗诱导的免疫原性细胞死亡。在对免疫治疗抵抗的病例中,研究人员观察到T淋巴细胞的耗竭评分较高,增殖评分较低。在其他免疫效应细胞如NK细胞和B淋巴细胞中也观察到了类似的表型,这表明免疫功能耗竭的状态,治疗失败个体的巨噬细胞、成纤维细胞和中性粒细胞之间通过CCL途径的相互作用明显增强。简而言之,治疗失败是由于MDSCs的促炎/血管生成活性增强和T淋巴细胞耗竭所致。
结论
03
总之,本研究明确了不同GCPM相关组织之间的细胞分化轨迹以及复杂的相互作用网络,并鉴定出与药物耐药相关的关键特征。这些发现有助于探索更有效的GCPM治疗靶点。
【参考资料】
https://onlinelibrary.wiley.com/doi/full/10.1002/ctm2.70054
链接:http://www.lewenyixue.com/2024/10/25/%E3%80%90CTM%E3%80%91%E5%8C%97%E4%BA%AC%E5%A4%A7%E5%AD%A6%E5%8F%91%E6%96%87%EF%BC%9A%E8%83%83%E7%99%8C%E6%B2%BB%E7%96%97%E7%9A%84%E6%9C%89%E6%95%88%E9%9D%B6/