尿路上皮癌 ( UC ) 是一种常见且致命的癌症,具有显著的遗传异质性 【1】 。在癌症发展过程中,突变过程和DNA修复之间不断相互作用,导致产生独特的突变特征和广泛的基因组结构变化。APOBEC3家族的胞嘧啶脱氨酶可在多种人类癌症的基因组中引起胞嘧啶向胸腺嘧啶或鸟嘌呤的替换,形成体细胞突变特征,尤其是在UC中。研究发现,APOBEC3酶家族在多种癌症中引起的突变模式与癌症的进展和耐药性密切相关 【2】 。尽管已有研究探讨了化疗对癌症突变的影响,初步探索了化疗耐药性晚期UC的进化动态 【1】 ,但关于内源性突变压力 (如APOBEC3) 和外源性突变过程 (如化疗) 的相对时序、克隆性及其对UC进化的影响仍存在许多未解之谜;复杂结构变异 (SV) ,包括 染色体外DNA ( ecDNA ) ,如何影响UC的进化和药物抗性也尚未可知。毫无疑问,这些基本问题的回答将有助于对晚期癌症患者的临床发展的预测并预防化疗耐药。
为了解决这些问题,近日,来自美国威尔康奈尔医学院的 Bishoy M. Faltas 团队在 Nature 上在线发表题为 The interplay of mutagenesis and ecDNA shapes urothelial cancer evolution 的文章, 通过全基因组测序(WGS)分析了尿路上皮癌的原发性和转移性肿瘤样本,探讨了APOBEC3和化疗引起的突变特征及其在肿瘤进化中的作用,使用连接平衡分析(JaBbA)工具分析了复杂结构变异,特别是ecDNA的形成,并研究了这些变异如何影响肿瘤对治疗的抗性 。此外,研究人员还利用长读长测序技术详细绘制了ecDNA的环形结构,并在实验模型中 证实了CCND1 ecDNA在促进治疗抗性中的优势 。这些发现 揭示了驱动尿路上皮癌进化的新机制,为开发新疗法提供了潜在靶点,具有重要的治疗意义。
本文研究人员首先通过WGS分析了77个UC肿瘤样本,包括28个铂类化疗前和49个化疗后的样本,发现APOBEC3胞苷脱氨酶是UC中主要的突变酶,其引起的单碱基替换 (SBS2和SBS13) 以及双碱基替换 (DBS11) 在所有突变中占有显著比例。此外,与铂类化疗相关的SBS31、SBS35和DBS5突变特征在化疗后的肿瘤样本中也有贡献。通过构建系统发育树,研究人员确定了APOBEC3引起的突变主要发生在肿瘤早期,并且具有克隆性,而化疗引起的突变则更多出现在晚期,且为亚克隆性。APOBEC3引起的突变与化疗引起的突变在时间上有明显的先后顺序,APOBEC3突变较早,化疗突变较晚 (图1) 。此外,化疗引起的突变速率高于APOBEC3,这表明化疗不仅是治疗手段,也是癌症进化的驱动力。研究还发现,APOBEC3引起的突变在正常尿路上皮和肿瘤之间共享,这强调了APOBEC3在UC早期发生和发展中的作用。这些结果表明早期由APOBEC3酶引起的突变推动了UC的发生,同时显示了早期克隆性的APOBEC3引起的突变与晚期亚克隆性的化疗引起的突变之间的相互作用,这两种突变共同塑造了癌症的转移性和治疗抗性表型,提示APOBEC3和化疗引起的突变在UC的发展和对治疗的抵抗性中扮演了关键角色。
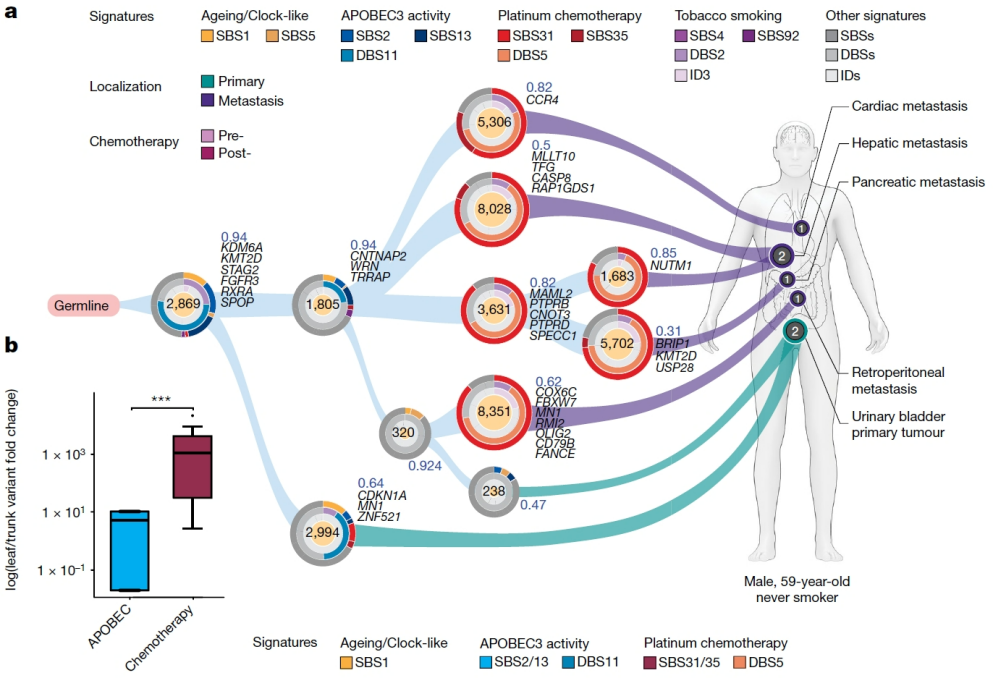 基因组不稳定性来自突变和复杂的大规模染色体变异之间的相互作用,为了研究这些过程,研究人员使用连接平衡分析 (JaBbA) 工具对威尔康奈尔医学院(WCM)-UC队列中的高阶SV进行了全面分析。研究结果发现大多数样本中存在多个复杂SV,其中模板插入链 (TIC) 、染色体碎裂 (chromoplexy) 和断裂-融合-桥接 (BFB) 事件最为常见。此外,研究还观察到与TP53基因突变相关的样本在基因组改变、总连接点数量和特定SV类别方面有显著增加,暗示了基因组稳定性基因突变在复杂SV形成中的重要性。癌细胞ecDNA是扩增癌基因的兆碱基规模的环状DNA亚类,研究人员进一步专注于检测形成ecDNA的SV的两个定义特征:高拷贝数的扩增子和环状结构。结果发现约35%的样本中含有可能生成ecDNA的SV事件,这突出了它们在UC中的高发病率,提示这些ecDNA形成事件可能在癌症的进化和治疗抗性中起着关键作用。与此同时,研究人员发现APOBEC3酶和化疗都能在UC中的ecDNA上引起突变。APOBEC3诱导的聚集突变 (kyklonas) 多发生在ecDNA形成早期,且靠近结构变异的断点,暗示其在ecDNA形成中扮演关键角色,APOBEC3诱导的突变和ecDNA的生物发生在空间和时间上是重叠的。相比之下,化疗诱导的突变主要出现在晚期,且变异等位基因频率 (VAF) 较低,表明它们在肿瘤发展中出现较晚。
随后,研究人员探讨了UC中由ecDNA驱动的癌基因扩增现象。利用FishHook工具分析复发性结构变异,研究人员发现其中55%的变异发生在与癌症相关的基因附近,特别是CCND1基因,它在大多数样本中通过ecDNA形成结构变异而扩增。此外,研究人员还观察到,与CCND1扩增相关的肿瘤样本中,CDKN2A基因 (编码抑制CDK4/6的肿瘤抑制因子p16) 的纯合缺失更为常见,提示ecDNA介导的CCND1扩增的UC肿瘤激活了p16–cyclin D1–CDK4/6–RB1通路,促进了细胞周期的进程。与此同时,研究人员分析了在系统治疗下CCND1 ecDNA形成SV的动态变化,结果发现在系统治疗后,UC中CCND1 ecDNA形成的结构变异事件变得更加复杂,拷贝数增加,提示ecDNA在选择性治疗压力下可能作为适应性储备,促进了耐药性的产生。进一步地,通过高级的ONT (Oxford Nanopore Technologies) 长读长全基因组测序技术,研究人员详细描绘了UC中CCND1基因所在的ecDNA形成结构变异的环形结构,发现每个ecDNA扩增子在结构上都是独特的,并且会获取不同癌基因的启动子、增强子和超级增强子。这些ecDNA扩增子通常包含癌基因FGF3、FGF4和FGF19的扩增,并保留了CCND1局部启动子和调控元件。
最后,研究人员通过实验模型,利用非整合性慢病毒载体在膀胱癌细胞中模拟了CCND1 ecDNA,并在顺铂化疗下进行了竞争实验,发现携带CCND1 ecDNA的细胞显示出更高的适应性。单细胞RNA测序分析揭示了这些细胞中E2F信号通路和其他与化疗抗性相关的通路的激活。此外,通过敲低依赖CCND1 ecDNA的癌细胞中的CCND1,研究人员观察到细胞适应性的降低。这些结果表明CCND1 ecDNA的获得显著增强了肿瘤细胞对化疗的适应性。
综上所述,本研究对晚期UC患者的不同解剖区域和连续时间点收集的配对样本进行了WGS,分析揭示了两种关键致突变因素——APOBEC3胞嘧啶脱氨酶和基于铂的化疗——在UC进展中的活动时间线,全面绘制了晚期UC中的复杂SV,阐明了驱动UC进化的基本机制,为未来的研究以及开发旨在阻断尿路上皮癌变和治疗抗性的创新治疗策略带来了希望。
原文链接:https://doi.org/10.1038/s41586-024-07955-3
基因组不稳定性来自突变和复杂的大规模染色体变异之间的相互作用,为了研究这些过程,研究人员使用连接平衡分析 (JaBbA) 工具对威尔康奈尔医学院(WCM)-UC队列中的高阶SV进行了全面分析。研究结果发现大多数样本中存在多个复杂SV,其中模板插入链 (TIC) 、染色体碎裂 (chromoplexy) 和断裂-融合-桥接 (BFB) 事件最为常见。此外,研究还观察到与TP53基因突变相关的样本在基因组改变、总连接点数量和特定SV类别方面有显著增加,暗示了基因组稳定性基因突变在复杂SV形成中的重要性。癌细胞ecDNA是扩增癌基因的兆碱基规模的环状DNA亚类,研究人员进一步专注于检测形成ecDNA的SV的两个定义特征:高拷贝数的扩增子和环状结构。结果发现约35%的样本中含有可能生成ecDNA的SV事件,这突出了它们在UC中的高发病率,提示这些ecDNA形成事件可能在癌症的进化和治疗抗性中起着关键作用。与此同时,研究人员发现APOBEC3酶和化疗都能在UC中的ecDNA上引起突变。APOBEC3诱导的聚集突变 (kyklonas) 多发生在ecDNA形成早期,且靠近结构变异的断点,暗示其在ecDNA形成中扮演关键角色,APOBEC3诱导的突变和ecDNA的生物发生在空间和时间上是重叠的。相比之下,化疗诱导的突变主要出现在晚期,且变异等位基因频率 (VAF) 较低,表明它们在肿瘤发展中出现较晚。
随后,研究人员探讨了UC中由ecDNA驱动的癌基因扩增现象。利用FishHook工具分析复发性结构变异,研究人员发现其中55%的变异发生在与癌症相关的基因附近,特别是CCND1基因,它在大多数样本中通过ecDNA形成结构变异而扩增。此外,研究人员还观察到,与CCND1扩增相关的肿瘤样本中,CDKN2A基因 (编码抑制CDK4/6的肿瘤抑制因子p16) 的纯合缺失更为常见,提示ecDNA介导的CCND1扩增的UC肿瘤激活了p16–cyclin D1–CDK4/6–RB1通路,促进了细胞周期的进程。与此同时,研究人员分析了在系统治疗下CCND1 ecDNA形成SV的动态变化,结果发现在系统治疗后,UC中CCND1 ecDNA形成的结构变异事件变得更加复杂,拷贝数增加,提示ecDNA在选择性治疗压力下可能作为适应性储备,促进了耐药性的产生。进一步地,通过高级的ONT (Oxford Nanopore Technologies) 长读长全基因组测序技术,研究人员详细描绘了UC中CCND1基因所在的ecDNA形成结构变异的环形结构,发现每个ecDNA扩增子在结构上都是独特的,并且会获取不同癌基因的启动子、增强子和超级增强子。这些ecDNA扩增子通常包含癌基因FGF3、FGF4和FGF19的扩增,并保留了CCND1局部启动子和调控元件。
最后,研究人员通过实验模型,利用非整合性慢病毒载体在膀胱癌细胞中模拟了CCND1 ecDNA,并在顺铂化疗下进行了竞争实验,发现携带CCND1 ecDNA的细胞显示出更高的适应性。单细胞RNA测序分析揭示了这些细胞中E2F信号通路和其他与化疗抗性相关的通路的激活。此外,通过敲低依赖CCND1 ecDNA的癌细胞中的CCND1,研究人员观察到细胞适应性的降低。这些结果表明CCND1 ecDNA的获得显著增强了肿瘤细胞对化疗的适应性。
综上所述,本研究对晚期UC患者的不同解剖区域和连续时间点收集的配对样本进行了WGS,分析揭示了两种关键致突变因素——APOBEC3胞嘧啶脱氨酶和基于铂的化疗——在UC进展中的活动时间线,全面绘制了晚期UC中的复杂SV,阐明了驱动UC进化的基本机制,为未来的研究以及开发旨在阻断尿路上皮癌变和治疗抗性的创新治疗策略带来了希望。
原文链接:https://doi.org/10.1038/s41586-024-07955-3
制版人:十一
1. Faltas, B. M. et al. Clonal evolution of chemotherapy-resistant urothelial carcinoma. Nat. Genet . 48, 1490–1499 (2016).
2. Swanton, C., McGranahan, N., Starrett, G. J. & Harris, R. S. APOBEC enzymes: mutagenic fuel for cancer evolution and heterogeneity. Cancer Discov. 5, 704–712 (2015).
版权声明:本文为“乐问号”作者或机构在乐问医学上传并发布,仅代表该作者或机构观点,不代表乐问医学的观点或立场,不能作为个体诊疗依据,如有不适,请结合自身情况寻求医生的针对性治疗。
链接:http://www.lewenyixue.com/2024/10/24/Nature%20%7C%20%E5%B0%BF%E8%B7%AF%E4%B8%8A%E7%9A%AE%E7%99%8C%E8%BF%9B%E5%8C%96%E7%9A%84%E5%9F%BA%E5%9B%A0%E5%AF%86/

