肉瘤是一类罕见的异质性间质肿瘤 【1】 。它们主要发生在骨骼和软组织中,对年轻患者的影响尤为严重 【1-3 】 。在美国,每年大约会诊断出13000例软组织肉瘤和4000例骨肉瘤,尽管发病率很低,但死亡率仍然很高。例如,骨肉瘤是导致20岁以下患者癌症死亡的第三大原因 【3】 。治疗方案因疾病亚型和分期而异,包括手术切除、化疗、靶向全身治疗和某些情况下的放射治疗 【4,5】 。尽管在特定亚型上取得了重大进展,但以目前的治疗方法来看,很少能治愈,软组织肉瘤的总体5年生存率为65%,骨癌的总体5年生存率为50%-60% 【6】 。
肉瘤的异质性表现为100多种不同的亚型,因而肉瘤的诊断也同样存在多样性:例如,据报道有9种不同的骨肉瘤亚型 【7】 。大约四分之一的肉瘤病例是由特定的染色体融合引起的,如尤文氏肉瘤、滑膜肉瘤、婴儿纤维肉瘤和横纹肌肉瘤(RMS)。其他骨和软组织肉瘤的遗传学诱因还包括影响细胞周期调节、生长因子信号传导和血管生成。特异性高患病率突变包括上皮样肉瘤中的RTK驱动突变,脂肪肉瘤中的CDK畸变,血管周细胞瘤 (PEComa) 和黏液样脂肪肉瘤中的PI3K突变等。其他类型的肿瘤,如骨肉瘤和未分化肉瘤,则是复杂的核型肿瘤,可以携带多种突变,没有单一的、明确的驱动因素。这种巨大的异质性加大了为这类罕见和超罕见癌症确定有效治疗方案的难度,并导致了持续的低生存率。
精准医学方法作为识别可操作特征和改善每位患者预后的工具,正越来越受学界重视。新一代测序(NGS)和免疫组织化学等技术被广泛用于识别患者分子水平变化和可成药靶点。在融合阳性肉瘤的情况下,除了NTRK外,大多数异常癌基因不能直接靶向干预。最近一项针对6000多例骨和软组织肉瘤的研究发现,平均42%的肿瘤含有可干预突变。尽管如此,在过去10年的多项临床试验中,很少有肉瘤患者在使用基因组精准医学选择的药物治疗时显示出临床益处。
由于这种遗传多样性以及通过传统或精准医学选择的化疗和靶向药物的疗效有限,迫切需要确定替代方法来系统地评估肉瘤的药物敏感性和耐药性,并确定个性化的治疗方案。
近日,来自美国加州大学洛杉矶分校的 Alice Soragni 研究组在 Cell Stem Cell 上发表题为 The landscape of drug sensitivity and resistance in sarcoma 的文章, 采集120余个患者样本并通过构建肿瘤类器官,来研究了21种肉瘤类型的药物敏感性和耐药性。
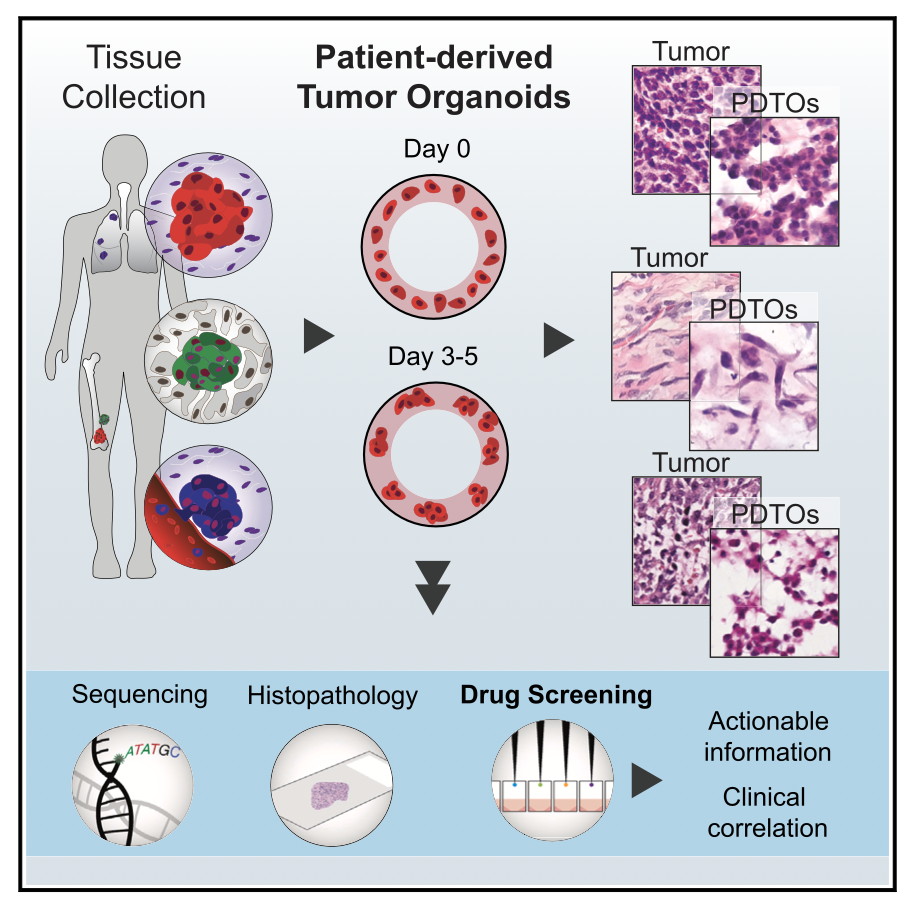
患者源性肿瘤类器官 (Patient-derived tumor organoids,简称 PDTOs ) 可以模拟一系列恶性肿瘤的行为特征。对于各种类型的上皮癌患者来说,PDTOs易于操作,并且可以预测机体响应和药物疗效。但是,目前肉瘤PDTOs发展滞后,应用有限。
作者利用PDTOs来表征肉瘤的耐药性和敏感性。作者从加州大学洛杉矶分校健康医院接受活组织检查或手术切除的126例患者中获取了n= 194个标本,并成功地从来自原发性、复发性和转移性骨和软组织肉瘤的121多个样本中生成PDTOs,涵盖24种不同的肉瘤亚型。
随后,作者采用高通量类器官筛选平台,并联合组织病理学检测,测试了类器官对单一药物和联合药物的敏感性和耐药性,并在手术后一周内获得结果。作者发现,药物敏感性与肿瘤亚型、治疗史、疾病发展轨迹等临床特征相关。PDTO筛查有利于药物最佳选择,并且可以反映肉瘤患者的预后。作者的上述工作可以为59%的样本所对应患者确定至少一种已经FDA批准或NCCN推荐的有效治疗方案,这也表明作者所开发的基于患者类器官的工作平台具有强大的临床潜力。
综上所述, 作者通过PDTOs,在24种肉瘤类型中检测和探讨药物敏感性和耐药模式,并发现患者的亚型特异性反应,与临床特征和预后相关。作者为大多数样本所对应的患者确定了可操作的给药方案,这也强调了类器官在精准医学应用中的巨大潜力。
https://doi.org/10.1016/j.stem.2024.08.010
制版人:十一
1. Mackall, C.L., Meltzer, P.S., and Helman, L.J. (2002). Focus on sar- comas. Cancer Cell 2, 175–178.
2. Miller, R.W., Young, J.L., and Novakovic, B. (1995). Childhood cancer. Cancer 75, 395–405.
3. Siegel, R.L., Miller, K.D., Fuchs, H.E., and Jemal, A. (2022). Cancer statistics, 2022. CA Cancer J. Clin. 72, 7–33.
4. von Mehren, M., Kane, J.M., Agulnik, M., Bui, M.M., Carr-Ascher, J., Choy, E., Connelly, M., Dry, S., Ganjoo, K.N., Gonzalez, R.J., et al. (2022). Soft tissue sarcoma, version 2.2022, NCCN clinical practice guidelines in oncology. J. Natl. Compr. Canc. Netw. 20, 815–833.
5. NCCN (2022). NCCN Guidelines Version 2.2023: Bone Cancer.
https://paulatakacsfoundation.org/wp-content/uploads/2022/11/NCCN- Guidelines-for-Patients.Bone_.2023.pdf.
6. NIH (2020). SEER Cancer Statistics Review (CSR) 1975-2017. https:// seer.cancer.gov/csr/1975_2017/index.html.
7. Rothzerg, E., Xu, J., and Wood, D. (2023). Different Subtypes of Osteosarcoma: Histopathological Patterns and Clinical Behaviour. J. Mol. Pathol. 4, 99 –108.
版权声明:本文为“乐问号”作者或机构在乐问医学上传并发布,仅代表该作者或机构观点,不代表乐问医学的观点或立场,不能作为个体诊疗依据,如有不适,请结合自身情况寻求医生的针对性治疗。
链接:http://www.lewenyixue.com/2024/10/23/Cell%20Stem%20Cell%20%7C%20%E8%82%89%E7%98%A4%E7%9A%84/





 知道|国家药品不良反应监测年度报告(2024年)
知道|国家药品不良反应监测年度报告(2024年)
赶快来坐沙发