【CACA周刊】80期 同卵双生为何不同?2024诺贝尔生理学或医学奖揭秘!
本期看点
序言
“小花和小草是双胞胎姐妹,长得一模一样,但为什么在性格上一个是i人一个是e人?”
有一次朋友问了我一个意味深长的问题。
这个问题的解答涉及遗传学及其分支学科——表观遗传学的系统理论。恰逢2024年诺贝尔奖项揭晓,生理学或医学奖的桂冠落到了Victor Ambros和Gary Ruvkun的头上,表彰二位在microRNA用于基因调控相关研究的突出贡献。
基因调控主要指基于非基因序列改变而导致的基因表达水平变化,即“同一个基因组,不同的细胞命运”。从一个受精卵开始,携带着相同基因组的“细胞们”有序分工,互相协作,各司其职,最终才能组成我们“四大组织、七十八器官、九大系统”的复杂人体。
一旦这种精细的调控失常,就会带来灾难性的后果——人群中常见的糖尿病、自身免疫病、痛风、肿瘤等都和基因调控失常息息相关。
那么,microRNA是如何参与到基因调控中的呢?
1980年,Victor Ambros和Gary Ruvkun开始研究一种模式生物——线虫。
模式生物指有代表性的用于揭示某种生命现象普遍规律研究的生物物种,如豌豆、果蝇、线虫、斑马鱼、小鼠等。
小小秀丽隐杆线虫拥有神经、肌肉等特殊细胞类型,其简单好养的特性使其成为研究多细胞生物组织发育和成熟的优选模型。两位研究者想要通过线虫探究基因为什么会按照一定的时间顺序激活,以及如何确保各种细胞类型在正确的时间发育。
基于以往研究结果,两位研究者构建了lin-4和lin-14两个突变体,这两个突变体的线虫表现出基因激活时间错误。之前的研究结果已经证实lin-4是lin-14的负调节因子,但尚不清楚lin-14的活性是如何被阻断的。
进一步研究的结果令所有人大吃一惊:Victor Ambros发现lin-4的最终产物是一个异常短的RNA分子,只有22个碱基长度,根本不足以编码一个能够抑制lin-14的蛋白质!同时,Ruvkun发现lin-4的mRNA转录仍在正常进行,但后续的蛋白质合成被关闭了。
lin-14被抑制的真相究竟是什么?是不是lin-4通过某种未知的途径实现了对lin-14的抑制?带着这些疑问,两位研究者在深度交流后提出了一个猜想,那就是lin-4产生的小RNA阻止了lin-14产生的mRNA的蛋白质翻译。
最终,两人合作的实验出了结果,lin-4产生的小RNA与lin-14存在互补序列,二者的结合阻断了lin-14蛋白的产生,进而影响了线虫的正常发育。
1993年,这一突破性发现分别刊登在 Cell 的两篇文章中。microRNA的概念横空出世,学界的沉默却“震耳欲聋”。很多科学家认为,该基因调控方式只是秀丽隐杆线虫特有的一种“有趣、偶然”的调控方式,不具有普遍性。但随后2000年Ruvkun组发现的存在于整个动物界且高度保守的let-7彻底征服了那些“挑剔”的生物学家们。
此后,数百上千的microRNA被逐渐发现和鉴定,一个microRNA可以调控多个基因表达,一个基因也可以受到多个microRNA调控。在多细胞生物的复杂生命形式背后存在更加纷繁复杂的调控系统,该精细调控的市场可能会带来严重的“蝴蝶效应”。
目前已有充分证据表明,多种microRNA与人类肿瘤相关。
在某些肿瘤如皮肤T细胞淋巴瘤中,致癌microRNA的异常高表达可通过直接与多个肿瘤抑制基因结合从而下调这些抑癌基因的表达,从而导致肿瘤的发生和发展。一些anti-microRNA药物靶向致癌microRNA如miR-155以抑制肿瘤进展,目前相关药物已进入临床试验阶段并取得了初步的成功。
还有一类microRNA在肿瘤中往往低表达,它们不能有效抑制相关促癌基因表达,与肿瘤的发生和进展存在密切联系。未来如何靶向这些microRNA并恢复其功能仍需进一步探索。目前已知miR-634这一microRNA参与抑制肿瘤生长,但其在肿瘤细胞中的表达受到显著抑制。为此,有研究者将miR-634模拟物(双链miR-634模拟物:ds-miR-634)包装在脂质纳米颗粒(LNP)中,在小鼠模型中取得了较好的抗肿瘤效果。
此外,还有许多microRNA并不直接参与促进或抑制肿瘤的发生和发展,但参与了肿瘤的转移以及肿瘤微环境的改变、肿瘤微血管生成等过程中,其具体的作用机制和临床价值仍需进一步探索。
综合来看,在科研领域起源于microRNA的RNAi技术目前已较为成熟,但从实验室走向临床的转化过程仍是“雄关漫道真如铁”,还得迈步从头越。2024年诺贝尔奖花落microRNA无疑是对该领域的巨大鼓舞,期待未来研究人员开发出更精准、更高效的靶向递送系统,推动肿瘤临床治疗更快地进步。
医术观澜
……
1-
9月17日, Nature Medicine :四川大学附属华西医院李为民教授等开发肺癌风险分层和精确管理系统,由胸部计算机断层扫描中检测到的肺结节数据驱动 [1]。
在肺癌筛查中应用低剂量计算机断层扫描(LDCT)可以增加肺结节检出率。为此,研究团队开发了一个基于45064例患者的数据创建的分类驱动的中国肺结节报告和数据系统(C-Lung-RADS)。
该系统首先根据肺结节的大小和密度区分低、中、高和极高危险性,随后根据影像学信息、人口学特征和随访数据以完善风险评估。该多维度评估系统在内部测试数据集上展现出优异的性能,AUC达0.918(95% CI:0.918~0.919),优于当前的单维方法(AUC为0.881,95% CI:0.880~0.882)。另外,该系统在独立队列中相比Lung-RADS v2022便显出更高的敏感性(87.1% vs 63.3%)。
该系统通过更精确的风险分层和量身定制的管理模式最大限度地减少了低危风险人群不必要的侵入性检查,同时减少了高风险人群诊断延误风险,提高了肺癌诊断效率。
2-
9月18日, The Lancet Respiratory Medicine :中山大学肿瘤防治中心杨弘教授等公布中国可切除非小细胞肺癌患者接受立体定向放疗序贯替雷利珠单抗+化疗新辅助治疗的SACTION01Ⅱ期研究结果 [2]。
免疫联合化疗的新辅助治疗有助于改善NSCLC患者预后。基于放疗可以与免疫治疗相互作用的原理,研究者想要探究立体定向放疗(SBRT)能否增强免疫化疗的效果。
该研究是一项单臂、开放标签、Ⅱ期研究,纳入18岁以上患有可切除ⅡA~ⅢB期NSCLC患者,接受原发肿瘤SBRT(24 Gy分三次)后两个周期的替雷利珠单抗+铂类化疗。新辅助治疗后4~6周进行手术切除。研究主要终点为MPR,定义为残留肿瘤不超过10%。
研究共纳入46例患者,其中76%的患者(95% CI:61~87)观察到MPR,9%的患者因肺炎(n=2)、结肠炎(n=1)和肌酐升高(n=1)而停止第二周期的免疫化疗。与新辅助治疗相关的3级及以上TRAE发生率为26%(95% CI:14~41)。最常见TRAE为脱发(35%),最常见3级及以上TRAE为中性粒细胞减少症(13%),并引起1例治疗相关死亡。
研究认为,术前SBRT后免疫化疗耐受性良好、可行,具有临床意义的MPR率。
高峰科讯
……
1-
9月3日, Advanced Science :复旦大学生命科学学院侯宪玉教授揭示新型Arf1抑制剂驱动肿瘤干细胞衰老并增强抗肿瘤免疫力 [3]。
有证据表明小G蛋白Arf1在支持肿瘤干细胞中发挥选择性作用,但目前现有的Arf1抑制剂具有高毒性和低特异性等缺陷,转化潜力较低。因此,本研究介绍了两种用于肿瘤治疗的新型强效Arf1小分子抑制剂,分别为DU101和DU102。临床前肿瘤模型表明,这两种抑制剂可在肿瘤干细胞中引发级联衰老,并增强抗肿瘤免疫力。
单细胞测序发现,新型Arf1抑制剂诱导了肿瘤免疫微环境重塑,而肿瘤相关的CD8 + CD4 + 双阳性T细胞(DPT)含量增加。DPT细胞表现出更优秀的CD8 + T细胞特性和更高百分比的TCF1 + 和PD-1 + ,这是干细胞样T细胞的特征。DPT细胞的含量与患者更好的DFS结局相关。
该研究表明,这两种新型Arf1抑制剂可以通过将肿瘤微环境由“冷”转“热”从而改善患者预后。
2-
9月10日, Nature Communications :中山大学肿瘤防治中心元云飞、李斌奎教授发现靶向PRMT3会削弱HSP60甲基化和寡聚化,激活cGAS/STING信号转导并增强抗肿瘤免疫 [4]。
免疫检查点阻断(ICB)是HCC更有希望的治疗方案,但患者对ICB可能存在耐药性,且该现象具有较大的个体差异,其背后的机制目前还未完全阐明。
本研究中,研究者揭示了PRMT3是HCC免疫耐药的驱动因素之一。ICB治疗下,T细胞激活了IFNγ-STAT1信号通路,诱导PRMT3表达。升高的PRMT3水平与肿瘤浸润CD8 + T细胞数量减少和治疗反应差相关,敲除PRMT3或使用药物抑制其活性可增加肿瘤中T细胞含量并抑制肿瘤生长。
机制上,PRMT3甲基化HSP60的R446位点,诱导HSP60寡聚化并维持线粒体稳态。靶向抑制PRMT3后线粒体完整性被破坏,线粒体DNA泄露增加,进而激活cGAS/STING抗肿瘤免疫信号通路。小鼠模型证实,阻断PRMT3与PD-1阻断可协同发挥作用。
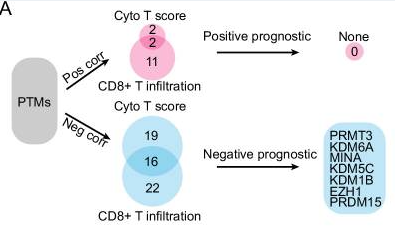
该研究指出,PRMT3是克服HCC免疫治疗耐药的潜在生物标志物和治疗靶点。
3-
9月17日, Advanced Science :中山大学孙逸仙纪念医院宋尔卫院士、罗曼莉教授发现lncRNA FAISL通过抑制钙蛋白酶2介导的FAK蛋白水解促进三阴性乳腺癌进展和转移 [5]。
三阴性乳腺癌是乳腺癌中最具侵袭性的亚型。研究者在TCGA乳腺癌数据集中发现细胞黏附分子相关基因在TNBC样本中高度富集于差异表达基因,其中FAK激酶与TNBC患者生存率存在显著负相关。
研究者发现,FAK相互作用和稳定lncRNA(FAISL)在与FAK相互作用的lncRNA中富集,并常在TCGA中TNBC组织过表达。该lncRNA可促进TNBC细胞黏附、细胞骨架扩散、增殖以及非锚定性存活。FAISL并不影响FAK的mRNA,但通过与FAK的C端结构域相互作用,阻断钙蛋白酶2介导的蛋白水解来增加FAK蛋白浓度。在小鼠模型中使用siRNA靶向FAISL可有效抑制TNBC小鼠模型中肿瘤的生长和转移。
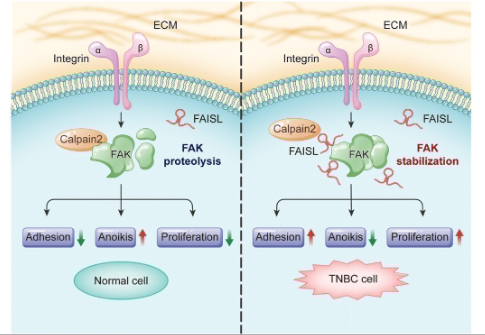
该研究阐明了FAISL促进TNBC发展和转移的机制,证明了靶向FAISL治疗TNBC的潜力。
4-
9月17日, Cell Discovery :复旦大学附属肿瘤医院胡欣教授指出,靶向SNRNP200可诱导RNA剪接失调,为三阴性乳腺癌提供免疫治疗机会 [6] 。
代谢失调在TNBC中常见,但临床缺乏针对代谢失调的治疗策略。
该研究利用TNBC队列(n=465)的多组学数据,证明了在糖酵解TNBC亚型中存在广泛的剪接失调,剪接体丰富增加。SNRNP200是葡萄糖驱动的代谢重编程的关键介质。
机制上,葡萄糖在SNRNP200的K1610位点诱导乙酰化,阻止蛋白酶体降解该蛋白。随后,增加的SNRNP200促进关键代谢酶编码基因(如GAPDH、ALDOA和GSS)的剪接,最终增加了乳酸和谷胱甘肽的产生。使用反义寡核苷酸靶向SNRNP200可阻碍肿瘤代谢,激活瘤内CD8 + T细胞并抑制Treg,进而增强抗PD-1治疗的疗效。
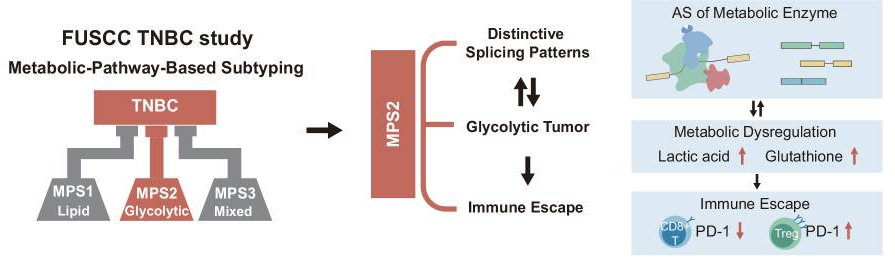
临床上,较高的SNRNP200表达水平与糖酵解TNBC对免疫反应的响应差相关,本研究揭示的TNBC中RNA剪接与代谢失调之间的相互作用为该类型TNBC的免疫联合治疗提供了可行的思路。
5-
9月17日, Nature Cancer :揭示紧密连接蛋白Claudins相关的血管异质性引导器官转移机制 [7]。
肿瘤在转移时有一定的特异性,例如乳腺癌常发生肺转移但很少出现肾转移。
本研究想要探索器官转移特异性背后的机制。为此,研究者使用转移性乳腺癌联合炎症组织纤维化的自发和植入模型、单细胞测序分析和功能研究来揭示器官特异性转移的因果决定因素。
研究发现,血管生成素2(Ang2)介导的非特异性Claudin5抑制促进了乳腺癌细胞肺转移。同时,研究者还发现炎症组织纤维化微环境增强了对Claudin5的抑制,该抑制可以由抗Ang2抗体阻断。和肾转移相关的是非Ang2介导的Claudin2和10,因此乳腺癌少见肾转移。研究者抑制Claudin2和10成功诱导了乳腺癌细胞的肾转移。
该研究指出,器官特异的血管异质性决定了器官特异性转移,与肿瘤细胞内在的机制无关。
6-
9月24日, Molecular Cell :厦门大学张永有教授指出,硫化氢介导的过硫化作用可调控非小细胞肺癌中同型半胱氨酸代谢并增强其铁蛋白沉积功能 [8]。
铁死亡是一种由脂质过氧化引起的独特的细胞死亡形式,虽然控制铁死亡的确切机制尚不清楚,但有研究表明铁死亡与硫化氢有关。
研究者发现,硫化氢使人非小细胞肺癌对铁死亡更加敏感,尤其是在半胱氨酸水平较低时。
机制上,研究表明硫化氢过硫化S-腺苷同型半胱氨酸水解酶(SAHH)第195位的半胱氨酸,降低其酶活性,最终导致同型半胱氨酸水平降低。随后,在半胱氨酸耗竭后,半胱氨酸和谷胱甘肽的浓度下降,从而导致细胞对铁死亡的敏感性增强。
该研究指出,硫化氢是同型半胱氨酸代谢的关键调节因子,也是决定非小细胞肺癌对铁死亡敏感性的关键因素。该研究表明基于硫化氢的疗法在提高铁死亡靶向治疗非小细胞肺癌具有转化潜力。
刊后语
大风泱泱,大潮滂滂;大道如砥,医者无疆。
积跬步以至千里,每一期周刊都是恶性肿瘤学科发展的剪影;积小流以成江海,一年周刊浓缩肿瘤领域各科前沿进展的精华!关注CACA周刊,带你领略恶性肿瘤学科发展的四季花开。
CACA周刊,我们下周不见不散!
编辑 | 李瑞源
排版 | 晓晓
审核 | 李瑞源
链接:http://www.lewenyixue.com/2024/10/23/%E3%80%90CACA%E5%91%A8%E5%88%8A%E3%80%9180%E6%9C%9F%20%E5%90%8C%E5%8D%B5%E5%8F%8C%E7%94%9F%E4%B8%BA%E4%BD%95%E4%B8%8D%E5%90%8C/







赶快来坐沙发