Nature︱细胞内的“搬运工”:揭秘蛋白质定位调控的新策略
蛋白质的亚细胞定位对蛋白质的功能至关重要,因为它们在不同的细胞区域执行特定的生物学功能。例如,某些蛋白质在细胞核内调控基因表达,而另一些则在细胞质中参与信号传导或物质代谢。这种精确的亚细胞定位是通过复杂的蛋白质转运机制实现的,包括核输入和输出、以及细胞器间的蛋白质运输。蛋白质的异常运输和定位往往与多种疾病的发生发展有关,包括癌症、神经退行性疾病和遗传性疾病等 【1,2】 。尽管针对性地调控蛋白质的亚细胞定位为治疗这些疾病提供了新的思路,但如何在不干扰细胞其他正常活动的前提下,高效、特异性地控制蛋白质的精确位置,以及如何将这种调控转化为疾病治疗的有效手段,都是该领域所面临的重大科学问题。
通过将目标蛋白与细胞内的穿梭蛋白或锚蛋白耦合来调节其位置,为可编程分子控制提供了另一种途径。为了推进定位控制的理念,以解决导致疾病的蛋白质问题,需要了解使定位被劫持的细胞特征,以及扩展可行的目标蛋白、分子和调控机制的原理。而对定位重编程能力的定量分析也将极大地促进小分子介导的蛋白质重新定位向治疗疾病的应用的扩展。
近日,来自美国斯坦福大学的 Steven M. Banik 团队在 Nature 上发表题为 Targeted protein relocalization via protein transport coupling 的文章, 利用一种创新的化学生物学工具——靶向重定位激活分子(TRAM),通过结合穿梭蛋白的转运来控制目标蛋白的亚细胞定位。 筛选了一系列具有强效配体的穿梭蛋白,并将其成功用于多种内源蛋白的重新定位。开发了一个定制的成像分析流程,展示了通过分子偶联到含有足够强定位序列的穿梭蛋白,可以调节蛋白质的稳态定位。由此 提出了一种通过蛋白质转运重构细胞互作网络的靶向治疗方法,为治疗疾病提供了新的思路。
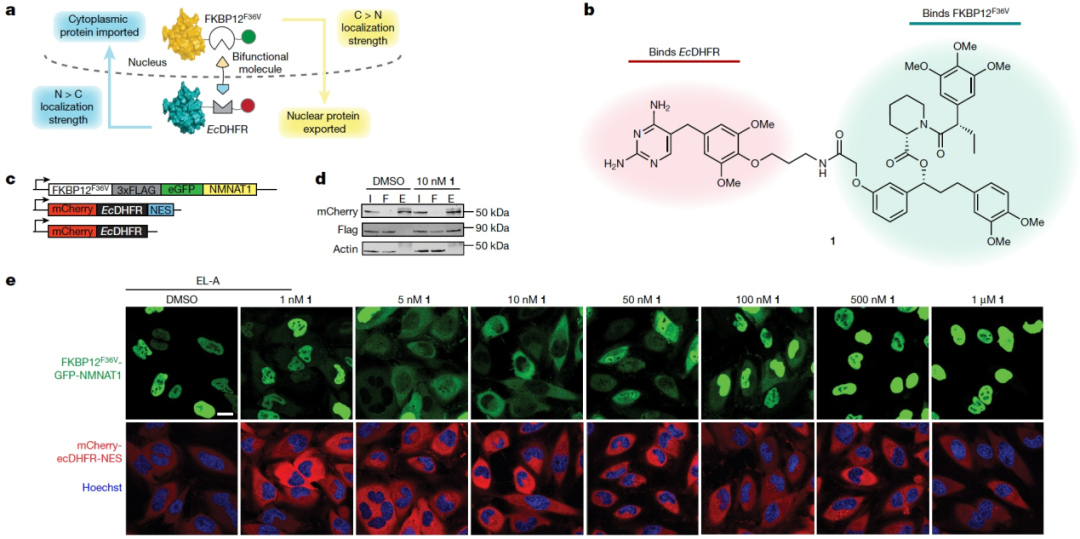
核定位序列 (NLS) 和核输出序列 (NES) 可被karyopherin蛋白家族识别,以调节货物在细胞核和细胞质之间的双向运输。 要通过蛋白质运输耦合的方式来克服蛋白质的固有定位,将需要满足2点:(1)在穿梭蛋白上有一个足够强的相反定位序列;(2)穿梭蛋白的必要化学计量比。为此,本文研究人员首先选择了烟酰胺核苷酸腺苷基转移酶1 (NMNAT1) 作为模型蛋白进行重新定位研究,因为NMNAT1只有一个预测的NLS且没有已知的直接DNA结合域,所以可能容易受到小分子介导的重新定位的影响。为了研究缺乏已知小分子结合位点的蛋白质,研究人员合成了双功能分子TRAM 1,其能够与大肠杆菌二氢叶酸还原酶结构域 (EcDHFR) 和FKBP12F36V结构域结合,这些结构域因其与大多数哺乳动物蛋白的紧密的结合亲和力和正交性而被广泛使用。然后生成了mCherry融合EcDHFR和来自HIV-1 REV蛋白的NES作为穿梭蛋白,并在HeLa细胞中稳定地整合了mCherry-EcDHFR-NES和FKBP12F36V-GFP-NMNAT1。实验证实在TRAM 1的介导下形成了复合物,而且NMNAT1表现出剂量依赖性地向细胞质的转移,且这种效应在更高浓度下被废除 (图1) 。
图1: a. 通过TRAM的蛋白质转运偶联实现亚细胞核质靶向定位控制示意图。 b. TRAM 1的结构。 c .用于产生稳定细胞系以研究NMNAT1定位控制的病毒构建体。 d. TRAM 1介导形成复合物。 e. 由TRAM 1驱动的NMNAT1重定位。
当同时研究两种蛋白质时,核质转运的量化传统上通过一组代表性图像的共定位度量来完成。而一个开源的计算成像分析流程,能够独立地在细胞核和细胞质中对两种不同蛋白质进行单细胞级别的分析,将是衡量蛋白质运输和比较不同目标蛋白与穿梭蛋白的最准确方法。为此,研究人员建立了这样一个定制的计算成像分析流程,展示了蛋白质稳态定位可以通过分子偶联到含有足够强定位序列并在必要丰度中表达的穿梭蛋白来调节。这种方法适用于不同的细胞类型和密度,将定量分析用于检测剂量、穿梭蛋白和化学计量依赖的再定位,实验结果再次证实NES可以通过小分子介导的偶联主动驱动的NMNAT1再分布。与此同时,研究人员发现,必须存在足够水平的锚或穿梭蛋白才能加强TRAM诱导的靶蛋白的再定位。原则上,只要提供合适的定位强度、表达水平和有效的分子偶联,任何蛋白质的运输都可以重新定位另一个蛋白质。核激素受体如雌激素受体 (ERα) 和糖皮质激素受体 (GR) 表现出从细胞质到细胞核的配体依赖性易位,从而发挥下游转录激活作用。研究人员合成了TRAM 4-7,通过实验证实了这些受体作为核穿梭蛋白的潜力。
为了有效地重新定位靶蛋白,TRAM必须与能够克服靶蛋白内在定位的穿梭蛋白充分结合,蛋白质相对再定位能力的量化将有助于合理选择穿梭-靶组合。为了开发一个定量方法来评估通过TRAM介导的蛋白质重新定位的潜力,研究人员建立了含有一系列遗传构建的多克隆细胞系,这些构建将核激素受体 (GR和ERα) 与已知的NES序列配对,以及将HIV-1 REV NES与不同的NLS序列配对。随后,研究人员使用不同浓度的相关TRAM处理这些细胞系,然后评估NES标记的蛋白以及核激素受体的重新定位情况。研究结果表明,目标蛋白的重新定位程度依赖于穿梭蛋白 (ERα或GR) 的特性和目标蛋白的NES序列。此外,研究人员还观察到,不同的NLS构建对HIV-1 REV NES的重新定位能力呈现出梯度变化。通过这些数据,研究人员能够区分不同穿梭蛋白和目标蛋白之间的相对可重新定位性,并为蛋白质对的选择提供了一个定量的评估标准,这对于实现程序化的蛋白质重新定位至关重要。
错位的转录调控蛋白和RNA结合蛋白是多种癌症和神经退行性疾病的特征,将这些蛋白质返回细胞核的靶向方法可能有助于改善疾病驱动表型。本文研究人员利用上述方法,使用核激素受体作为穿梭蛋白,检测了三种已知在疾病中表现出异常定位的突变蛋白——SMARCB1 Q318X (一种SMARCB1蛋白的突变型C末端截短,存在于非典型畸胎样和横纹肌样肿瘤,定位与细胞质) 、TDP43 ΔNLS (缺失了核定位信号的TDP43突变形式,导致它不能正确地定位到细胞核,而是异常地积累在细胞质中,形成病理性的聚集体) 和FUSR 495X (与ALS相关的FUS蛋白的一种突变形式,通常在细胞质中形成应激颗粒,与疾病的发生发展密切相关) ——的重新定位能力。研究结果显示,不同的突变蛋白根据其固有特性,对ERα介导的重新定位的敏感性不同。TDP43 ΔNLS 和FUSR 495X 比SMARCB1 Q318X 更容易被ERα重新定位。此外,研究还发现,FUSR 495X 在应激颗粒中的定位可以通过TRAM的处理而转移到细胞核,并且这种重新定位与应激颗粒数量的减少相关。这些发现表明,通过靶向蛋白质重新定位的方法,有可能改善疾病相关的蛋白错位现象。
与此同时,研究人员探索了利用TRAM实现内源性蛋白质重新定位的能力。他们采用了CRISPR-Cas9基因编辑技术,将结合域和荧光蛋白标签插入到内源性蛋白PRMT9、SOS1和FKBP12上,使用METAP2和PARP1作为内源性细胞质和核的穿梭蛋白,并合成了能够与它们结合的TRAM 11-13。实验结果证明即使在内源性蛋白表达水平下,通过TRAM介导的内源性蛋白重新定位也是可行的,并且整个细胞群体均显示出均匀的重定位效果,这与外源性表达模型通常只在细胞群体的子集中观察到重定位的现象不同。这表明在内源系统中,可以在整个群体中达到穿梭蛋白与靶蛋白的最低相对比例要求。
最后,研究人员使用TRAM 1处理转 导了携带mNMNAT1和EcDHFR标签的腺相关病毒 (AAV) 的大鼠胚胎的背根神经节 (DRG) 神经元,发现TRAM 1可以促进NMNAT1从细胞核向轴突的重新定位,NMNAT1在轴突中的表达得到了维持,即使在轴突损伤后也能观察到轴突的健康状况和轴突末端的保护,这表明通过TRAM介导的NMNAT1重新定位确实能够在体外模型中减缓轴突退化的过程。
综上所述,本研究开发了一种定量的单细胞分析方法来检查通过TRAM介导的目标蛋白与穿梭蛋白的耦合潜力,展示了两种蛋白质伙伴的相对表达水平是推动目标蛋白重新定位能力的主要参数,证明通过与内源性穿梭蛋白的耦合可以改变内源性目标蛋白的定位。由此提供了一种新的策略来调控蛋白质的亚细胞定位,为治疗蛋白质定位异常相关疾病提供了新的可能性。通过精确控制蛋白质的定位,不仅可以纠正因蛋白质错位导致的疾病表型,还可以通过蛋白质重新定位赋予有益的功能,更细致地调节细胞功能,从而扩大治疗选择的范围,为开发新的治疗方法提供了理论基础和实验策略。
原文链接:https://doi.org/10.1038/s41586-024-07950-8
制版人:十一
1. Kau, T. R., Way, J. C. & Silver, P. A. Nuclear transport and cancer: from mechanism to intervention. Nat. Rev. Cancer 4, 106–117 (2004).
2. Hung, M.-C. & Link, W. Protein localization in disease and therapy. J. Cell Sci. 124, 3381–3392 (2011).
版权声明:本文为“乐问号”作者或机构在乐问医学上传并发布,仅代表该作者或机构观点,不代表乐问医学的观点或立场,不能作为个体诊疗依据,如有不适,请结合自身情况寻求医生的针对性治疗。
链接:http://www.lewenyixue.com/2024/10/19/Nature%EF%B8%B1%E7%BB%86%E8%83%9E%E5%86%85%E7%9A%84%E2%80%9C%E6%90%AC%E8%BF%90%E5%B7%A5%E2%80%9D%EF%BC%9A%E6%8F%AD%E7%A7%98%E8%9B%8B/
THE END