HER2靶向ADC新药:DHES0815A用于晚期/转移性乳腺癌初探索
【CMT&CHTV 医学前沿·临床经典】
导语 :研究探讨了一种新型HER2导向的抗体药物偶联物(ADC)在晚期乳腺癌治疗中的应用,为患者带来了新的希望,特别是在提高药物选择性和减少不良反应方面。
在乳腺癌治疗领域,HER2阳性乳腺癌因其高恶性程度和复发风险而备受关注。尽管已有多种靶向HER2的疗法,如曲妥珠单抗和帕妥珠单抗,以及ADC药物如恩美曲妥珠单抗(T-DM1)和T-DXd,但患者对于现有治疗的响应存在异质性,且部分患者最终会发展为对现有治疗耐药。这提示,开发新的治疗手段,尤其是具有新作用机制的ADC药物,是该领域的重要研究方向。2023年12月, Nat Commun 杂志发表了一篇题为“The HER2-Directed Antibody-Drug Conjugate DHES0815A in Advanced and/or Metastatic Breast Cancer: Preclinical Characterization and Phase 1 Trial Results”的文章,为我们提供了新视角和可能的解决方案。

本研究是一项多中心Ⅰ期临床试验,旨在评估DHES0815A在晚期或转移性HER2阳性乳腺癌患者中的安全性和耐受性,并确定最大耐受剂量(MTD)和推荐的Ⅱ期剂量(RP2D)。研究纳入了14例患者,采用静脉注射DHES0815A,剂量为0.6~6 mg/kg,每3周一次。主要指标为安全性和耐受性,次要指标包括药代动力学特征、客观缓解率(ORR)等。
临床缓解情况
研究结果显示,一名患者实现了完全缓解(7%),两名患者达到了部分缓解(14%),而大多数患者(57%)表现出病情稳定。然而,也有两名患者出现了病情进展(14%)。这些数据表明DHES0815A在一定程度上能够达到临床缓解,尽管并非所有患者均有缓解。
药代动力学特征
药代动力学分析揭示了DHES0815A的总抗体、抗体偶联PBD-单酰胺及未偶联PBD-单酰胺的最大浓度(Cmax)和曲线下面积(AUC)均与剂量成正比。值得注意的是,在所有剂量组中,未观察到明显的药物积累现象,这为药物的安全性提供了一定的支持。
安全性与耐受性问题
尽管治疗早期显示出抗肿瘤活性,但随着治疗的继续,患者在接受较高剂量(4 mg/kg及以上)治疗时出现了持续性、不可逆的皮肤、眼部及肺部毒性。这些不良反应最终导致了研究的提前终止。具体来说,11名患者(79%)经历了与DHES0815A相关的不良事件,其中最常见的不良事件为瘙痒和皮疹(各5例,36%)、疲劳(4例,29%),以及皮肤色素沉着、畏光、恶心(各3例,21%,表1)。
表1 发生率在20%以上的不良事件
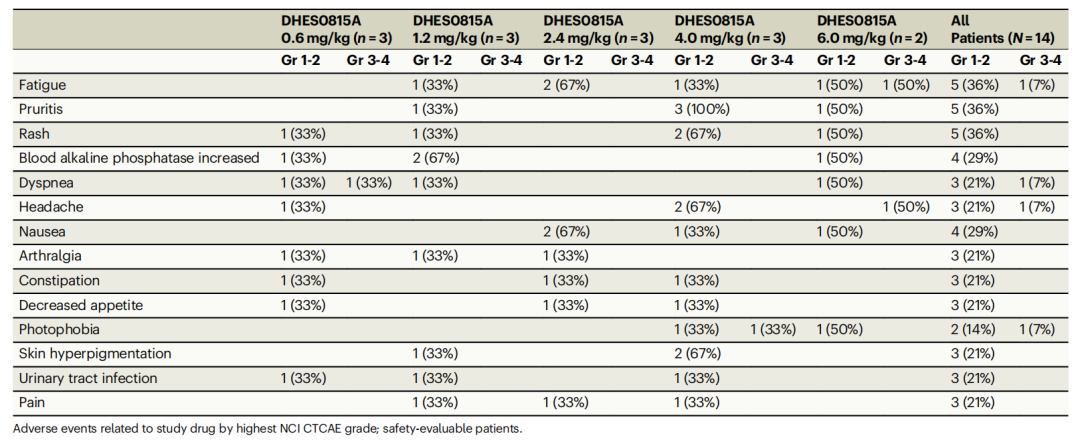
剂量效应关系
研究中观察到的剂量效应关系表明,尽管在低剂量下(0.6~2.4 mg/kg)未观察到剂量限制性毒性,但随着剂量的增加,特别是在4.0 mg/kg及以上剂量时,患者的不良反应显著增加。这提示了在进一步的开发中需要仔细考虑剂量选择和毒性管理。
抗药抗体的产生
研究还评估了抗DHES0815A抗体的产生情况,结果显示14.3%的患者产生了这些抗体。
本研究提供了一种新HER2靶向ADC药物DHES0815A的临床前和初步临床数据,该药物在HER2低表达的肿瘤中显示出的抗肿瘤活性。尽管由于剂量限制性毒性导致研究提前终止,但DHES0815A在低剂量下展现出的临床活性和药代动力学特征,为未来可能的剂量优化和安全性管理提供了重要信息。
参考文献
LEWIS G D, LI G, GUO J, et al. The HER2-directed antibody-drug conjugate DHES0815A in advanced and/or metastatic breast cancer: preclinical characterization and phase 1 trial results[J]. Nat Commun, 2024, 15(1): 466. DOI: 10.1038/s41467-023-44533-z.
链接:http://www.lewenyixue.com/2024/10/18/HER2%E9%9D%B6%E5%90%91ADC%E6%96%B0%E8%8D%AF%EF%BC%9ADHES0815/