Nat Gen | 哈佛医学院突破:空间转录组学揭示胰腺癌微环境治疗抵抗新机制
撰文:克里斯
IF :31.7
推荐度: 
亮点:
文章通过结合单细胞空间转录组学和计算方法,揭示了胰腺癌肿瘤微环境中细胞间相互作用的重构,特别是在新辅助化疗和放疗后的肿瘤微环境。该研究开发了一种新的空间约束最优传输相互作用分析(SCOTIA)方法,发现了癌症相关成纤维细胞与恶性细胞之间的配体-受体相互作用在治疗后显著变化,特别是与化疗抗性相关的IL-6家族信号通路的富集。这项研究不仅为理解治疗抵抗性的形成提供了新的分子层面的见解,而且提供了一个可以广泛应用于其他研究领域的空间分析框架。
近日,美国哈佛医学院系统生物学中心在 国际知名期刊 《 Nature genetics 》 发表了题为: Spatially resolved analysis of pancreatic canceridentifies therapy-associated remodeling of the tumor microenvironment 的研究文章。
文章首先介绍了胰腺癌治疗响应的研究背景和目的,随后详细描述了使用单细胞空间转录组学技术和新开发的SCOTIA分析方法来研究人类胰腺癌样本的实验设计和方法。随后,文章展示了通过这些技术获得的关于肿瘤微环境中细胞组成和相互作用的详细结果,特别强调了治疗后癌症相关成纤维细胞与恶性细胞之间相互作用的变化,以及IL-6家族信号在化疗耐药性中的作用。在讨论部分深入分析了这些发现对于理解胰腺癌治疗耐药性的意义,并指出了研究的局限性和未来研究方向。
1、前言
研究背景
胰腺导管腺癌(PDAC)作为一种极其致命的恶性肿瘤,其5年总体生存率大约只有13%,治疗失败普遍存在,这主要是由于对细胞固有状态的转录重编程以及与肿瘤微环境(TME)的细胞外相互作用理解不足。研究者们利用单细胞空间转录组学技术,深入探索了新辅助化疗和放疗如何重塑胰腺癌的多细胞邻域和细胞间相互作用,以期发现可能在治疗抵抗性出现中起作用的分子相互作用,并为治疗抵抗性的形成提供新的视角和潜在的治疗靶点。
研究设计
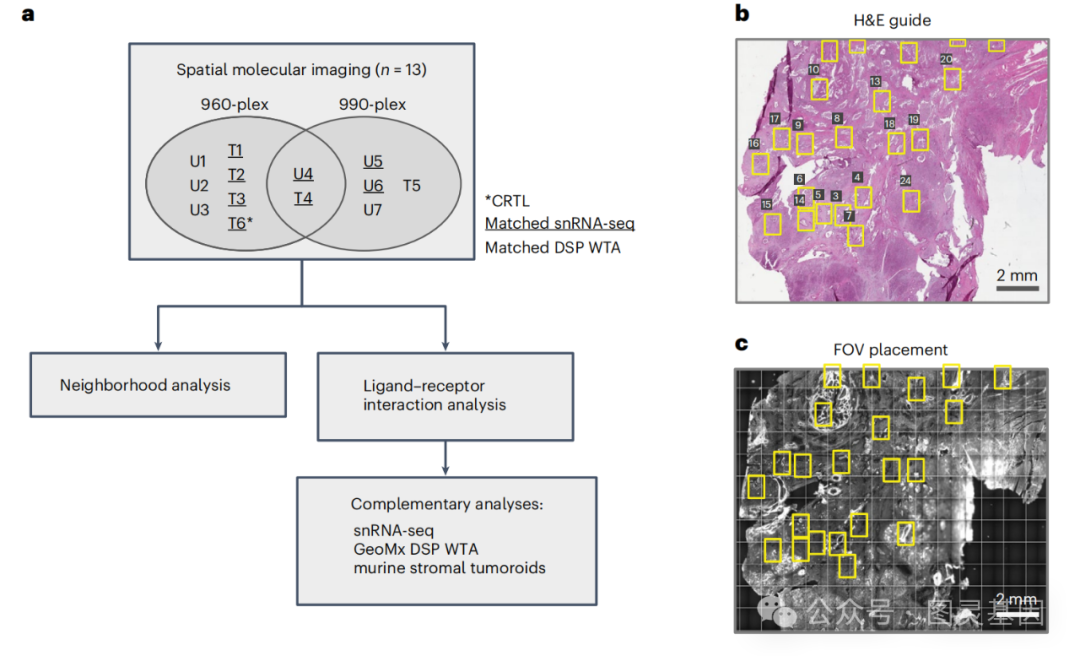
图1.捕捉到胰腺肿瘤的亚细胞级结构
基于上述背景,研究首先选取了一组经过新辅助化疗和放疗治疗以及未经治疗的胰腺癌患者样本,然后利用先进的空间分子成像(SMI)技术对这些样本进行单细胞分辨率的空间转录组分析,以捕捉肿瘤微环境中细胞间的相互作用。
研究者进一步开发了一种创新的空间约束最优传输相互作用分析(SCOTIA)模型,该模型通过结合细胞间的空间距离和配体-受体基因表达信息,定量分析了肿瘤微环境中细胞间通讯的强度和变化。通过对治疗前后样本的SCOTIA分析,研究团队揭示了癌相关成纤维细胞与恶性细胞之间在治疗后配体-受体相互作用的显著变化,并在体外肿瘤类器官共培养系统中验证了这些发现。
此外,研究还特别关注了IL-6家族信号通路在化疗抵抗中的作用,为揭示胰腺癌治疗抵抗性的分子机制提供了新的视角。整个研究通过综合利用单细胞空间转录组学、计算生物学和功能实验验证,构建了一个多维度、高精度的胰腺癌肿瘤微环境分析框架,为未来的精准治疗提供了潜在的靶点和理论基础。
2、单细胞空间转录组学分析技术
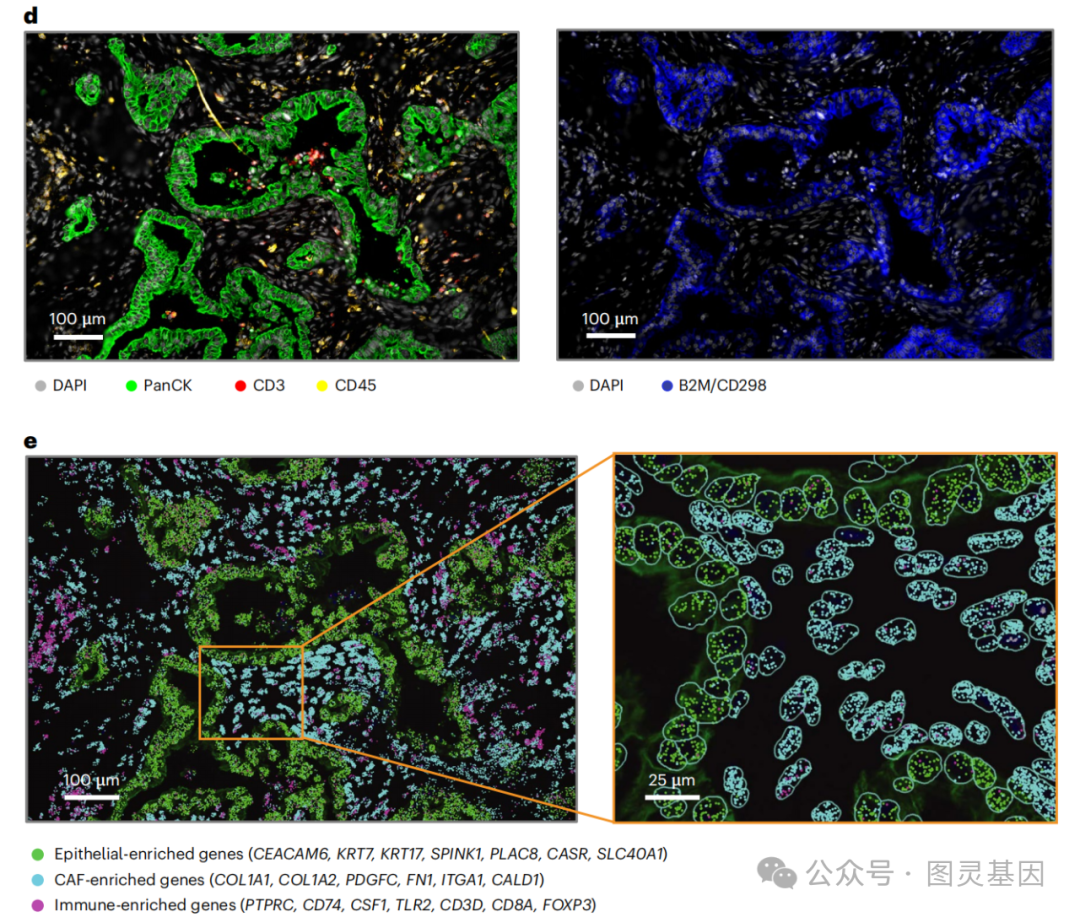
研究者使用单细胞空间转录组学技术,特别是空间分子成像(SMI)技术,对人类胰腺癌组织进行了深入的分析。这项技术允许研究者在单细胞分辨率下,对肿瘤微环境中的细胞进行空间定位和基因表达分析。通过对接受新辅助化疗和放疗的胰腺癌患者以及未经治疗的患者的肿瘤样本进行分析,研究者们能够详细地描绘出肿瘤微环境中的细胞组成和它们的空间组织结构。
在该实验中研究者们开发了一种名为空间约束最优传输相互作用分析(SCOTIA)的新方法,这是一种结合了空间距离和配体-受体基因表达信息的最优传输模型。利用SCOTIA,研究者们能够量化并比较治疗前后肿瘤微环境中细胞间相互作用的变化,特别是癌相关成纤维细胞(CAFs)与恶性细胞之间的相互作用。研究发现,在治疗后,CAFs与恶性细胞之间的配体-受体相互作用发生了显著变化,这些变化在体外肿瘤类器官共培养系统中得到了验证。
图2.SMI技术揭示胰腺癌中的细胞类型多样性
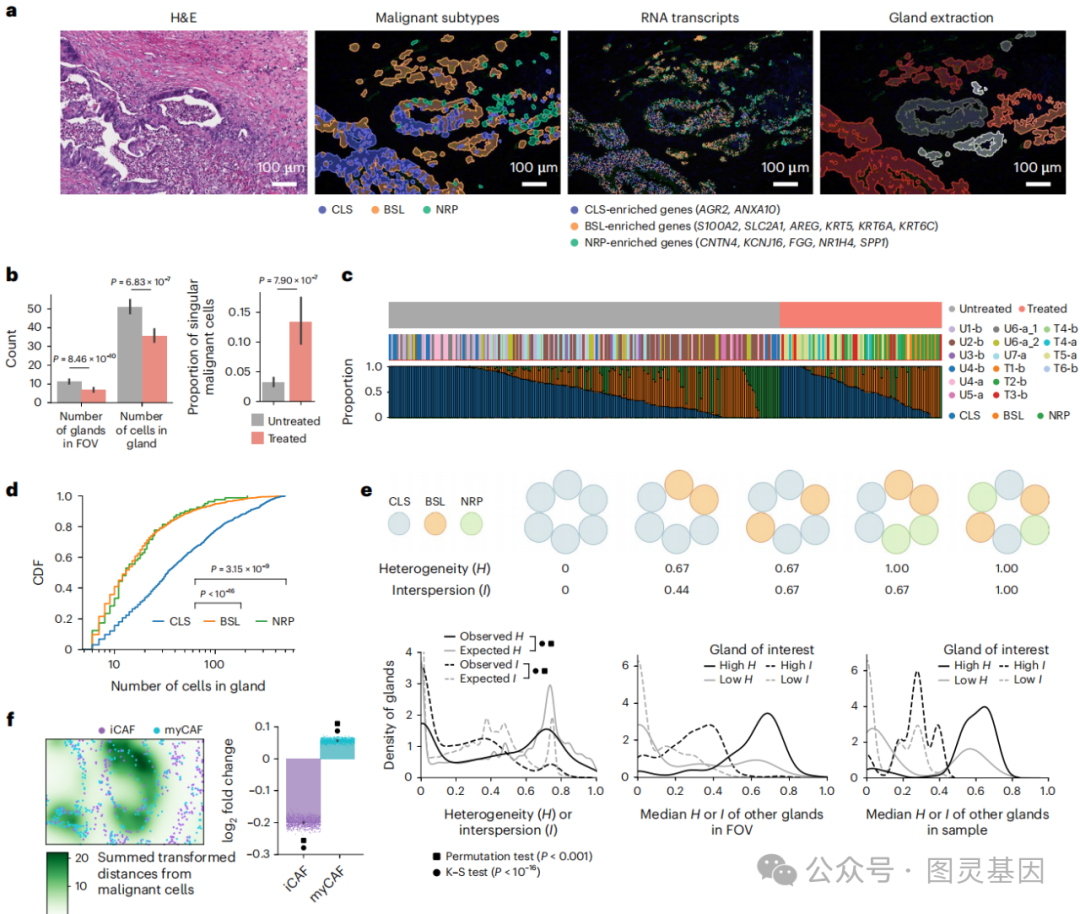
3、低腺体异质性与多细胞关联
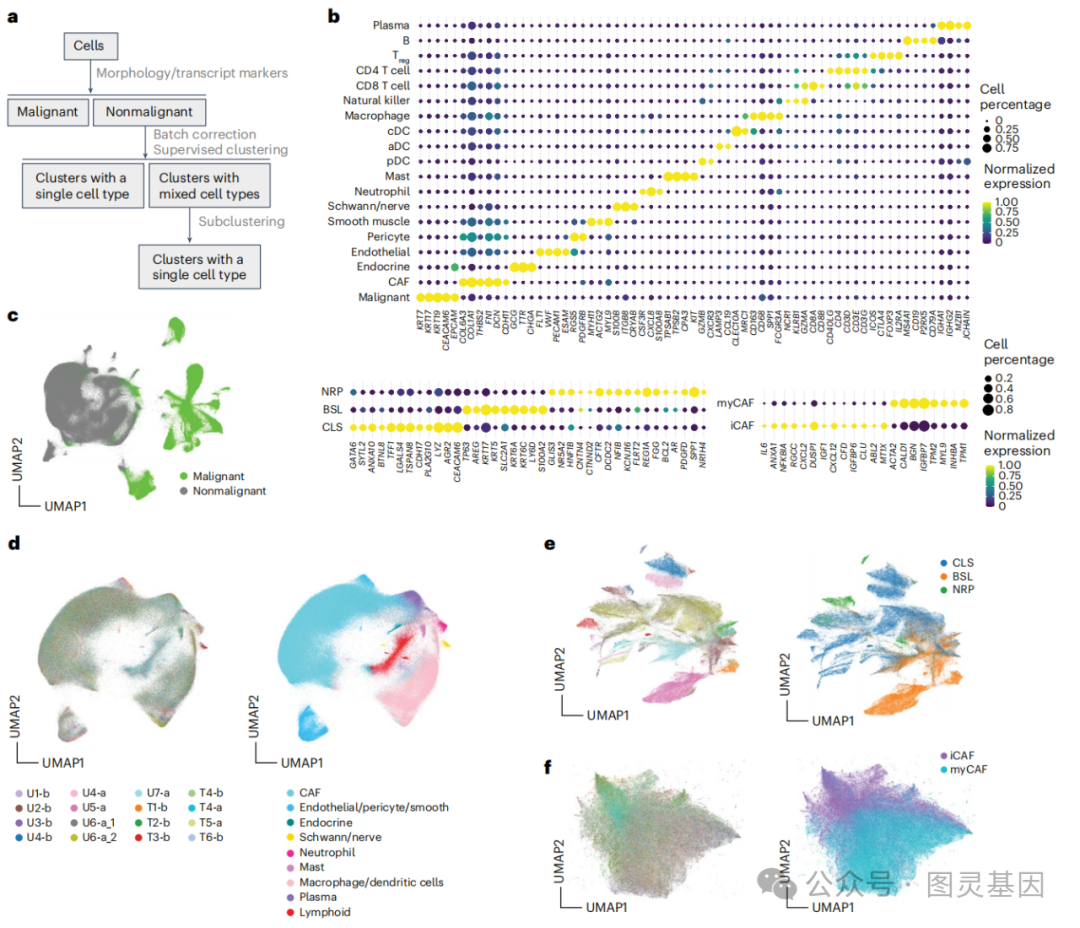
通过对单细胞空间转录组学数据的分析,研究者们观察到肿瘤中的腺体显示出较低的异质性,即腺体内部的细胞类型组成倾向于单一化,而非多样化混合。此外,这些腺体与多种类型的细胞,包括癌相关成纤维细胞(CAFs)和免疫细胞等,存在显著的空间关联性。这些发现揭示了胰腺癌肿瘤微环境中细胞间相互作用的复杂性,以及这些相互作用如何可能影响肿瘤的生物学行为和对治疗的响应。
图3.空间分子成像揭示胰腺癌的腺体异质性和多细胞邻里关系
具体来说,研究者们利用空间约束最优传输相互作用分析(SCOTIA)模型,分析了治疗前后肿瘤微环境中细胞间配体-受体相互作用的变化,发现治疗后CAFs与恶性细胞之间的相互作用增强,特别是与IL-6家族信号通路相关的相互作用,这可能与癌细胞对化疗的抵抗性增强有关。这些结果强调了在胰腺癌治疗策略中考虑肿瘤微环境内细胞间相互作用的重要性。
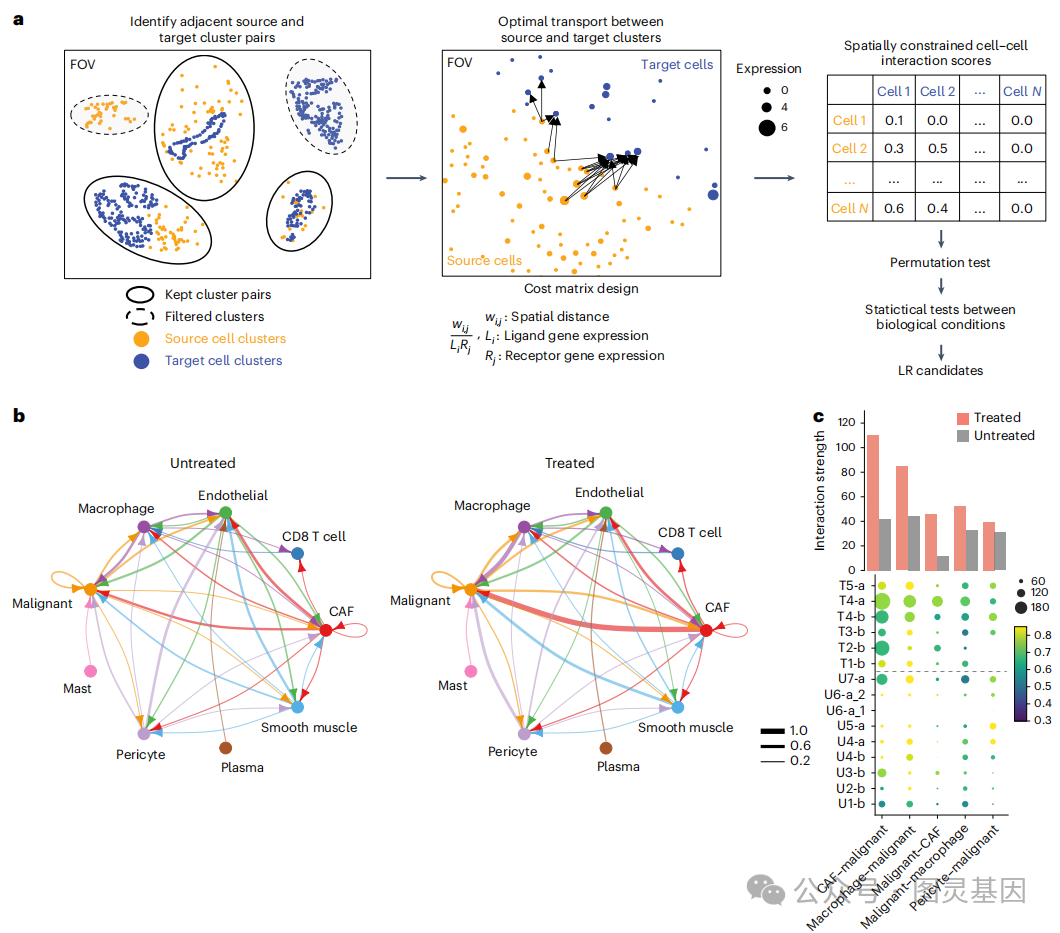
4、利用SCOTIA模型识别CAFs和恶性细胞之间的相互作用
通过运用空间约束最优传输相互作用分析(SCOTIA)这一先进方法,研究团队能够量化并揭示在新辅助化疗和放疗之后,CAFs与恶性细胞之间的配体-受体相互作用发生了显著的增强。研究发现在治疗后的肿瘤微环境中,CAFs与恶性细胞之间的某些关键信号通路,尤其是与IL-6家族信号通路相关的相互作用,表现出了明显的富集,这可能在癌细胞对化疗药物产生抵抗性的过程中起到了促进作用。
图4.SCOTIA解析细胞间相互作用
此外,研究者们还利用了体外肿瘤类器官共培养系统对这些相互作用进行了验证,进一步证实了SCOTIA分析结果的可靠性。这些发现不仅揭示了治疗如何影响肿瘤微环境中的细胞间通讯,而且强调了在开发新的治疗策略时,需要考虑肿瘤微环境内的细胞间相互作用,特别是CAFs与恶性细胞之间的相互作用。通过深入理解这些相互作用在治疗抵抗性中的作用,研究者们希望能够为胰腺癌患者提供更有效的治疗选择,从而改善治疗效果和患者预后。
5、细胞毒性治疗改变配体-受体相互作用
研究团队利用单细胞空间转录组学技术对人类胰腺癌样本进行了深入分析新辅助化疗和放疗对肿瘤微环境中细胞间相互作用的影响,开发出一种名为空间约束最优传输相互作用分析(SCOTIA)的计算方法,该方法结合了空间距离和配体-受体基因表达信息,以评估细胞间的相互作用强度。
通过这种方法研究人员发现,在接受了新辅助化疗和放疗的胰腺癌样本中,癌相关成纤维细胞(CAFs)与恶性细胞之间的配体-受体相互作用发生了显著变化。具体来说,与未治疗的肿瘤相比,治疗后的肿瘤中CAFs与恶性细胞之间的相互作用在多个信号通路上表现出增强或减弱的趋势,尤其是那些涉及IL-6家族信号通路的相互作用,这些通路已知与肿瘤的化疗耐药性有关。
该发现表明,细胞毒性治疗不仅影响了肿瘤细胞本身,还重塑了肿瘤微环境中的细胞间通讯网络。这种对肿瘤微环境的重构可能会影响肿瘤对治疗的响应,包括促进或抑制治疗抵抗的形成。研究结果强调了深入理解肿瘤微环境中细胞间相互作用的重要性,并为开发新的治疗策略提供了潜在的靶点,这些策略旨在干扰肿瘤微环境中的细胞间通讯,从而提高治疗效果。
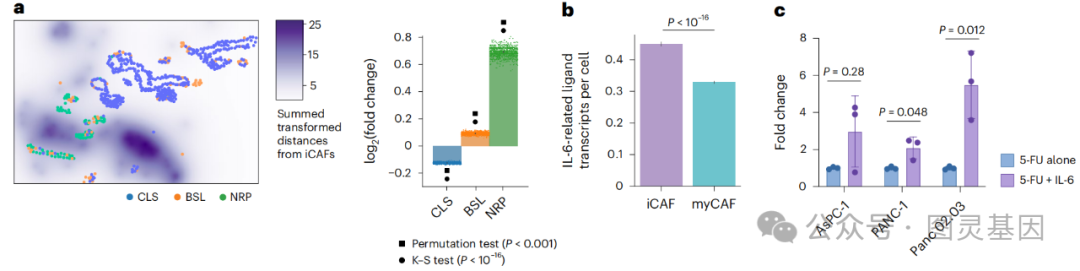
6、IL-6家族信号通路在胰腺癌化疗耐药性中的作用及其验证
图5.IL-6家族信号在人类胰腺癌细胞系中赋予化疗抗性
除了通过单细胞空间转录组学技术揭示了新辅助化疗和放疗对胰腺癌肿瘤微环境中配体-受体(LR)相互作用的影响外,研究人员还通过补充分析进一步验证了这些发现。他们利用体外肿瘤类器官共培养系统和人类胰腺癌细胞系实验,证实了治疗后CAFs与恶性细胞之间IL-6家族信号通路的活化,特别是CLCF1-CNTFR和LIF-IL6ST配体-受体对,这些通路在治疗后的肿瘤中表达增强,并与化疗耐药性相关。
此外,通过在人类胰腺癌细胞系中加入重组IL-6进行的实验表明,IL-6能够促进癌细胞在5-FU化疗药物存在下的存活,从而直接证明了IL-6家族信号通路在介导化疗耐药性中的重要作用。这些结果不仅在不同的实验模型中得到了一致的验证,而且为未来的治疗策略提供了潜在的分子靶点,以期通过干预这些信号通路来克服胰腺癌的化疗耐药性。
教授介绍
William L Hwang 教授,马萨诸塞州癌症综合医院放射肿瘤科医生,同时担任哈佛医学院的助理教授。他专门研究胃肠道癌症的治疗,他的研究项目专注于使用单细胞和空间基因组学、基因工程小鼠模型和3D类器官共培养物,以高分辨率阐明胰腺癌症细胞及其微环境之间的相互作用。其主要研究方向为:肿瘤神经交流,肿瘤发生和治疗耐药性的细胞状态可塑性;以及放疗和全身疗法重新编程肿瘤微环境的机制。他的研究获得了 Seidman 杰出高级医学生论文奖、MGH临床研究奖、 William Shipley 研究奖、美国临床肿瘤学会青年研究员奖和 Hopper Belmont 基金会灵感奖。
参考文献
Shiau C, Cao J, Gong D, Gregory MT, Caldwell NJ, Yin X, Cho JW, Wang PL, SuJ, Wang S, Reeves JW, Kim TK, Kim Y, Guo JA, Lester NA, Bae JW, Zhao R,Schurman N, Barth JL, Ganci ML, Weissleder R, Jacks T, Qadan M, Hong TS, Wo JY,Roberts H, Beechem JM, Castillo CF, Mino-Kenudson M, Ting DT, Hemberg M, HwangWL. Spatially resolved analysis of pancreatic cancer identifiestherapy-associated remodeling of the tumor microenvironment. Nat Genet. 2024Sep 3. doi: 10.1038/s41588-024-01890-9. Epub ahead of print. PMID: 39227743.
链接:http://www.lewenyixue.com/2024/10/17/Nat%20Gen%20%EF%BD%9C%20%E5%93%88%E4%BD%9B%E5%8C%BB%E5%AD%A6%E9%99%A2%E7%AA%81%E7%A0%B4%EF%BC%9A%E7%A9%BA%E9%97%B4/







赶快来坐沙发