中国青年学者领衔,炎症小体蛋白抑制肿瘤发展新机制,登上Nature大子刊!
炎症小体 (Inflammasome)是一种多蛋白复合体,存在于 真核细胞 的细胞质中,是先天免疫系统的关键组成部分。它们的主要功能是感知入侵的病原体以及细胞内部的损伤信号,并由此触发炎症反应。炎症小体的激活可以导致促炎细胞因子的成熟和分泌,以及一种特殊的程序性细胞死亡方式——焦亡(Pyroptosis)。
1.炎症小体传感器(Sensors) :这些是能够识别特定 病原体相关分子模式 (PAMPs)和损伤相关分子模式(DAMPs)的受体蛋白。常见的传感器包括NLR(NOD样受体)家族成员,如NLRP3、NLRC4和AIM2等。
2.适配蛋白(Adaptor proteins) :某些炎症小体复合体,如NLRP3炎症小体,需要适配蛋白如ASC(Apoptosis-associated speck-like protein containing a caspase recruitment domain)来桥接传感器和效应蛋白。
3.效应蛋白(Effector proteins) :主要是炎症 caspases,如caspase-1、caspase-4、caspase-5和caspase-11。这些蛋白在炎症小体中被激活,进而切割前体的促炎细胞因子,使其成熟并发挥生物学功能。
炎症小体因其在感染性疾病和自身炎症性疾病中的显著作用而受到极大关注。此外,它们还可能与肿瘤的发生、发展以及转移过程有着密切的联系。尽管如此,目前对于炎症小体在肿瘤形成和进展中的具体作用尚不完全清楚,尤其是NLRC4蛋白在这一过程中可能扮演的角色,仍然是一个谜。
澳大利亚国立大学 满思明 团队 通过在Apc min/+ 小鼠模型中的研究,发现了炎症小体蛋白NLRC4在肿瘤发展中扮演的新角色,即NLRC4能够独立于其在炎症小体中的经典功能,通过与DNA损伤感应复合体相互作用来减轻肿瘤的发展。他们揭示了NLRC4与ATR-ATRIP-ETAA1复合体的相互作用,以及其在促进checkpoint adapter protein claspin招募和激活checkpoint kinase-1 (CHK1)中的作用,进而减少DNA损伤的积累,抑制肿瘤发展。 相关工作以“Inflammasome protein scaffolds the DNA damage complex during tumor development”为题发表在《 Nature Immunology 》中。
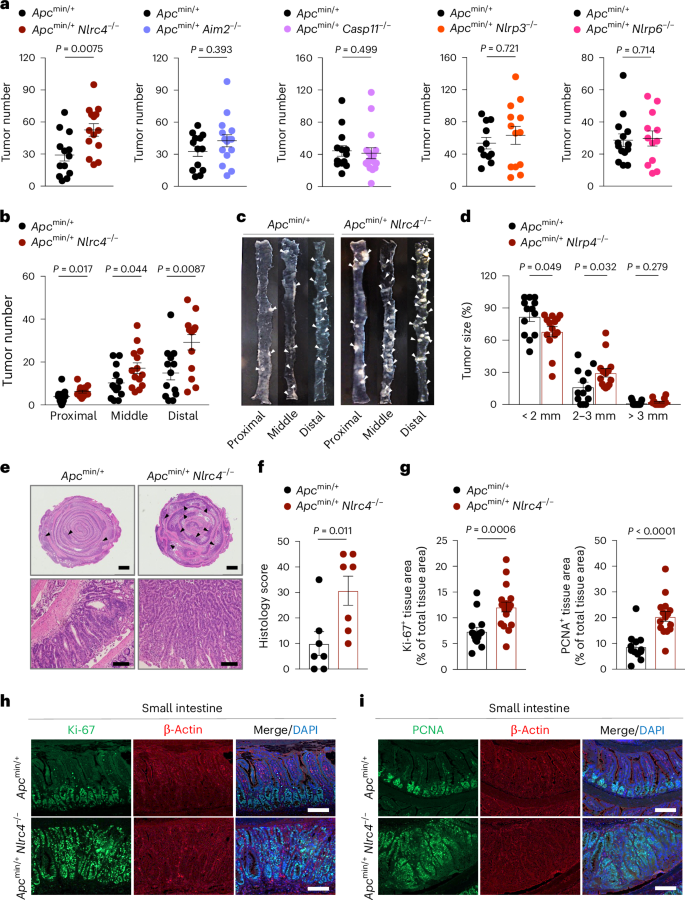
图1 NLRC4在Apc min/+ 小鼠模型中对肿瘤发展的影响
研究发现,与野生型Apc min/+ 小鼠相比,NLRC4基因敲除的Apc min/+ Nlrc4 −/− 小鼠在20周龄时小肠肿瘤数量显著增加,且肿瘤在小肠的近端、中部和远端段均有分布,尤其在远端段肿瘤数量最多。此外,这些小鼠的肿瘤大小也略大于野生型小鼠。通过苏木精-伊红(H&E)染色,作者们观察到Apc min/+ Nlrc4 −/− 小鼠小肠组织中腺瘤和增生的组织学评分更高,表明NLRC4的缺失与肿瘤的增加和增大有关。同时,通过Ki-67和 PCNA 的染色,研究还发现Apc min/+ Nlrc4 −/− 小鼠小肠组织中的增殖标志物表达增加,进一步证实了NLRC4对肿瘤发展的抑制作用。
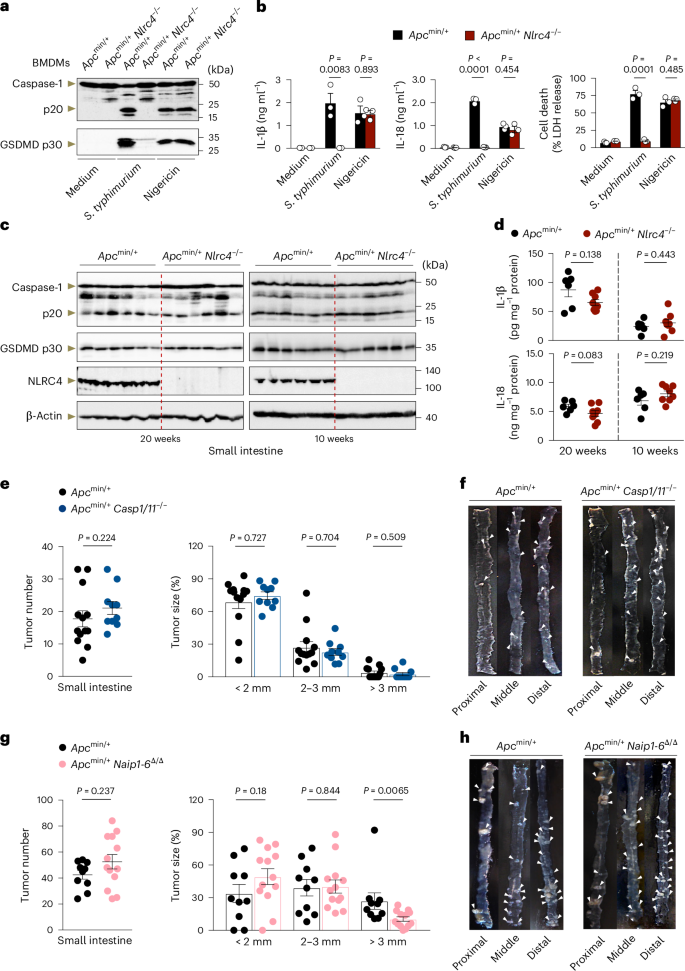
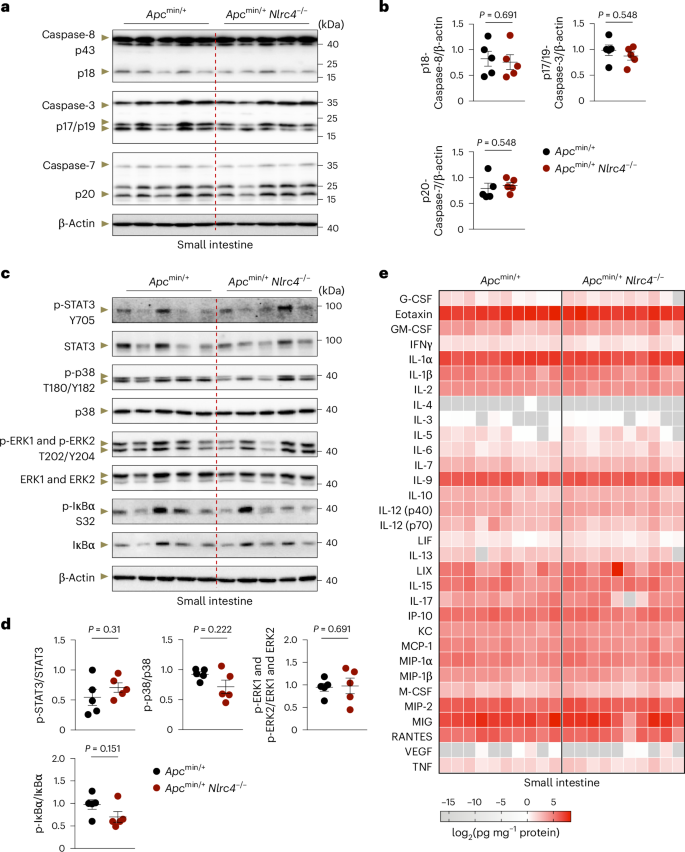
研究结果表明,NLRC4基因敲除的小鼠与野生型小鼠相比,在肿瘤相关炎症小体激活、细胞因子分泌、细胞死亡以及炎症信号通路激活方面没有显著差异。这些发现排除了NLRC4通过炎症小体途径参与肿瘤发展的可能,揭示了NLRC4可能通过其他未定义的信号通路发挥其抑制肿瘤的功能。
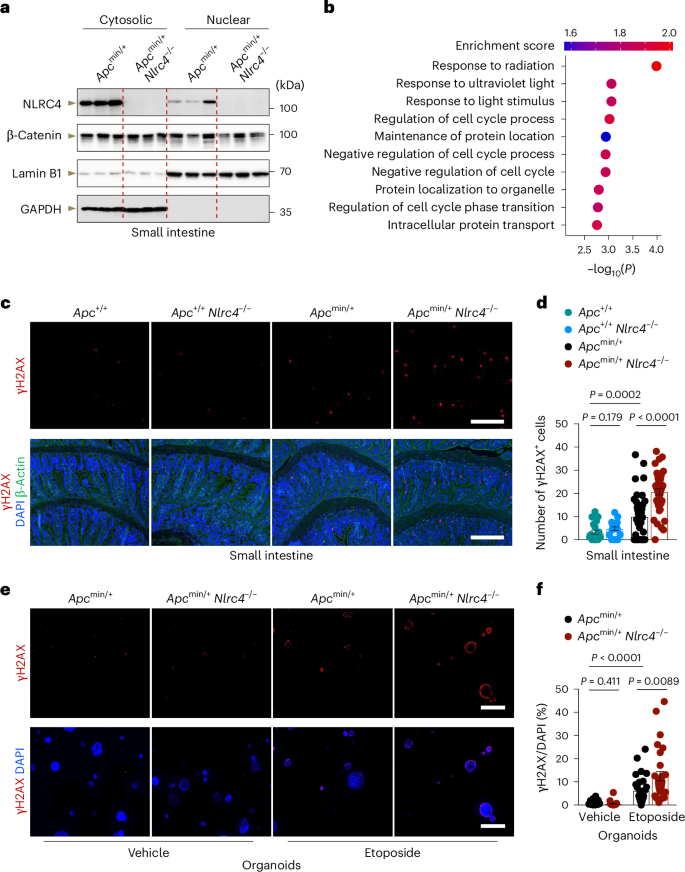
图3 NLRC4在小鼠小肠组织中与DNA损伤应答相关蛋白的相互作用及其功能
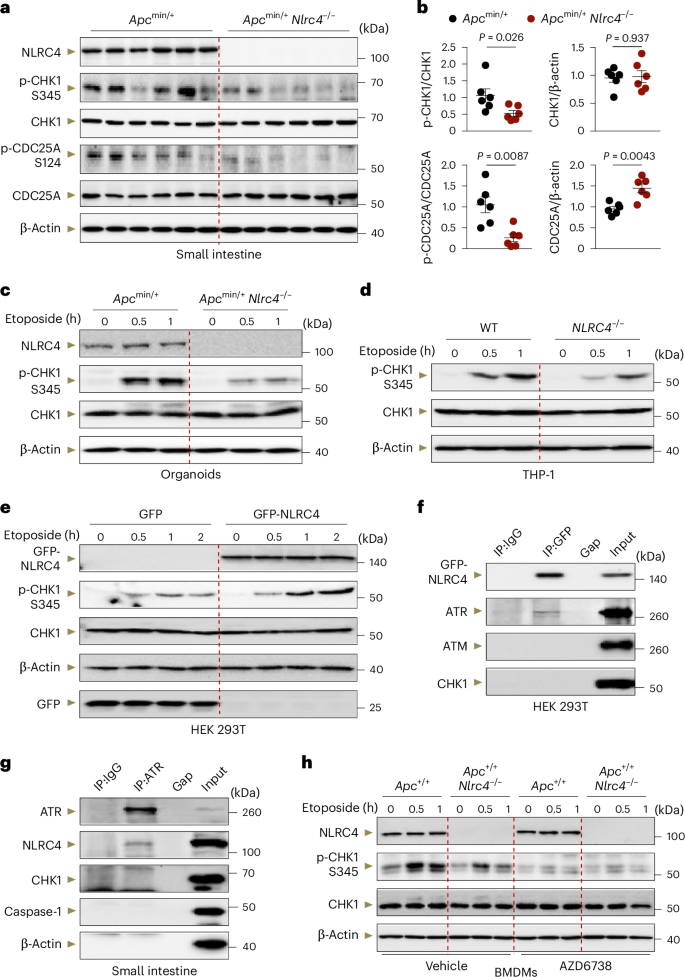
研究发现,与Apc min/+ 小鼠相比,NLRC4基因敲除的Apc min/+ Nlrc4 −/− 小鼠小肠组织中DNA损伤标志物γH2AX的阳性细胞数量增多,表明NLRC4有助于减少DNA损伤的积累。此外,通过检测DNA损伤响应蛋白的磷酸化水平,研究还发现Apc min/+ Nlrc4 −/− 小鼠中CHK1的激活水平降低,这与其在 DNA损伤应答 中的关键作用一致。
图4 NLRC4如何通过与ATR-ATRIP-ETAA1复合体相互作用来促进DNA损伤响应
研究显示,在Apc min/+ 小鼠模型中,NLRC4的缺失导致小肠组织中γH2AX阳性细胞数量增加,这表明DNA损伤的积累加剧。此外,通过全球磷酸蛋白质组质谱分析,研究团队发现与DNA损伤应答相关的蛋白质磷酸化水平发生了变化,暗示NLRC4可能参与调控DNA损伤应答。进一步的实验证实,NLRC4能够与ATR激酶相互作用,并且这一相互作用对于促进CHK1的激活和减少DNA损伤积累至关重要。
在Apc min/+ 小鼠的小肠组织中,NLRC4与ATR激酶相互作用,这一相互作用对于DNA损伤诱导的CHK1激活至关重要。与野生型小鼠相比,NLRC4基因敲除的小鼠显示出CHK1激活水平的降低,这与增加的DNA损伤积累相一致。此外,研究还发现NLRC4能够促进 claspin 到 ATR–ATRIP 复合体的招募,这是ATR介导的DNA损伤响应的一个关键步骤。通过使用ATR抑制剂AZD6738,研究证实了ATR-CHK1-CDC25A信号通路在NLRC4介导的DNA损伤响应中的核心作用。
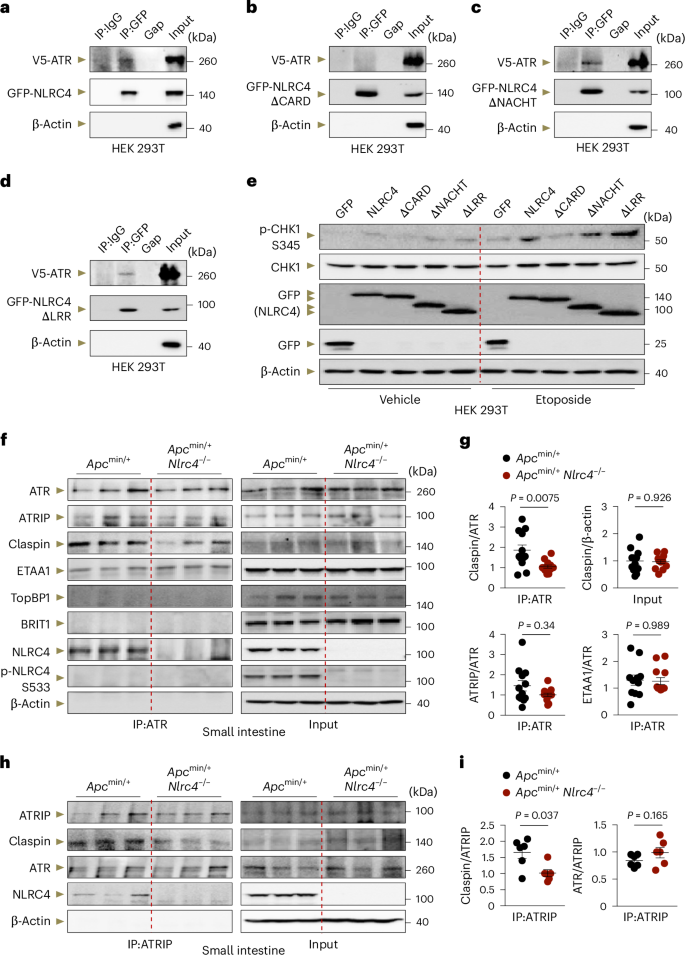
图6 NLRC4通过其CARD结构域与ATR的HEAT和FATC结构域相互作用
研究发现,NLRC4的CARD结构域对于其与ATR的结合以及后续CHK1激活至关重要。通过一系列分子生物学实验,包括免疫共沉淀和蛋白质互作分析,作者们揭示了NLRC4在ATR介导的信号传导中的作用,特别是它在促进 claspin 招募到ATR–ATRIP复合体中的作用。
本文报道了一项突破性的研究,揭示了炎症小体蛋白NLRC4在肿瘤发展中的非典型功能。研究人员发现,在Apc min/+ 小鼠模型中,NLRC4能够独立于其在炎症小体中的经典功能,通过与DNA损伤感应复合体相互作用来减轻肿瘤的发展。这一发现挑战了以往对炎症小体仅在炎症反应中发挥作用的传统观点,扩展了我们对炎症小体在肿瘤生物学中作用的理解。
原文链接: https://doi.org/10.1038/s41590-024-01988-6
版权声明:本文为“乐问号”作者或机构在乐问医学上传并发布,仅代表该作者或机构观点,不代表乐问医学的观点或立场,不能作为个体诊疗依据,如有不适,请结合自身情况寻求医生的针对性治疗。
链接:http://www.lewenyixue.com/2024/10/16/%E4%B8%AD%E5%9B%BD%E9%9D%92%E5%B9%B4%E5%AD%A6%E8%80%85%E9%A2%86%E8%A1%94%EF%BC%8C%E7%82%8E%E7%97%87%E5%B0%8F%E4%BD%93%E8%9B%8B%E7%99%BD%E6%8A%91%E5%88%B6%E8%82%BF%E7%98%A4%E5%8F%91/
THE END