Cell | 饱和基因组编辑评估RAD51C变异的癌症风险
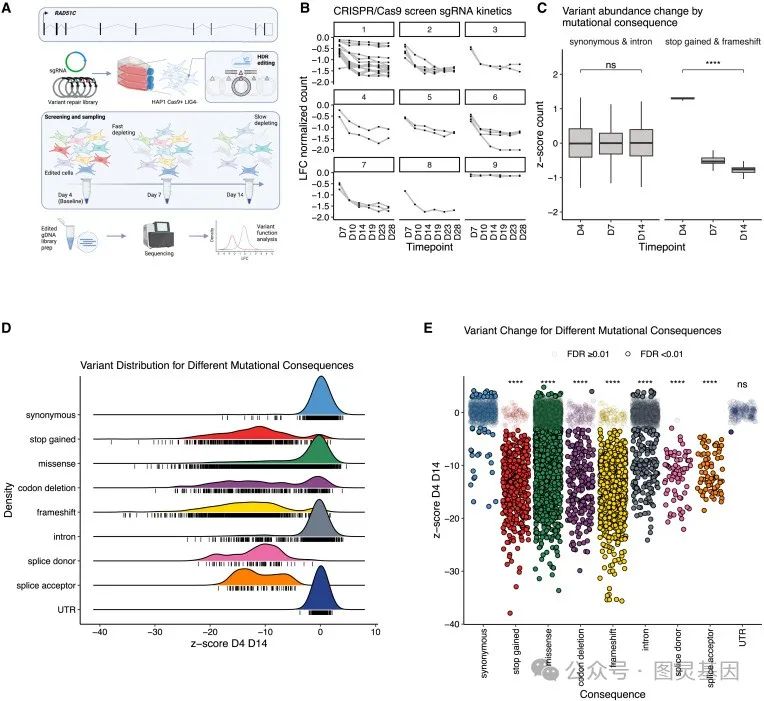
RAD51C 的致病变异会增加患乳腺癌和卵巢癌的风险,而特定 RAD51C 等位基因纯合的个体可能会患上范科尼贫血( FanconiAnaemia )。使用饱和基因组编辑( SGE ),研究人员对 9188 个独特的变异进行了功能评估,包括 >99.5% 的所有可能的编码序列单核苷酸改变。
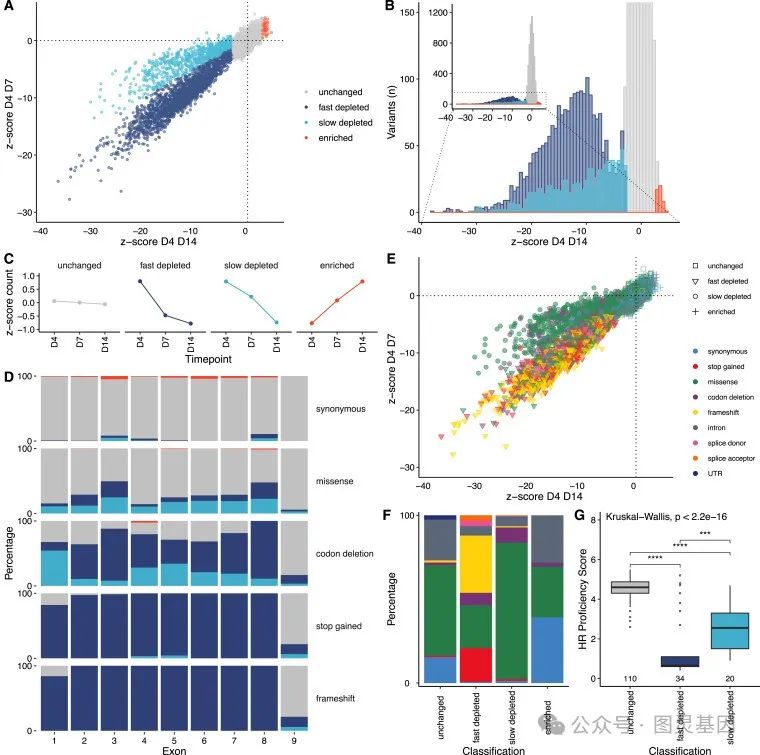
通过计算变异丰度的变化和高斯混合模型( GMM ),研究人员根据功能将 3094 个变异分类为破坏性变异,并使用临床真值集来揭示变异分类的准确性 / 一致性 >99.9% 。细胞适应度是主要的分析读数,使研究人员能够观察到一种现象,即特定的错义变异表现出明显的衰竭动力学,可能表明它们代表着亚效等位基因。
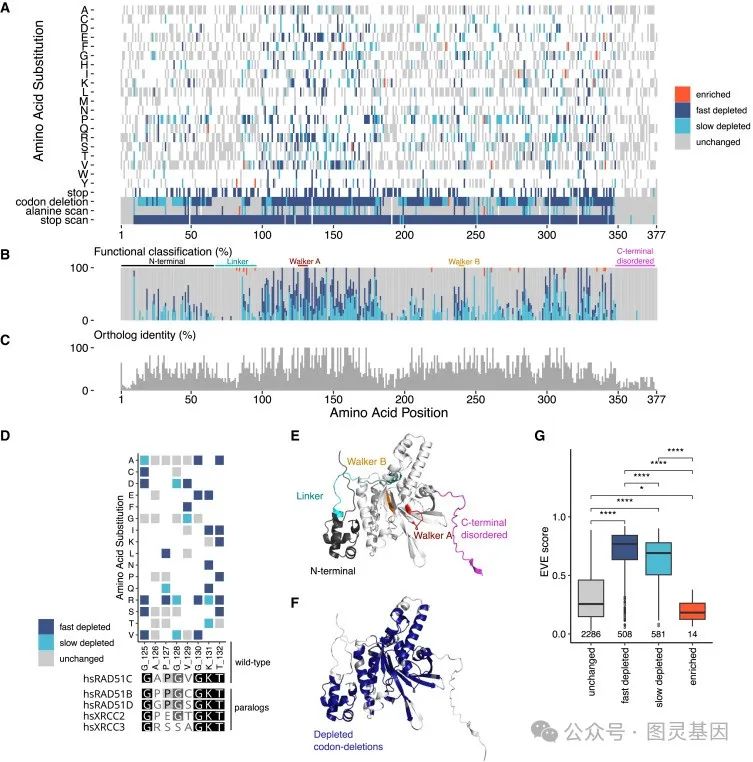
研究人员进一步探索了他们详尽的功能图谱,揭示了 RAD51C 结构上的关键残基,并解决了在癌症谱系中发现的变异。此外,通过对 UK Biobank 和大型多中心卵巢癌队列的调查,研究人员发现 SGE 缺失变异与癌症诊断之间存在显著关联。
RAD51C 基因是一种“癌症保护”基因,它编码一种对 DNA 修复至关重要的蛋白质。这种基因的变异会使蛋白质停止工作,从而增加患乳腺癌和卵巢癌的风险,在极少数情况下,还会导致一种叫做范科尼贫血( FanconiAnaemia )的严重遗传疾病。了解到这一点, WellcomeSanger 研究所的研究人员及其合作者对 RAD51C 进行了调查,发现了 3000 多种有害的基因变化,这些变化可能会破坏其功能并增加癌症风险。
研究结果发表在《 Cell 》杂志上的一篇题为“ High-resolutionfunctional mapping of RAD51C by saturation genome editing ”的文章中,为更好的风险评估和更加个性化的治疗铺平了道路。

通过绘制蛋白质结构,研究小组还确定了 RAD51C 的关键表面区域,这对其 DNA 修复功能至关重要。
该研究还揭示了“亚效等位基因”的存在,这是一种可以降低 RAD51C 基因功能但不会完全使其丧失功能的变异。这些似乎比以前认为的更常见,可能会显著增加乳腺癌和卵巢癌的风险。
这项研究的第一作者、 Wellcome Sanger 研究所的 Rebeca Olvera-León 说:“这项研究表明,乳腺癌和卵巢癌的遗传风险不是一个简单的是或否的情况,而是基于遗传变化如何影响蛋白质功能而存在的。随着对 RAD51C 基因变异如何导致癌症风险的更全面了解,这为更准确的风险预测、预防策略和潜在的靶向治疗开辟了新的可能性。”
“这项工作展示了在基因组背景下大规模分析遗传变异的力量。”该研究的资深作者之一、 WellcomeSanger 研究所的 AndrewWaters 博士解释说。 Waters 补充道:“我们不仅可以了解癌症相关的 DNA 变化如何影响患者,帮助临床决策,而且还可以探索这些变异如何在详细的分子水平上影响基因的功能。这为了解蛋白质如何工作以及基因如何随时间进化提供了重要的见解。”
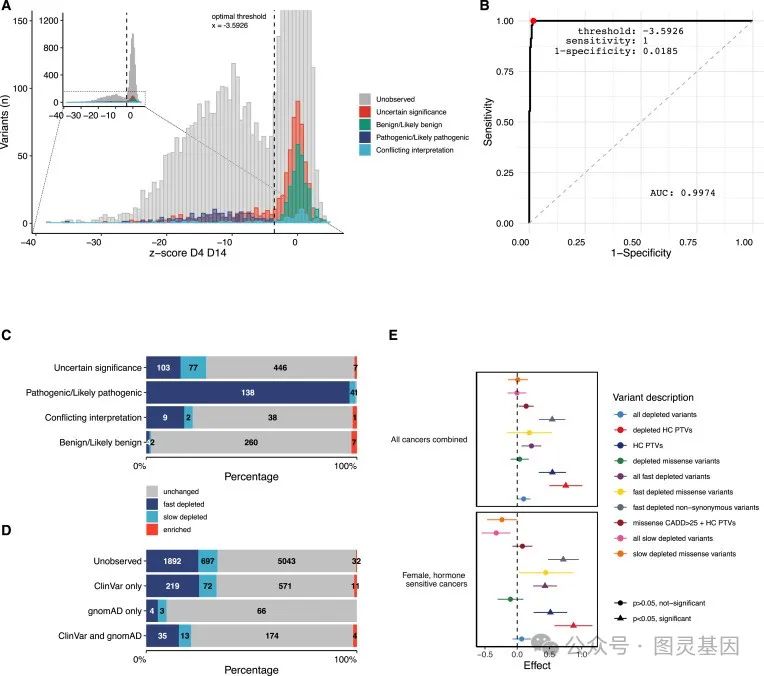
研究人员认为,在大型研究中,有害变异与癌症之间的紧密联系表明,这种变异分类方法可能是个性化医疗和癌症预防的宝贵工具。他们的目标是将这项技术扩展到许多其他基因,目标是在未来十年通过变异效应图谱覆盖整个人类基因组。

该研究的临床负责人,伦敦癌症研究所转化癌症遗传学教授,皇家马斯登 NHS 基金会癌症临床遗传学顾问 ClareTurnbull 博士说:“这些新数据将对诊断实验室非常有用,可以更好地了解我们在癌症患者及其家庭成员的临床基因检测中发现的 RAD51C 基因变化。分析数据将帮助我们断定哪些基因变化是有害的,哪些是无害的。这有助于我们确定哪些患者可能从额外的乳腺癌筛查和卵巢预防性手术中受益。”
链接:http://www.lewenyixue.com/2024/10/15/Cell%20%7C%20%E9%A5%B1%E5%92%8C%E5%9F%BA%E5%9B%A0%E7%BB%84%E7%BC%96%E8%BE%91%E8%AF%84%E4%BC%B0RAD5/