30+综述聚焦肿瘤研究新热点:癌症免疫循环
早上好呀,小伙伴们~今天跟大家分享一篇 癌症免疫(CI) 循环相关的综述(IF=32+),CI循环提供了一个框架来理解产生抗癌免疫反应的一系列事件,循环中的每一步都可能成为限制因素,导致免疫系统无法控制肿瘤生长,本文综合讨论了CI循环的机制以及应用。

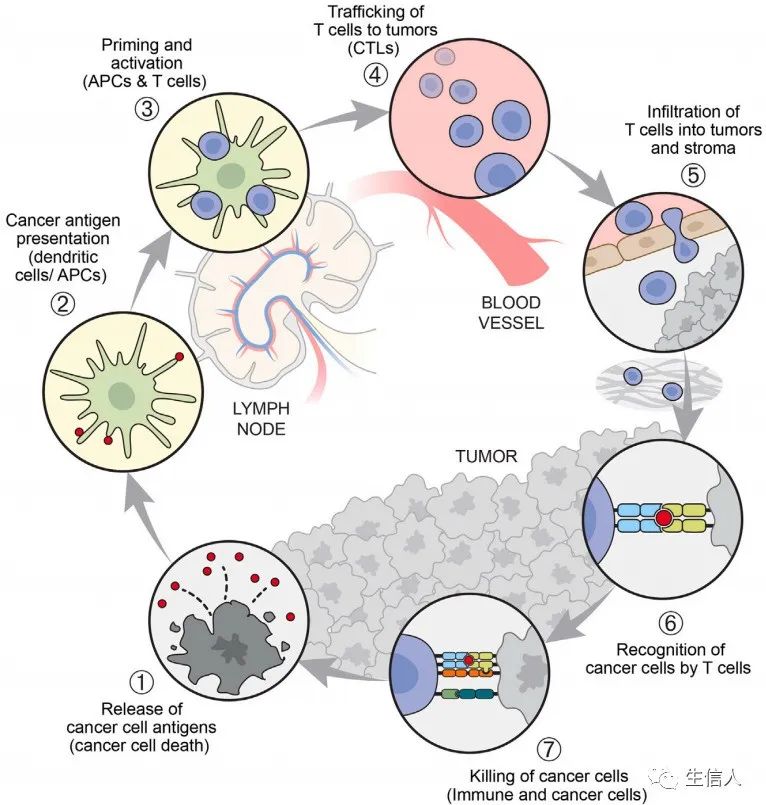
癌症免疫疗法的出现彻底改变了肿瘤学的临床实践和我们对癌症生物学的理解。目前的免疫治疗药物主要针对T细胞,然而,2013年提出的癌症免疫循环表明, T细胞自身既不反应也不发挥作用, 而是存在于一系列CI循环的步骤中(图1)。这些步骤相互关联,意味着 任何单个步骤都有可能限制产生最佳免疫力的速率,以及成功的抗癌免疫力有可能在反应过程中自我强化。 接下来,文章总结了该循环中每个步骤的研究进展,以及未来面对的挑战和机遇。
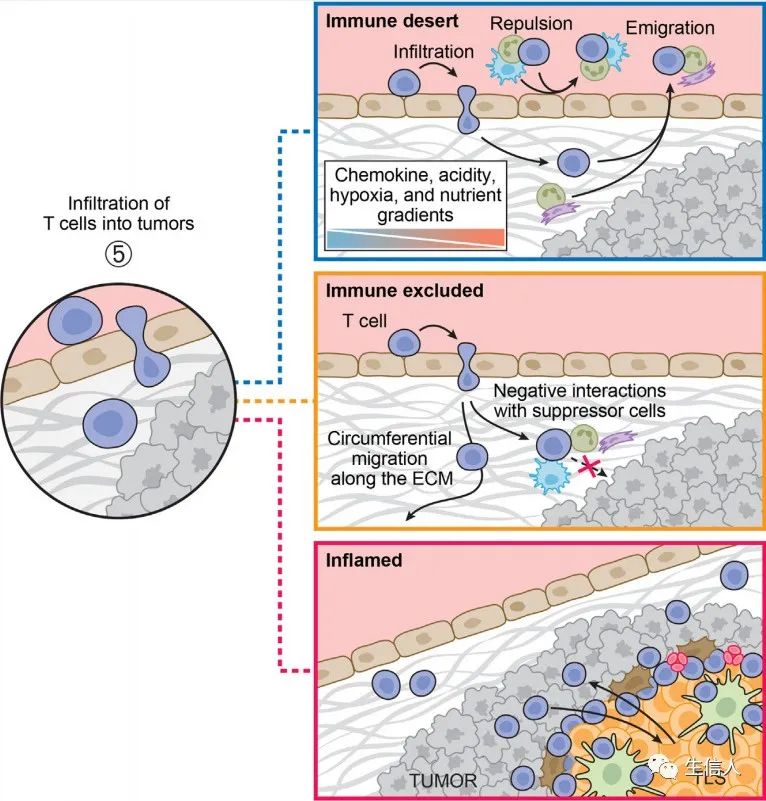
肿瘤有三种经典的免疫分型:免疫浸润型 (肿瘤内部有丰富的免疫浸润)、 免疫排斥型 (T细胞浸润仅存在于肿瘤间质而非实质)和 免疫沙漠型 (几乎不存在免疫浸润)(图2)。多数患者的治疗反应发生在肿瘤表现出浸润免疫型时,因此,揭示这些免疫表型的发生机制对于免疫疗法的开发至关重要。此外,作者还指出将肿瘤简单地分为“热”或“冷”具有误导性。
肿瘤基质或肿瘤微环境(TME) 在决定免疫类型和肿瘤轨迹方面发挥着关键作用,先天免疫系细胞和非免疫细胞协同形成富含胶原的纤维化基质,通过抑制T细胞功能和物理限制它们向肿瘤的迁移来 抑制T细胞免疫 。然而,TME还可以通过产生肿瘤周围淋巴聚集体或三级淋巴结构 (TLSs) 促进抗癌免疫 。
肿瘤中的T细胞功能障碍通常与耗竭T(Tex)细胞的积累有关 ,Tex细胞的特征是PD-1、 LAG3、TIM3和TIGIT等多种共抑制受体(免疫检查点受体)的表达增加,这些受体也是T细胞激活的标记。目前,大家普遍认为阻断共抑制受体与各自受体的结合将逆转T细胞耗竭状态,恢复抗肿瘤活性,然而,Tex细胞却无法轻易逆转。因此,检查点阻断可能并不是为了逆转耗竭,而是为了防止耗竭表型的发展,并且在T细胞终末分化的较早时间发挥作用。研究发现, DCs不仅是在CI循环早期启动T细胞反应的关键,而且对于T细胞反应的维持也至关重要 。
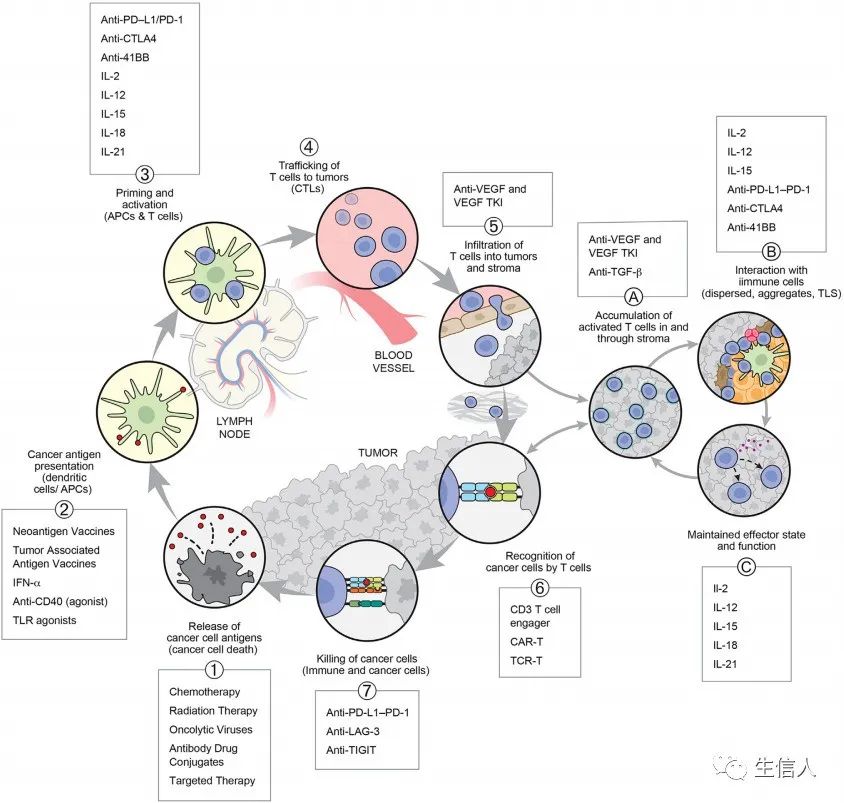
基于上述,有必要考虑将TME(尤其是DCs)在调节和维持抗肿瘤 T细胞反应中的关键作用纳入CI循环。如图3所示,作者在 CI循环的第5步引入了一个子循环 ,引流淋巴结(dLN)衍生的T细胞进入肿瘤后会遇到散布在肿瘤实质内的抗原呈递细胞,然后T细胞可能会扩增和分化,直接杀死肿瘤细胞。
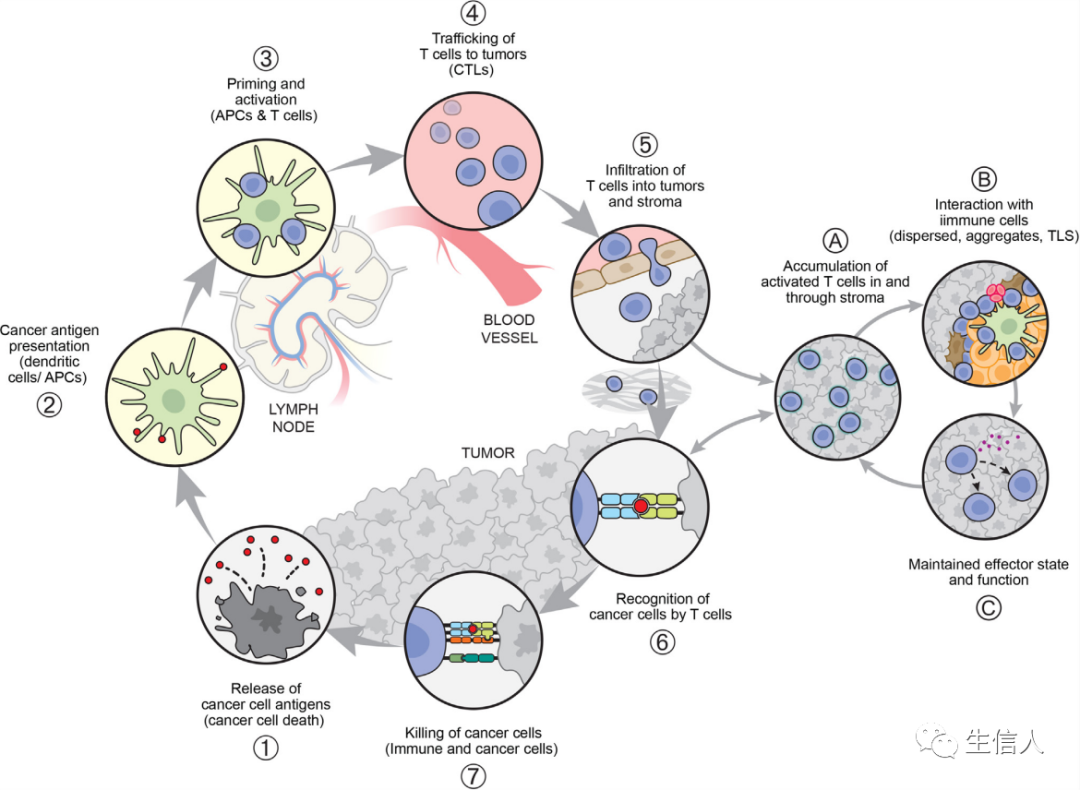
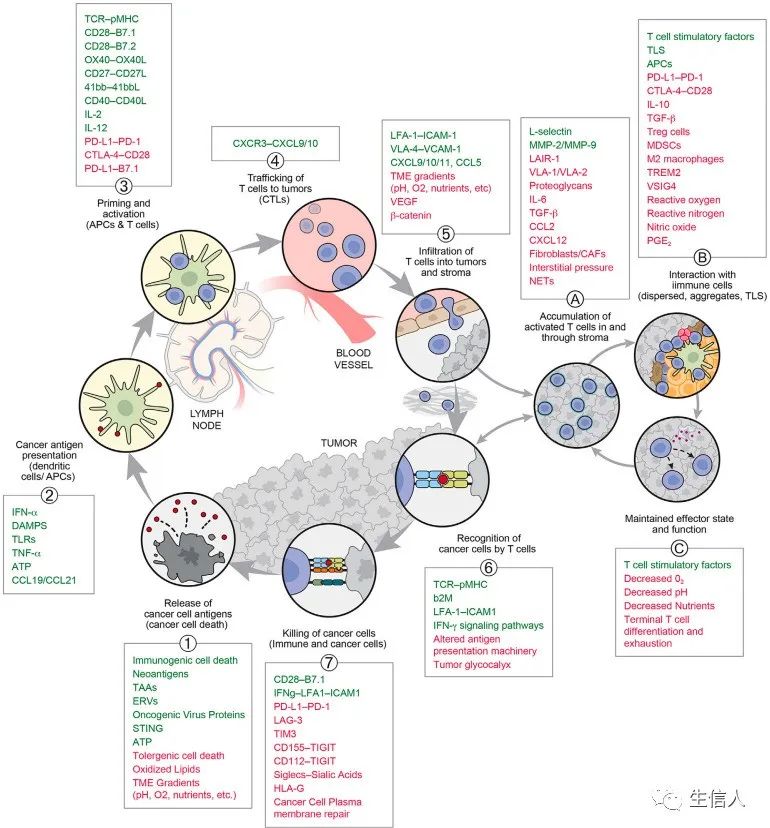
图4列出了一些已知的会影响CI循环或子循环中T细胞功能的分子或相互作。
癌相关成纤维细胞(CAFs)在TME的机制构建中起着关键作用,影响癌症的肿瘤起始、代谢、进展和转移、抗癌免疫、血管生成、药物渗透和治疗反应等过程。scRNA-seq将CAFs分为三类:肌纤维母细胞CAF (myCAFs)、促炎CAF (iCAFs) 和抗原呈递CAF (apCAFs)。 MyCAFs 是主要亚型,可产生大量细胞外基质 (ECM) 和其他纤维化相关分子,myCAFs还具有免疫调节作用,表现出抑制和分隔CD8 T细胞和其他免疫细胞的潜力; iCAFs 产生多种细胞因子和趋化因子,发挥免疫抑制作; apCAFs 除表达免疫调节因子外,也表达较高水平的MHC II 类分子并诱导招募Treg细胞。
同一CAF 亚型可能在不同的环境中表现出肿瘤促进或肿瘤抑制功能,表明还需要其他的机制研究来系统地阐明这些细胞的潜在功能和发育复杂性。在临床数据中,myCAFs与患者生存率降低以及对化疗、免疫和肿瘤靶向治疗的反应不佳相关。
骨髓细胞是实体癌中除癌细胞外最丰富的细胞类型,巨噬细胞、单核细胞和未成熟的骨髓细胞比例占据了TME中近一半的细胞比例。肿瘤相关骨髓细胞与患者生存率低和抗癌治疗缺乏反应有关,肿瘤相关巨噬细胞 (TAM) 是胚胎来源的组织驻留巨噬细胞以及源自循环骨髓单核细胞的巨噬细胞的混合物,TAM比周围正常组织的巨噬细胞更具异质性。TAM具有促肿瘤和抗肿瘤功能,表现出促肿瘤特性的TAM数量远远多于抗肿瘤TA。 TAM的抗肿瘤功能包括杀伤和吞噬肿瘤细胞、MHC类II抗原呈递和促炎细胞因子的表达,TAM的促肿瘤功能包括表达促血管生成的因子、ECM重塑和通过诱导Treg细胞抑制抗肿瘤免疫。 由于巨噬细胞区室的巨大、发育复杂性以及对癌细胞和抗肿瘤免疫的影响, 打破癌症治疗的功效上限可能需要采取针对骨髓细胞的策略, 实际上,多种基于TAM的治疗方法也正在开发中。
肿瘤细胞本身也具有抑制T细胞免疫的能力 ,临床前模型提出了多种相关机制,但很少有在临床中得到验证或提供新的治疗靶点。肿瘤会释放大量吲哚2,3-双加氧酶1 (IDO)等代谢物,或促进T 细胞功能所必需的氨基的消耗,这些代谢改变将创造一个显著的免疫抑制环境。
许多 肿瘤释放的TGF-β也具有免疫抑制作用 ,该细胞因子促进T细胞排斥性基质反应,促进 Treg细胞分化,并限制Treg细胞的扩增。
致癌途径的激活也可能直接或间接对抗T细胞免疫。 例如,增加 Ras/ MAPK 信号传导会减少MHC I 类基因产物的表达,从而降低肿瘤细胞攻击的敏感性。
树突状细胞(DCs) 具有强大的启动和扩增抗原特异性CD4和CD8 T细胞反应的能力。1型常规树突状细胞(cDC1)是抗癌免疫的关键, 具有刺激初始CD8 T细胞的能力。另外两个类别的DCs,cDC2与MHC II类分子的呈递和CD4反应的刺激相关,cDC3存在于肿瘤内和dLN中,可根据情况介导免疫刺激或调节功能。
DCs在肿瘤中的定位是抗癌免疫反应的主要决定因素,维持免疫和耐受之间的平衡,在癌症背景下是一把双刃剑。“免疫沙漠型”患者不存在持续的免疫反应,也 缺乏DCs浸润,这可能是产生该表型的原因。 在免疫治疗背景下,DCs表达的PD-L在控制T细胞反应中发挥重要作用,并且还可以作为比总 PD-L1 表达更有效的患者反应预测因子。 DCs在TME中不仅将抗原从肿瘤转移到dLN,而且还确保肿瘤本身抗原特异性T细胞的激活和扩增。
三级淋巴结构(TLSs)本质上是含有生发中心样结构的原始LNs,人体临床研究指出对检查点疗法的反应通常与TME中TLSs的存在有关, TLSs可能是T细胞被肿瘤相关DCs激活和扩增的位点。
TLSs的相关性表明TME除了具有免疫抑制作用外,还具有免疫刺激作用,并且DCs刺激的T 细胞不仅存在于次级淋巴器官,也是肿瘤本身的重要组成部分。DCs除了在淋巴迁移至dLN后发挥作用外,还可以原位刺激T细胞。
T细胞在dLN和TM中被启动并进一步刺激的可能性提出了有关T细胞分化和轨迹控制的重要问题。最初的假设是,T细胞激活和扩增仅发生在 dLN(CI循环的第3步)中,后来又提出,T细胞可能仅在dLN中启动或激活,而终末分化发生在肿瘤部位(CI循环第5步的“子循环”),也有可能所有这些活动可以在这两个位点发生。
最近的小鼠模型实验发现, T细胞仅在到达肿瘤后才实现终末分化 ,细胞在肿瘤水平上才开发生耗竭。这表明, 治疗性检查点抑制不会逆转而是阻止T细胞耗竭状态的发展。
目前,在接受免疫治疗后,只有不到一半的患者能够获得持久的结果。寻找预测反应的特征或了解耐药机制仍是临床研究的重点,这些因素可能是肿瘤、TME所固有的,或者是患者遗传学、微生物组、代谢或药理学状态的反映,但都必须反映CI循环中限速步骤的位置。
所有肿瘤,都表现出基本的免疫表型:免疫浸润、免疫排斥或免疫沙漠,不同的表型定义了免疫学上不同的肿瘤群体 。这些分类可能有助于识别限制或促进T细胞对肿瘤反应的因素, 虽然可能无法准确地预测对治疗的反应,但如果能够理解这些表型的基础,未来将更能更好的挖掘潜在治疗靶点。
宿主和环境因素可能会影响CI循环和患者对免疫治疗的反应。表观遗传因素和肠道微生物对免疫的影响已得到实验验证,联合用药也影响着免疫疗法的结果。
另一方面,各种癌基因靶向疗法,例如Ras-MAPK抑制剂和Cdk4/抑制剂,可以通过增加肿瘤的抗原呈递或促进T细胞功能来增强抗癌免疫反应。 了解它们在CI循环中起作用的位置有助于理解这些影响的机制。
免疫检查点抑制 (ICI),尤其是PD-L1/PD-1疗法,已在多种癌症中取得了成功,关于ICI治疗的最佳持续时间和停止治疗后的免疫记忆问题尚未得到解决。一项研究发现,ICI治疗后近期再接受PD-(L)1治疗,并无临床获益, 这种反应的丧失反映了CI循环中另一个限速步骤的发展。
PD-1和CLTA4抑制的组合在特定癌症疗效显著,但许多患者出现无法耐受的较高毒性。CLTA-4可以促进新T细胞反应的启动,也可以去除Tregs细胞, 抗CTLA可以在CI循环的两个位点发挥作用(图5)。
个性化癌症疫苗在在黑色素瘤和胰腺癌中取得了可观的治疗效果,但无法在高肿瘤负荷下发挥作用,了解限制疫苗功效的CI 循环步骤对提高其治愈机会非常重要。此外,还有许多癌症治疗的靶点以及反应机制,不同的治疗手段针对CI循环的不同阶段,因此, 构建一个清晰的CI循环框架,允许我们查看建立和维持有效抗癌反应所必须采取的步骤,对于解释复杂的临床结果至关重要。
免疫疗法开发面临的挑战反映了人类免疫的复杂性,由于TME异质性, 肿瘤免疫分型在T细胞反应调节中至关重要,更重要的是揭示CI循环中每个速率限制步骤的机制。 这些机制包括癌症内、外因素的参与,例如I类丢失或下调、新抗原丢失、多个免疫检查点的积累、TME中抑制性细胞群体的增加等,一旦我们搞清楚了这些,新的生物标志物以及治疗方法也将顺势而出,免疫疗法的发展会进入新的阶段。
Mellman I, Chen DS, Powles T, Turley SJ. The cancer-immunity cycle: Indication, genotype, and immunotype. Immunity. 2023 Oct 10;56(10):2188-2205. doi: 10.1016/j.immuni.2023.09.011. PMID: 37820582.
版权声明:本文为“乐问号”作者或机构在乐问医学上传并发布,仅代表该作者或机构观点,不代表乐问医学的观点或立场,不能作为个体诊疗依据,如有不适,请结合自身情况寻求医生的针对性治疗。
链接:http://www.lewenyixue.com/2024/10/14/30%2B%E7%BB%BC%E8%BF%B0%E8%81%9A%E7%84%A6%E8%82%BF%E7%98%A4%E7%A0%94%E7%A9%B6%E6%96%B0%E7%83%AD%E7%82%B9%EF%BC%9A%E7%99%8C%E7%97%87%E5%85%8D%E7%96%AB%E5%BE%AA/
THE END








赶快来坐沙发