谭蔚泓院士团队开发基于mRNA-LNP的体内原位CAR-M细胞疗法,增强癌症免疫治疗
实体肿瘤的 腹膜转移 是肿瘤治疗领域的重大临床挑战。 典型的细胞减灭术 (CRS) 和腹腔内热化疗 (HIPEC) 的组合仅能为肿瘤负荷极低的少数患者带来益处,对于大多数晚期腹膜肿瘤患者来说,这并不被视为一种临床选择。
免疫疗法 是应对腹膜转移的有前途的前沿方法。然而,腹膜肿瘤常常会发展出对抗免疫系统的逃逸机制,导致疾病进展和不良预后。因此,对于大多数腹膜转移患者来说,探索其他免疫疗法是一项迫切的、未被满足的临床需求。同时,腹膜转移患者的腹水中含有大量的免疫细胞 (其中巨噬细胞约占45%) 。在肿瘤微环境 (TME) 中,肿瘤相关巨噬细胞 (TAM) 大致分为促炎M1型或促肿瘤M2型,在临床试验中,高水平的M2型TAM浸润常与不良预后和免疫治疗耐药相关。
因此,改变巨噬细胞表型或功能以增强针对实体瘤的免疫应答的方法正在研究中。 特别是 CAR-巨噬细胞 (CAR-M)对靶细胞表现出明显的吞噬活性,并且容易穿透实体瘤,在临床前实体瘤模型中显示出降低肿瘤负荷和延长总生存期的效果。然而,与FDA批准的CAR-T细胞疗法相似,CAR-M同样涉及复杂且昂贵的制造工艺,加上涉及病毒载体的致癌风险,限制了更多患者从CAR-M疗法中获益。
近日,中国科学院杭州医学研究所 谭蔚泓 院士、 谢斯滔 研究员和 刘湘圣 研究员等在预印本平台 bioRxiv 上发表了题为: Intraperitoneal programming of tailored CAR macrophages via mRNA-LNP to boost cancer immunotherapy 的研究论文。
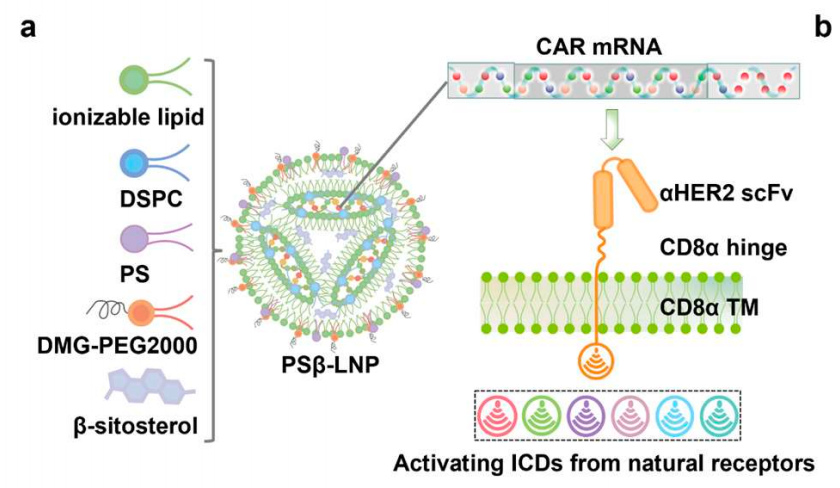
该研究探索了36种包含不同 巨噬细胞 胞内域 (ICD) 的 CAR组合,利用巨噬细胞靶向的
mRNA-LNP系统 , 实现了肿瘤免疫治疗所需的 CAR-M细胞的体内原位高效构建 。 在实体瘤小鼠模型中,CAR-M细胞的腹腔内编程可引起稳健的适应性免疫系统激活,并且在耐药模型中与标准治疗PD-1/PD-L1免疫检查点阻疗法发挥显著的协同作用。
为了解决上述难题,研究人员开始尝试通过非病毒纳米载体在体内原位制备CAR-M细胞,直接治疗实体瘤。此外,目前对巨噬细胞的胞内域 (ICD) 的结构研究主要集中在CD3ζ信号转导上。然而,仅仅依赖CD3ζ并不能完全发挥巨噬细胞的多功能特性,用于肿瘤免疫疗法。因此,通过CAR途径系统性地研究与巨噬细胞相关的信号通路的合理设计、组合及其生物学效应是必要的。
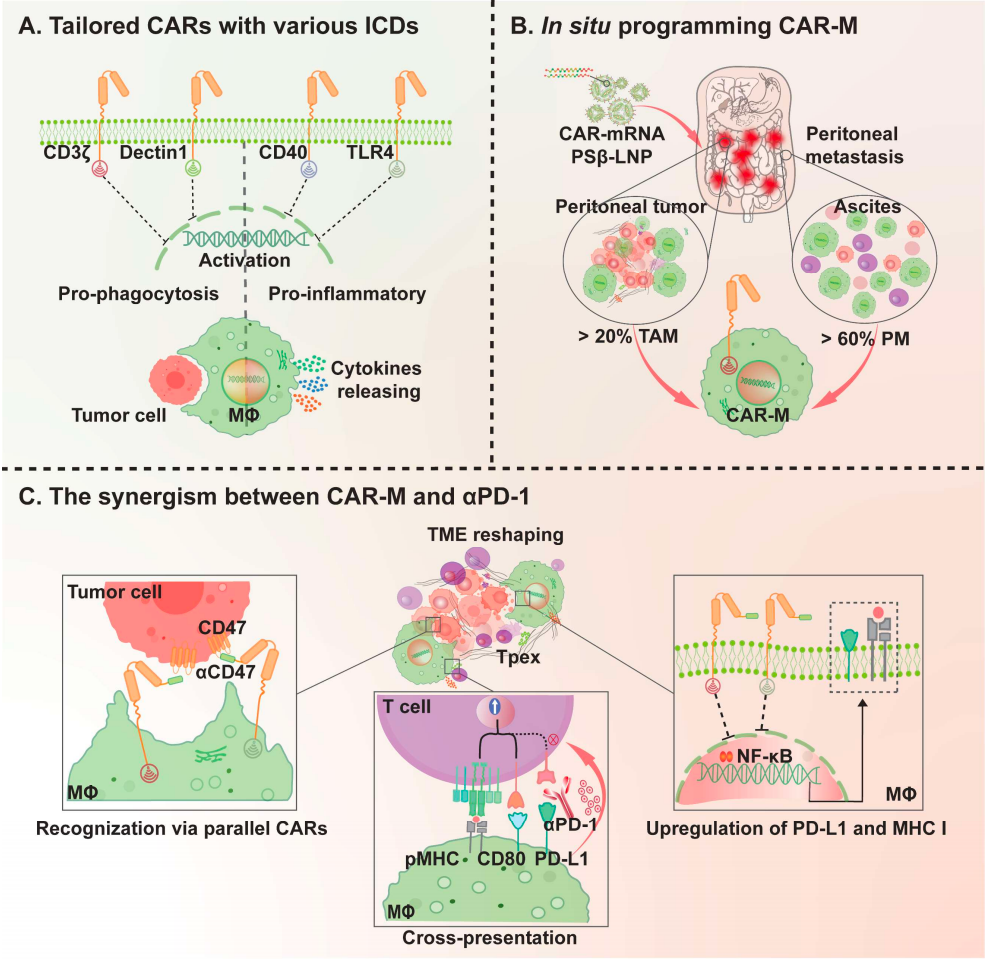
在这项研究中,研究团队分析了含有不同 胞内域 (吞噬:CD3ζ和Dectin1;促炎:CD40和TLR4;可能效应物:CD46和CFS2R) 的36种CAR组合对体外和体内巨噬细胞的生物学影响。
通过开发巨噬细胞靶向的mRNA-LNP递送系统,研究团队实现了肿瘤免疫治疗所需的CAR-M细胞的体内原位高效构建。
在两种同系实体瘤小鼠模型中,CAR-M腹腔内编程可引起稳健的适应性免疫系统激活,并且在耐药模型中与标准治疗PD-1/PD-L1免疫检查点阻疗法发挥显著的协同作用。通过全面的单细胞RNA测序 (scRNA-seq) 进一步分析表明,同时用CD3ζ和TLR4在体内编程CAR-M可以显著促进巨噬细胞从M2促癌表型向M1促炎表型的转变,通过干扰NF-κB通路以上调PD-L1和MHC I表达。同时,该研究还发现,CAR-M细胞重塑了免疫抑制性的肿瘤微环境,从而提高了TCF1 + PD-1 + 祖细胞耗竭的CD8 T细胞 (T pex ) 的数量。此外,siRNA介导的PD-L1敲低和CAR-M细胞之间的协同作用突出了巨噬细胞上PD-L1表达在抗原交叉呈递过程中的关键作用,强调了在抗原交叉呈递中阻断PD-1/PD-L1信号轴的必要性。
总的来说,该研究开发了一种mRNA-LNP递送系统,用于体内靶向定制CAR-M的腹腔编程,并进一步加深了对CAR-M疗法治疗实体瘤的调控和反馈机制的理解.
https://www.biorxiv.org/content/10.1101/2024.07.30.605730v1
版权声明:本文为“乐问号”作者或机构在乐问医学上传并发布,仅代表该作者或机构观点,不代表乐问医学的观点或立场,不能作为个体诊疗依据,如有不适,请结合自身情况寻求医生的针对性治疗。
链接:http://www.lewenyixue.com/2024/10/14/%E8%B0%AD%E8%94%9A%E6%B3%93%E9%99%A2%E5%A3%AB%E5%9B%A2%E9%98%9F%E5%BC%80%E5%8F%91%E5%9F%BA%E4%BA%8EmRNA-LNP%E7%9A%84/
THE END