Int Immunopharmacol | NGS揭示广泛期小细胞肺癌免疫联合化疗标志物
广泛期小细胞肺癌(ES-SCLC)已经全面进入免疫治疗时代,免疫联合化疗的模式可显著改善ES-SCLC患者的生存和预后,但受益人群仍有待明确和优化。免疫治疗生物标志物的探索有助于富集优势人群,进一步提高ES-SCLC患者的临床获益。
南京大学医学院附属金陵医院 吕镗烽 教授 、 展平教授 团队,采用NGS和多重荧光免疫组化等技术对一线使用免疫联合化疗的ES-SCLC患者样本进行检测探索,结果表明: MCL1、STMN1、KMT2B等多个基因与ES-SCLC免疫联合治疗疗效及预后相关,同时肿瘤间质区中的CD8+ T细胞及M1型巨噬细胞的浸润增加与更差的预后相关 。研究成果已于近日发表 International Immunopharmacology 。

研究共入组24例接受一线免疫联合化疗的ES-SCLC患者,根据患者生存获益情况,划分为长生存组(OS超过24个月,n=11)和短生存组(OS小于9个月,n=13)。收集患者样本进行NGS,多重荧光免疫组化(mIHC)和免疫组化检测,多维度探索ES-SCLC患者免疫联合化疗的生物标志物。
NGS大Panel有助于发现ES-SC LC患者免疫治疗生物标志物
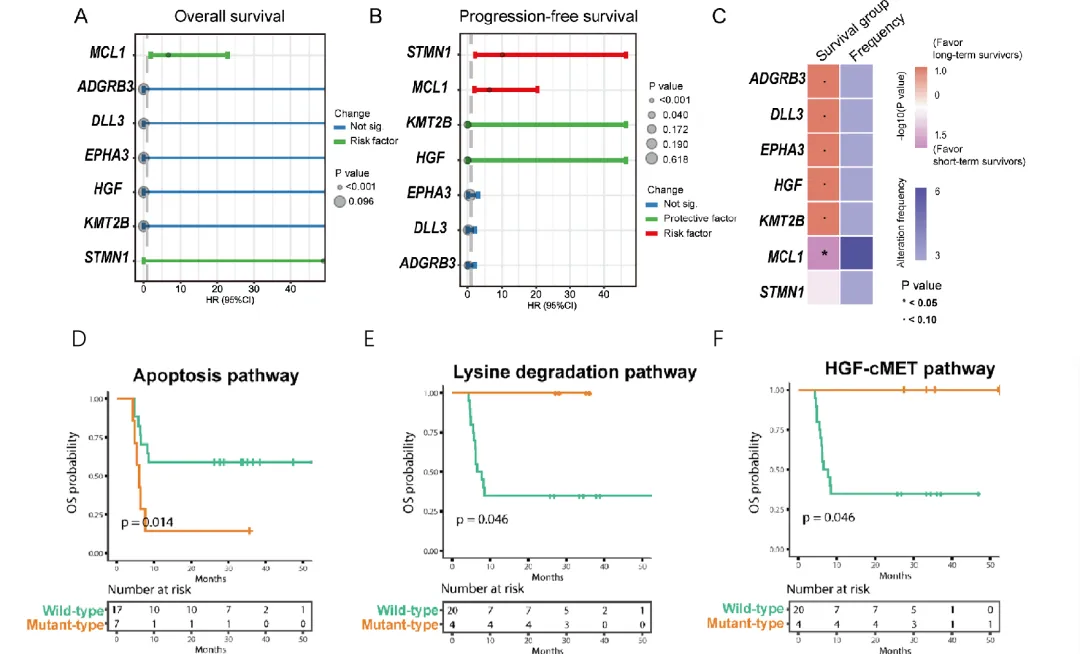
通过大Panel检测发现 MCL1、STMN1、KMT2B、HGF、DLL3、EPHA3和ADGRB3 共7个基因的变异与ES-SCLC免疫治疗的疗效及预后相关 (图1A, B)。
其中, MCL1基因和STMN1基因拷贝数扩增患者OS和PFS均显著更短,KMT2B基因和HGF基因突变患者OS和PFS显著延长 。此外, DLL3基因、EPHA3基因和ADGRB3基因突变仅与更长的OS相关 。在长/短生存组中比较以上七个基因的突变频率,STMN1基因扩增频率在组间无差异,MCL1基因扩增在短生存组中显著富集,KMT2B等基因在长生存组中显著富集(图1C)。
从通路层面分析, MCL1基因相关的细胞凋亡通路与更短的OS相关、KMT2B基因相关的赖氨酸降解通路及HGF基因相关的HGF-cMET通路突变患者OS显著延长 (图1 D-F)。此外,从样本层面分析,TMB-H和CIN-L与更佳的预后相关(图1 G-H),PD-L1表达与ES-SCLC患者免疫联合化疗无显著关联。
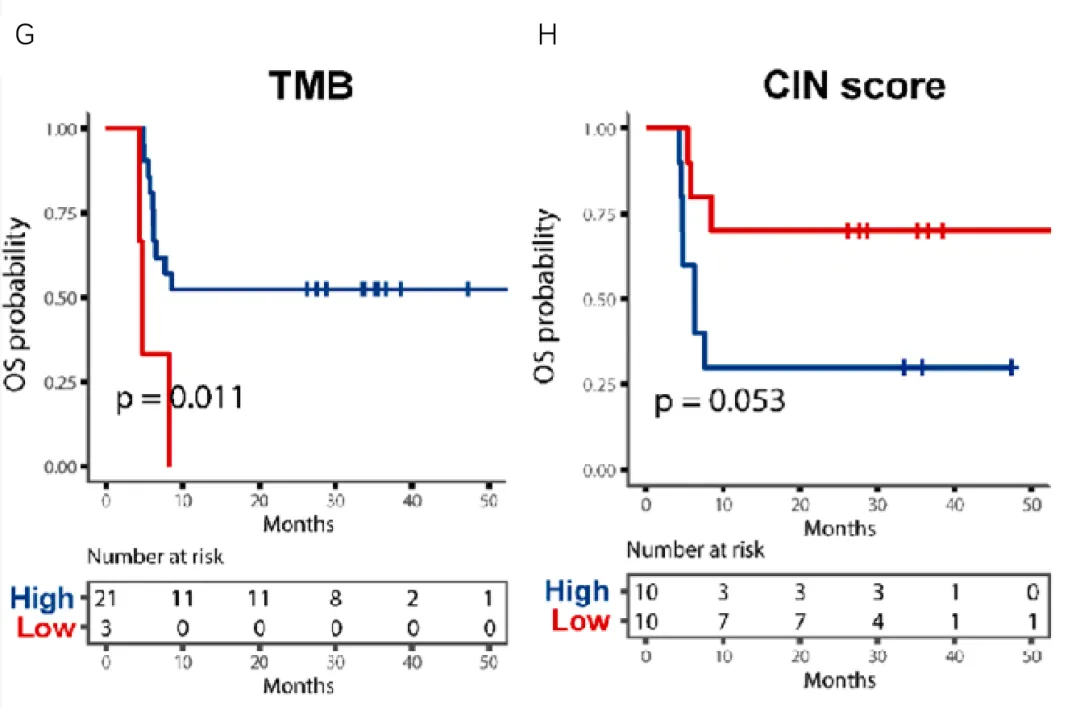
图1. 基因突变与患者生存的相关性
A, B)分别为单因素cox回归分析发现的可提示OS和PFS的七个基因变异情况;(C)除STMN1基因扩增在组间无差异外,另外六个基因在长/短生存组中的分布具有显著差异;(D, E, F)分别为MCL1基因相关的细胞凋亡通路、KMT2B基因相关的赖氨酸降解通路及HGF基因相关的HGF-cMET通路突变与OS的相关性;(G)TMB-H与更佳的预后相关;(H)CIN-L与更佳的预后相关
间质区CD8+ T细胞和M1型巨噬细胞浸润增加与较差的预后相关
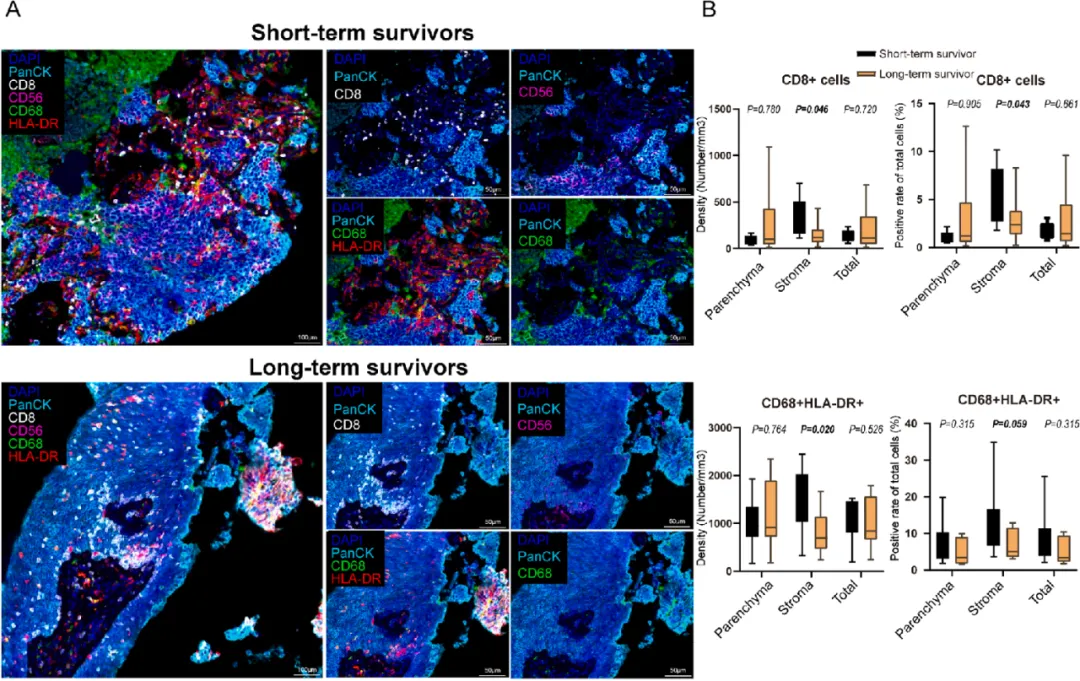
基于mIHC分析得到的四种经典免疫细胞(CD8+ T细胞、CD56dim+和CD56bright+ NK细胞,以及M1型和M2型巨噬细胞)分布情况如图2A所示。与短生存期患者相比, 长生存期患者在肿瘤间质区显示出更低密度和比例的CD8+ T细胞和M1型巨噬细胞 (图2B)。生存分析结果证实, 肿瘤间质区中CD8+ T细胞和M1型巨噬细胞浸润程度高与较差的预后相关 。
图2. 多重免疫荧光的免疫细胞浸润与预后间的关系
广 A)多重免疫荧光图像显示短生存组和长生存组间免疫细胞差异;(B)短生存组间质区中CD8+ T细胞和M1巨噬细胞的密度和比例大于长生存组
综上所述,该研究评估了不同变异及免疫微环境状态对一线免疫联合化疗预后的提示价值。这些发现有助于筛选从免疫联合化疗治疗中获益的ES-SCLC患者,并为未来治疗策略的精准化提供新的视角。
版权声明:本文为“乐问号”作者或机构在乐问医学上传并发布,仅代表该作者或机构观点,不代表乐问医学的观点或立场,不能作为个体诊疗依据,如有不适,请结合自身情况寻求医生的针对性治疗。
链接:http://www.lewenyixue.com/2024/09/29/Int%20Immunopharmacol%20/
THE END









赶快来坐沙发