Adv Sci丨上海交通大学薛婧/唐玉杰/孙勇伟合作发现SIN3B缺失促进胰腺癌的免疫治疗
尽管某些实体肿瘤的免疫疗法取得了重大进展,但胰腺导管腺癌(PDAC)仍然对此类干预措施反应不佳,这主要是因为其高度免疫抑制的肿瘤微环境(TME)具有有限的CD8 +T细胞浸润。
2024年9月24日,上海交通大学薛婧、唐玉杰、孙勇伟共同通讯在 Advanced Science 在线发表题为 “ SIN3B Loss Heats up Cold Tumor Microenvironment to Boost Immunotherapy in Pancreatic Cancer ”的研究论文。 该研究探讨了表观遗传因子Sin3B在PDAC TME中的作用。
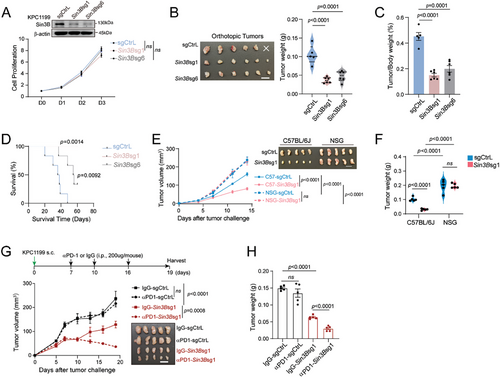
使用小鼠PDAC模型,作者发现肿瘤细胞内在的Sin3B缺失会重塑TME,增加CD8 + T细胞浸润和细胞毒性,从而阻碍肿瘤进展并增强对抗PD1治疗的敏感性。Sin3B缺陷的肿瘤细胞在响应干扰素-γ(IFNγ)时表现出CXCL9/10分泌增加,通过CXCL9/10-CXCR3轴形成正反馈回路,从而增强对PDAC的抗肿瘤免疫反应。从机制上看,Sin3B缺失揭示了广泛的表观遗传调控,特别是PDAC细胞中与免疫反应相关的基因上H3K27Ac分布增强。与小鼠模型的发现一致,对人类PDAC样本的分析显示SIN3B水平与CD8 +T细胞浸润和CXCL9/10表达之间存在显著的负相关性。值得注意的是,SIN3B表达较低的PDAC患者对抗PD1疗法的反应更为有利。 研究结果表明,靶向SIN3B可以增强细胞毒性T细胞向肿瘤部位的浸润并提高PDAC的免疫治疗效果,为这种具有挑战性的疾病的治疗生物标志物或靶标提供了潜在途径。
 旨在阻止通过PD-1或CTLA-4通路的免疫逃避的免疫疗法已被证明对多种恶性肿瘤(如黑色素瘤、非小细胞肺癌和肾细胞癌)具有显著疗效。 尽管如此,大多数患者对免疫检查点阻断(ICB)疗法没有反应。因此,了解低免疫反应微环境形成的基础并探索增强肿瘤对免疫疗法敏感性的新靶点至关重要。最近的研究强调了肿瘤细胞内内在染色质调节剂在塑造免疫肿瘤微环境(TIME)方面的关键作用(例如EZH2、SETDB1和ASF1A)。此外,最近有研究表明,抑制表观遗传调节因子(如SETDB1、KDM5B和PHF8)与增强对免疫疗法的反应性有关。 这些发现表明,整合表观遗传疗法可能会增强ICB疗法的有效性,为癌症治疗提供一条有希望的途径。
最近,Gabriel等人使用小鼠肿瘤模型进行了体内表观遗传CRISPR筛选,以系统地识别影响肿瘤免疫和ICB疗法疗效的染色质调节因子。 值得注意的是,Sin3B成为此次筛选中的潜在候选基因之一。Sin3B已被证明具有双重功能,既可作为靶基因转录的激活剂,又可作为靶基因转录的抑制剂,从而控制多种细胞和生物过程。这些包括细胞周期调控、衰老、胚胎发育和干细胞分化等关键途径。早期研究表明,Sin3B表达在癌前病变中升高,这是致癌Kras诱导的体内衰老所必需的。 然而,Sin3B在肿瘤免疫逃避中的作用仍未被探究。
SIN3B协调抗肿瘤免疫来调节体内胰腺肿瘤的生长。(图源自 Advanced Science )
胰腺导管腺癌(PDAC)以其高度免疫抑制的肿瘤微环境(TME)而闻名,其特点是抑制性髓系细胞群丰富、肿瘤免疫原性降低和细胞毒性T细胞浸润稀少。 这些因素共同导致了PDAC TME的免疫“冷”性质,对免疫疗法的成功提出了重大挑战。在作者的研究中,作者揭示了Sin3B在塑造肿瘤内免疫景观方面的新作用,特别是在PDAC中。 在小鼠PDAC模型中,作者发现肿瘤细胞内SIN3B的内在缺失通过增加IFNγ诱导的趋化因子CXCL9和CXCL10的分泌来增强CD8 + T细胞浸润。这导致通过CXCL9/10-CXCR3轴的正反馈回路,将PDAC微环境从“冷”转变为“热”。
作 者的研究结果还表明,缺乏Sin3B的PDAC对抗PD1疗法的反应性更强。 对人类PDAC样本的分析一致表明,SIN3B表达与CD8 + T细胞浸润和CXCL9/10表达之间存在显著的负相关性。值得注意的是,SIN3B表达较低的PDAC患者对抗PD1疗法的反应更为有利。从机制上讲,Sin3B缺乏会破坏SIN3B-HDAC1/2复合物,从而改变H3K27Ac的分布,特别是在干扰素刺激基因(如Cxcl10)的启动子区域,从而增强其表达。 总体而言,作者的研究将SIN3B确定为一种潜在的治疗靶点,可在具有挑战性的PDAC环境中改善细胞毒性T细胞对肿瘤微环境的可及性并增强免疫疗法的疗效。
https://onlinelibrary.wiley.com/doi/10.1002/advs.202402244
旨在阻止通过PD-1或CTLA-4通路的免疫逃避的免疫疗法已被证明对多种恶性肿瘤(如黑色素瘤、非小细胞肺癌和肾细胞癌)具有显著疗效。 尽管如此,大多数患者对免疫检查点阻断(ICB)疗法没有反应。因此,了解低免疫反应微环境形成的基础并探索增强肿瘤对免疫疗法敏感性的新靶点至关重要。最近的研究强调了肿瘤细胞内内在染色质调节剂在塑造免疫肿瘤微环境(TIME)方面的关键作用(例如EZH2、SETDB1和ASF1A)。此外,最近有研究表明,抑制表观遗传调节因子(如SETDB1、KDM5B和PHF8)与增强对免疫疗法的反应性有关。 这些发现表明,整合表观遗传疗法可能会增强ICB疗法的有效性,为癌症治疗提供一条有希望的途径。
最近,Gabriel等人使用小鼠肿瘤模型进行了体内表观遗传CRISPR筛选,以系统地识别影响肿瘤免疫和ICB疗法疗效的染色质调节因子。 值得注意的是,Sin3B成为此次筛选中的潜在候选基因之一。Sin3B已被证明具有双重功能,既可作为靶基因转录的激活剂,又可作为靶基因转录的抑制剂,从而控制多种细胞和生物过程。这些包括细胞周期调控、衰老、胚胎发育和干细胞分化等关键途径。早期研究表明,Sin3B表达在癌前病变中升高,这是致癌Kras诱导的体内衰老所必需的。 然而,Sin3B在肿瘤免疫逃避中的作用仍未被探究。
SIN3B协调抗肿瘤免疫来调节体内胰腺肿瘤的生长。(图源自 Advanced Science )
胰腺导管腺癌(PDAC)以其高度免疫抑制的肿瘤微环境(TME)而闻名,其特点是抑制性髓系细胞群丰富、肿瘤免疫原性降低和细胞毒性T细胞浸润稀少。 这些因素共同导致了PDAC TME的免疫“冷”性质,对免疫疗法的成功提出了重大挑战。在作者的研究中,作者揭示了Sin3B在塑造肿瘤内免疫景观方面的新作用,特别是在PDAC中。 在小鼠PDAC模型中,作者发现肿瘤细胞内SIN3B的内在缺失通过增加IFNγ诱导的趋化因子CXCL9和CXCL10的分泌来增强CD8 + T细胞浸润。这导致通过CXCL9/10-CXCR3轴的正反馈回路,将PDAC微环境从“冷”转变为“热”。
作 者的研究结果还表明,缺乏Sin3B的PDAC对抗PD1疗法的反应性更强。 对人类PDAC样本的分析一致表明,SIN3B表达与CD8 + T细胞浸润和CXCL9/10表达之间存在显著的负相关性。值得注意的是,SIN3B表达较低的PDAC患者对抗PD1疗法的反应更为有利。从机制上讲,Sin3B缺乏会破坏SIN3B-HDAC1/2复合物,从而改变H3K27Ac的分布,特别是在干扰素刺激基因(如Cxcl10)的启动子区域,从而增强其表达。 总体而言,作者的研究将SIN3B确定为一种潜在的治疗靶点,可在具有挑战性的PDAC环境中改善细胞毒性T细胞对肿瘤微环境的可及性并增强免疫疗法的疗效。
https://onlinelibrary.wiley.com/doi/10.1002/advs.202402244

— END—
版权声明:本文为“乐问号”作者或机构在乐问医学上传并发布,仅代表该作者或机构观点,不代表乐问医学的观点或立场,不能作为个体诊疗依据,如有不适,请结合自身情况寻求医生的针对性治疗。
链接:http://www.lewenyixue.com/2024/09/29/Adv%20Sci%E4%B8%A8%E4%B8%8A%E6%B5%B7%E4%BA%A4%E9%80%9A%E5%A4%A7%E5%AD%A6%E8%96%9B%E5%A9%A7-%E5%94%90%E7%8E%89%E6%9D%B0/
THE END






 未来|指南共识|广东省药学会发布《医疗机构药品费用科学管理(DES)专家共识》
未来|指南共识|广东省药学会发布《医疗机构药品费用科学管理(DES)专家共识》
赶快来坐沙发