锁定二区,公开数据库纯生信聚焦肿瘤转移前微环境
癌细胞的转移受其固有特性和肿瘤微环境(TME)的影响,然而,乳腺癌淋巴结前转移的分子机制仍不清楚。 一项最新研究通过54个样本的216963个细胞,全面分析了乳腺癌淋巴结前转移瘤内异质性和肿瘤微环境重塑的单细胞景观,为乳腺癌转移的潜在机制提供新见解。
一、研究背景:
在全球范围内,乳腺癌仍然是女性最常见的恶性肿瘤之一。据估计,大约20-30%的乳腺癌病例在诊断时有转移证据,其余病例中很大一部分最终可能发展为转移性疾病。乳腺癌转移在疾病进展中发挥着重要作用,是乳腺癌患者死亡的主要原因。转移过程很复杂,涉及遗传改变、生物学过程以及与肿瘤微环境中细胞的相互作用。因此,了解乳腺癌转移的同质性并获得预防其发生和进展的新见解至关重要。
近年来,单细胞RNA测序(scRNAseq)技术通过提供对复杂细胞多样性的无与伦比的见解,彻底改变了癌症转移研究。与乳腺癌转移相关的几项scRN-seq研究主要集中在TME中的细胞上,揭示了免疫和间质景观高度异质性。重要的是要认识到癌细胞本身以及癌细胞与TME之间的相互作用在乳腺癌转移中发挥的关键作用。然而,不同癌细胞亚群的潜在转移机制及其与TME的相互作用仍未完全了解。
根据最近的研究,转移性乳腺癌患者在远处转移方面表现出异质性,其中骨转移最常见,其次是肺和肝转移,而脑转移的频率最低。鉴于癌细胞在起源、表型和功能方面的高度多样性,阐明乳腺癌转移中不同癌细胞亚型的组织倾向性或优先转移至特定器官仍然具有挑战性。此外,很少有研究调查不同癌细胞亚型在转移过程中的组织倾向性。因此,系统、深入的研究来调查不同癌细胞亚型的组织倾向性和转移机制,以及它们与TME的相互作用,对于深入了解乳腺癌转移的潜在机制至关重要。
二、主要结果
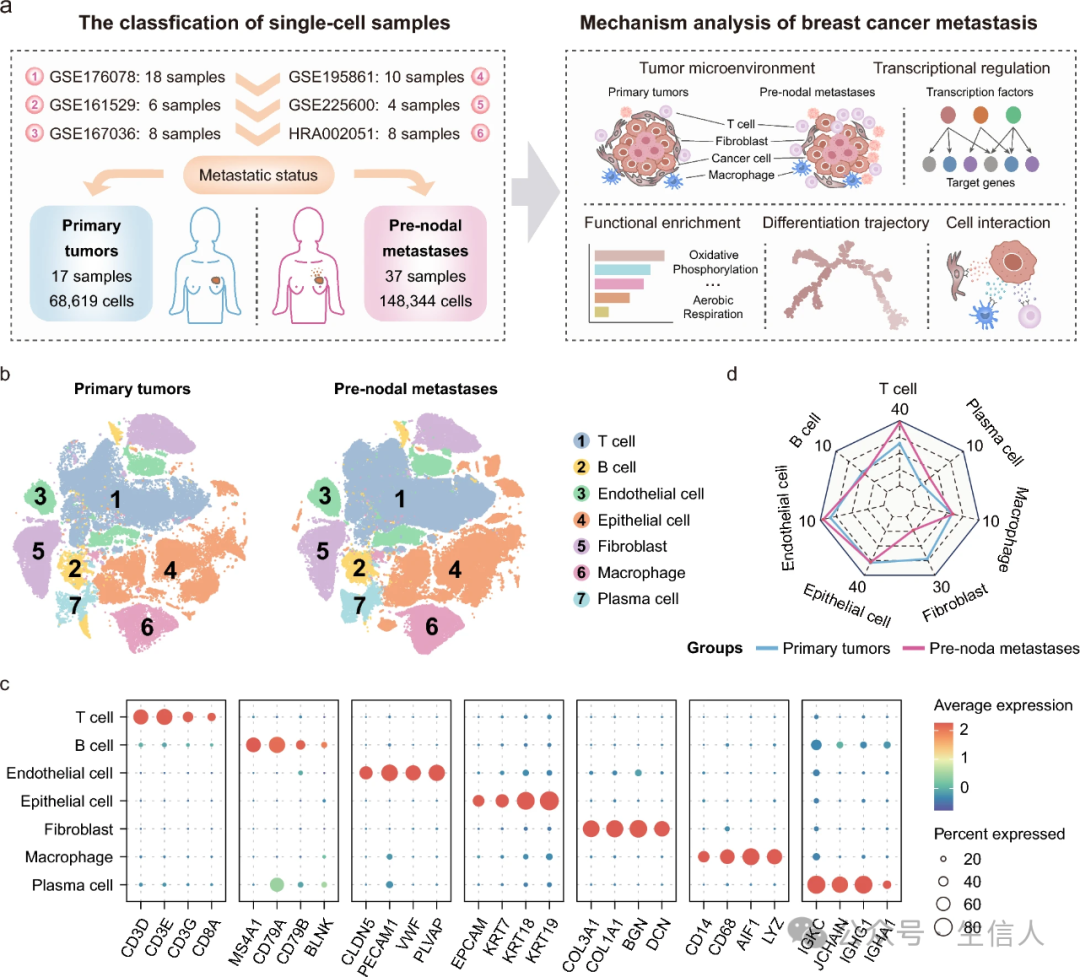
1. 原发肿瘤和淋巴结前转移之间的异质性细胞组成
为了研究乳腺癌转移和非转移的细胞多样性,研究整合了6个单细胞数据集的17个原发肿瘤样本和37个结前转移样本的数据(图1a)。经过质量控制和批量效应去除后,从原发肿瘤中总共获得了68619个细胞,从结前转移中获得了148344个细胞(图1b)。使用标准标记基因,将216963个细胞分类为七种不同的细胞类型:上皮细胞、内皮细胞、成纤维细胞、巨噬细胞、T细胞、B细胞和浆细胞(图1c)。原发肿瘤和结前转移瘤表现出相当的上皮细胞和巨噬细胞的细胞比例(图1d)。然而,与原发肿瘤相比,观察到结前转移瘤中T细胞的积聚和成纤维细胞的耗尽。此外,与原发肿瘤相比,结前转移瘤在细胞组成方面表现出更高的样本间异质性。
2. 整合与表型相关的批量数据揭示了转移性上皮细胞亚型
对67784个上皮细胞进行了重新聚类,其中包括原发肿瘤的21641个细胞和结前转移的46143个细胞(图2a)。通过Scissor整合批量数据的转移表型后,4961个细胞被鉴定为Scissor+细胞,3484个细胞被归类为Scissor-细胞(图2b)。与患者的临床信息一致,发现4961个Scissor+细胞中有4717个(95.1%)来自淋巴结转移患者。相比之下,Scissor-细胞均匀分布在原发肿瘤和结前转移瘤中。根据Scisssor的结果,将上皮细胞分为8个亚型(图2c)。Epi1-3亚型占转移性亚型的大多数,其特征是PSM 7、CRIP 1、S100 A8和S100 A9等转移标志物的表达(图2d)。之前对乳腺癌、胃癌和宫颈癌的研究表明,PIMA 7、CRIP 1、S100 A8和S100 A9的高表达增强了癌细胞的迁移和侵袭能力,从而促进肿瘤转移。GO分析表明,Epi1-3亚型特异性上调的基因显着富集于氧化磷酸化、质子动力驱动的ATP合成和有氧呼吸(图2e)。相比之下,Epi4-8亚型中上调的基因在腺体发育和伤口 愈合中丰富。
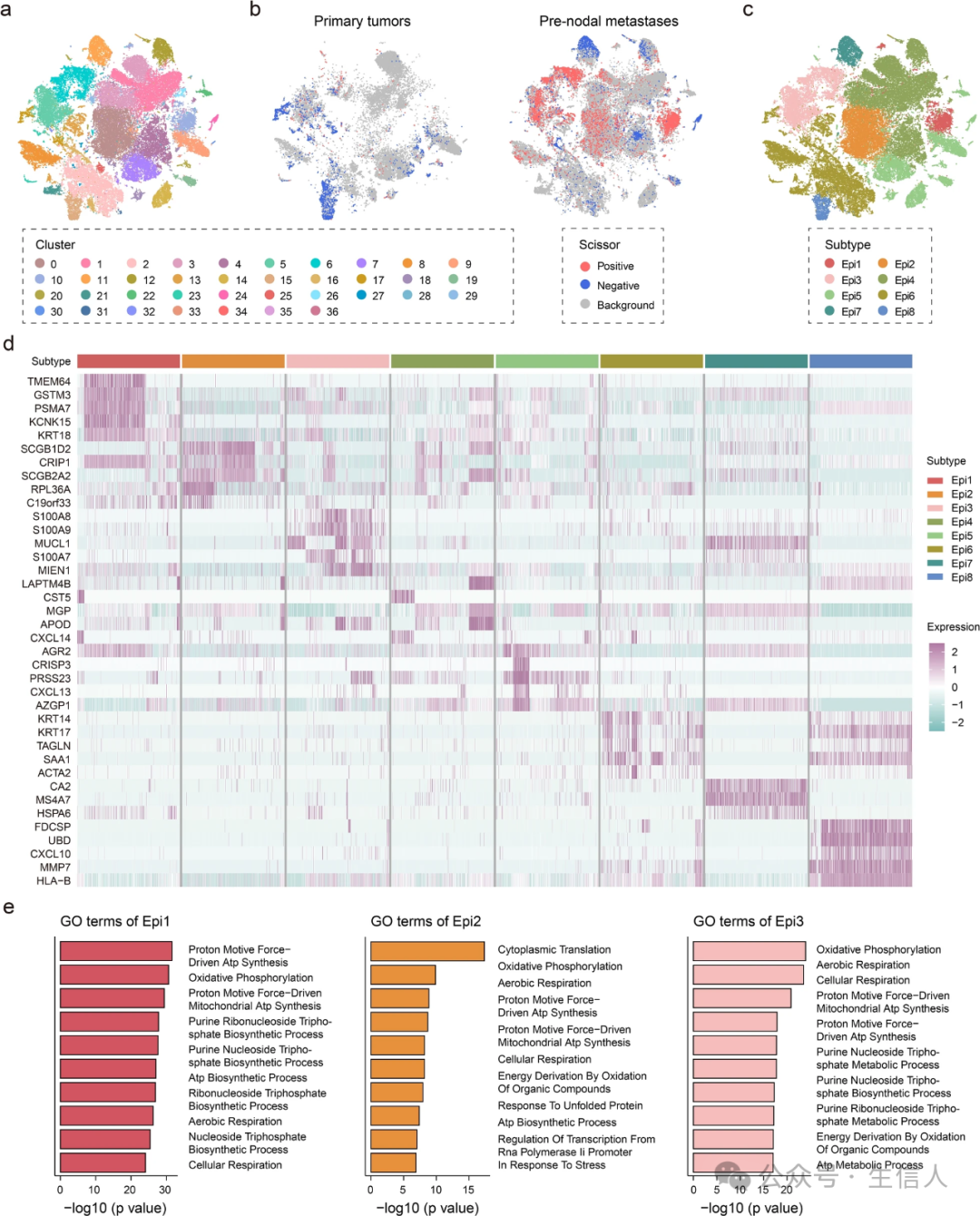 图 2 上皮细胞的重聚类分析
图 2 上皮细胞的重聚类分析 3. 转移性上皮细胞亚型表现出异质性的基因组变异
拷贝数变异(CNV)分析表明,转移性Epi1-3亚型表现出高水平的拷贝数扩增(图3a)。在非转移性上皮细胞亚型中,Epi7亚型表现出高拷贝数扩增,而Epi8亚型表现出高拷贝数缺失。值得注意的是,与Epi4-6亚型相比,Epi1-3和Epi7-8亚型都表现出更高的CNV评分(图3b)。此外,克隆性分析结果揭示了原发肿瘤和结前转移瘤之间不同的克隆进化模式(图3c)。根据进化树,发现大多数转移性上皮细胞在13号染色体上表现出拷贝数扩增。此外,在结前转移瘤的几个基因组区域中检测到了典型 CNVs ,包括染色体 8 、 12 和 20 ,这与之前调查乳腺癌淋巴结转移的研究一致。
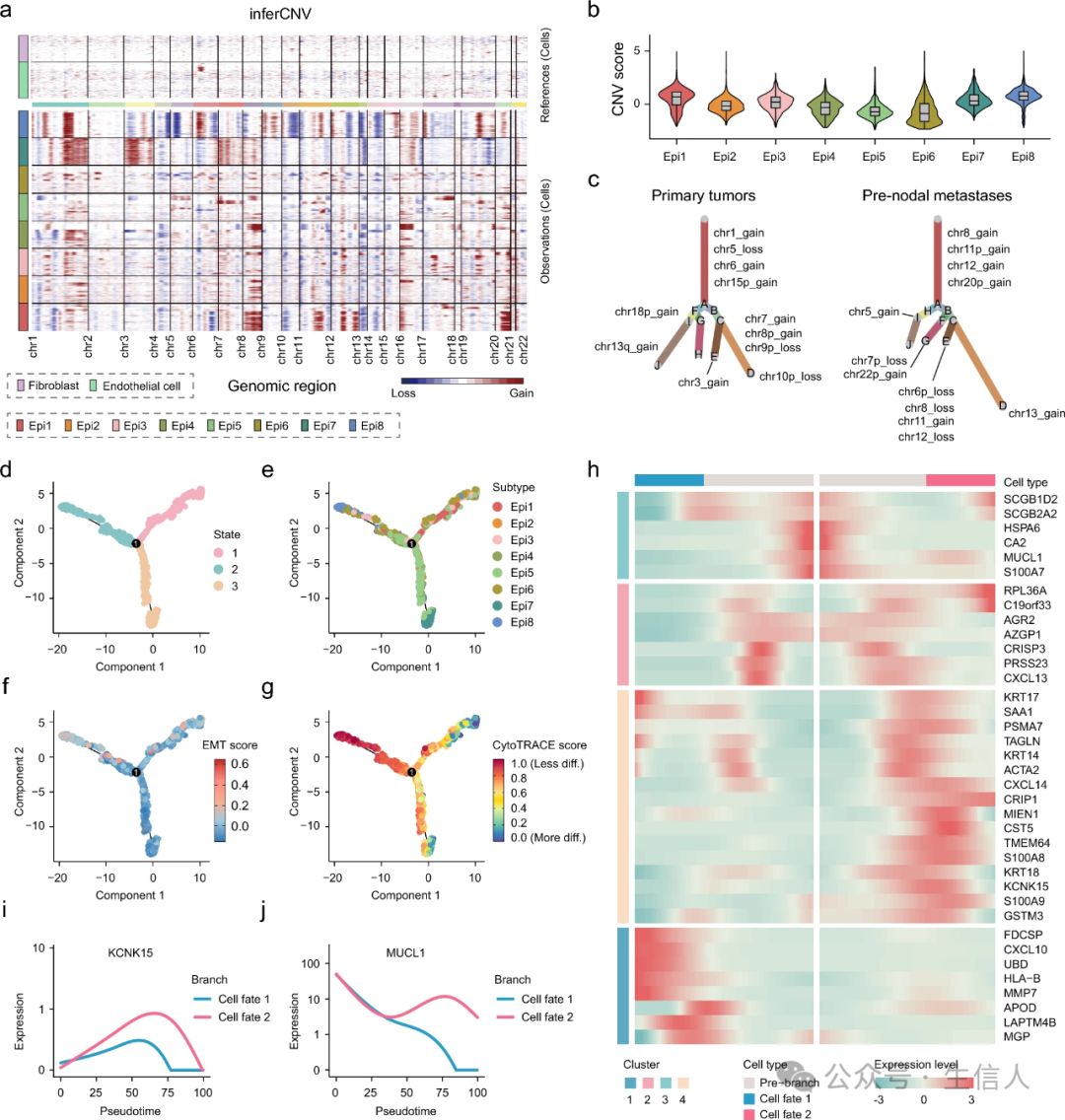 图 3 上皮细胞亚型的单细胞 CNV 分析和轨迹分析
图 3 上皮细胞亚型的单细胞 CNV 分析和轨迹分析 4. 转移性上皮细胞亚型表现出精心安排的细胞分化
研究构建了一个细胞轨迹来推断原发肿瘤和结前转移之间的分化关系。在八种上皮细胞亚型中,观察到三种不同的状态(图3d)。Epi1-3亚型主要分布在状态1中,而Epi 7亚型主要分布在状态3中(图3e)。随后,根据表皮-间充质转变(EMT)评分和CycloTRACE评分标记轨迹,其中状态3因其EMT评分低和CycloTRACE评分高而被认为是潜在的根源(图3f、g)。转移性Epi1-3亚型主导了轨迹的末端,具有很高的CycloTRACE评分,这表明转移期间上皮细胞的精心安排的分化(图3g)。使用分支表达分析建模(BEAM)分析,鉴定了37个分支依赖性基因,这些基因可以调节从分支前(状态3)到细胞命运2(状态1)和细胞命运1(状态2)的细胞分化过程(图3 h)。重要的是,观察到KCNK 15和MUCL 1的表达在推断的从分支前到细胞命运2的假定时间升高(图3i、j)。
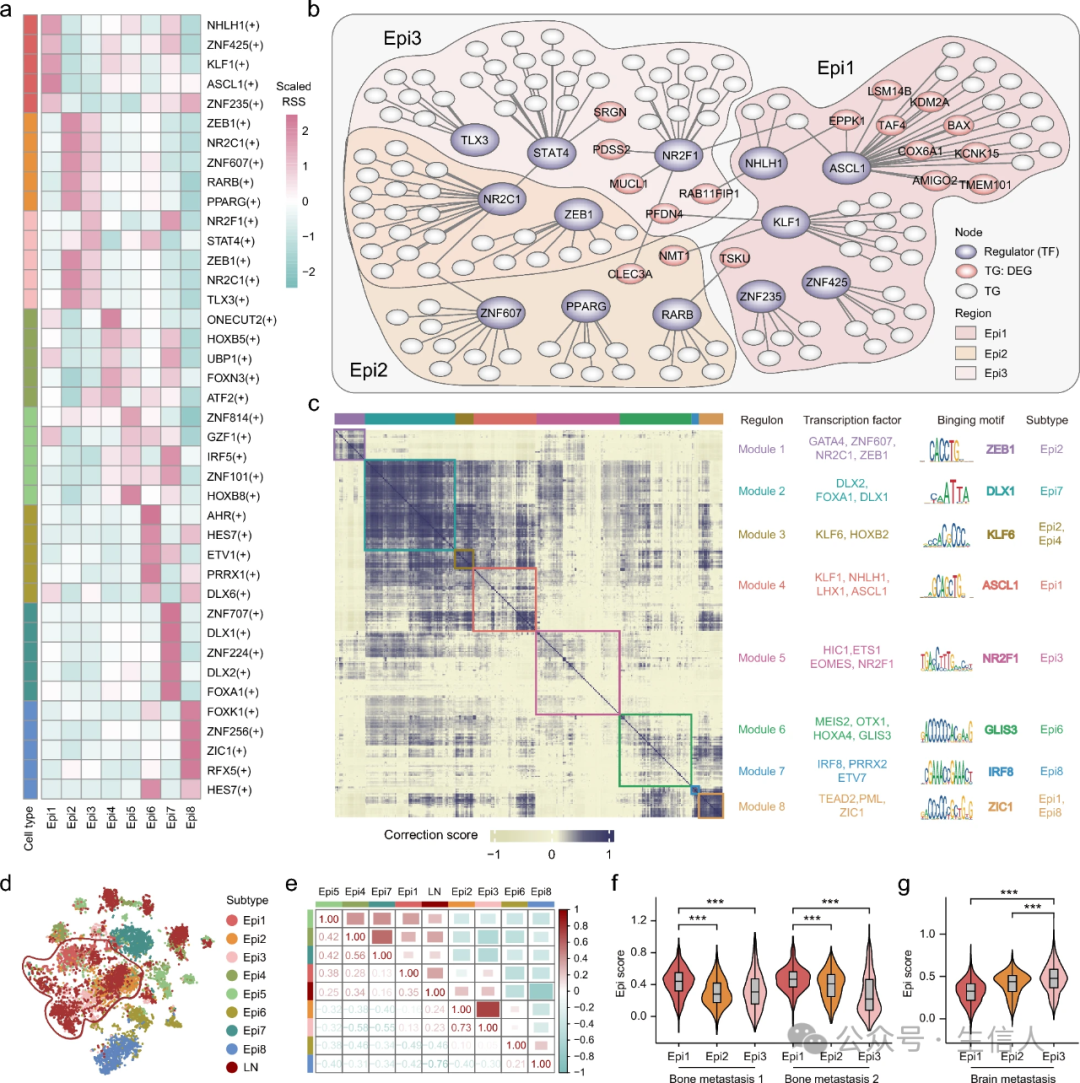
5. 转移性上皮细胞亚型中定制转录调节程序的鉴定
通过计算调节子特异性评分(RSS),观察到ASCL1在Epi1亚型中表现出最高的RSS,而RARB和NR2F1分别在Epi2和Epi3亚型中特异性富集(图4a)。此外,发现Epi2和Epi3亚型表现出一些共同的调节子,例如ZEB1和NR2C1。基于SCENIC结果,进一步构建了转录调节网络,以探索Epi1-3亚型的潜在转移机制(图4b)。结果表明ASCL1是一种关键转录因子(TF),靶向大多数Epi1亚型特异性差异表达基因(DEGs)(图2d)。此外,ASCL1的靶基因KCNK15沿着轨迹分析确定的推断假定时间表现出升高的表达(图3i)。相比之下,在Epi2亚型特异性的转录调节网络中没有观察到任何受TFs调节的DEGs。在Epi3亚型中,NR2F1被强调为编码粘蛋白MUCL1的基因调节因子。值得注意的是,靶基因MUCL1不仅是Epi 3亚型特异性的DEG,而且在拟时间轨迹上发挥着重要作用(图3j)。
接下来,试图识别每个上皮细胞亚型的特定模块,这些模块由一组调节子组成。通过相关性分析,共有357个调节子聚集在8个主要模块中(图4c)。这些模块不仅富含亚型特异性TFs,还富含保守的结合基序,这有助于模块的协调激活。还观察到Epi 3亚型中模块5相关NR2F1的激活。此外,一些共享模块,例如模块3和模块8,可能代表 与转移过程相关的细胞状态,而不是特定的细胞亚型。
6. 转移性上皮细胞亚型与不同的远处转移相关
通过整合上述八种上皮细胞亚型,观察到来自转移性淋巴结样本的上皮细胞与Epi1-3 亚型紧密聚集在一起(图4d)。SCENIC结果的相关性分析还表明,转移性淋巴结样本中的表皮细胞与Epi 1亚型的相关性最强(图4e)。基于Epi 1-3亚型的DEGs,发现在两个乳腺癌骨转移样本中,Epi 1亚型的评分明显高于Epi 2-3亚型(图4f)。相比之下,在一份乳腺癌脑转移样本中,Epi 3亚型的评分明显高于Epi 1 -2亚型(图4g)。
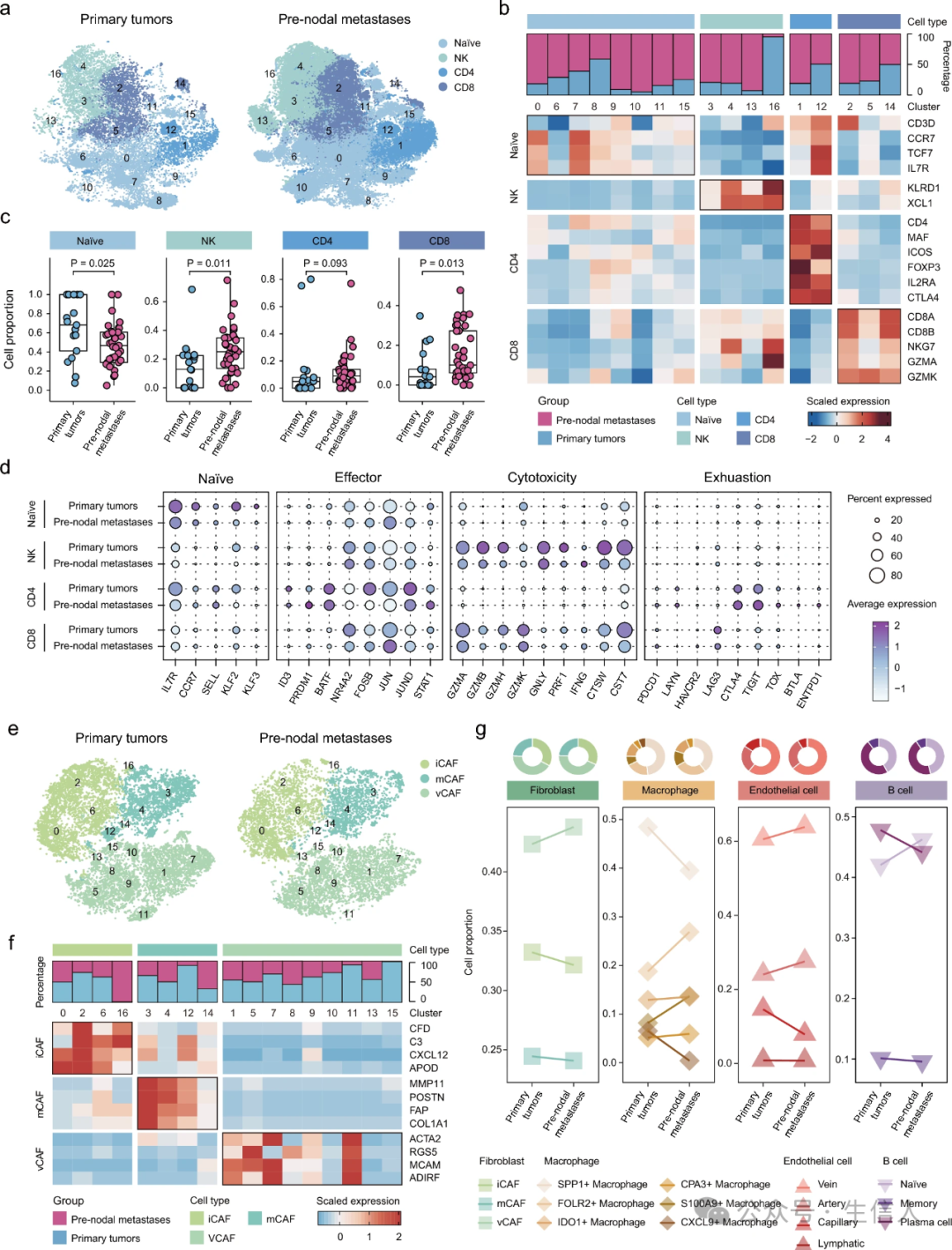
7. 结前转移TME的重塑
单细胞分析揭示了结前转移瘤中成纤维细胞的减少和T细胞的聚集(图1d)。T细胞的无监督聚类显示了17个细胞群,包括8个幼稚T细胞群、4个自然杀伤(NK)细胞群、2个CD4+ T细胞群和3个CD8+ T细胞群(图5a、b)。原发肿瘤和结前转移瘤共享所有 T 细胞集群,但它们的细胞比例各不相同(图 5b)。特别是,NK 细胞和 CD8+ T 细胞在结前转移瘤中表现出明显的富集(图 5c),幼稚 T 细胞在原发性肿瘤中富集。虽然细胞比例没有明显变化,但在结前转移瘤中,CD4+ T 细胞的效应标志物明显下调,而衰竭标志物上调(图 5d)。此外,结前转移灶中的 NK 细胞和 CD8+ T 细胞的细胞毒性标记也明显下调。
对成纤维细胞进行亚聚类分析,发现了 17 个聚类(图 5e)。按照 Cords 等人提出的成纤维细胞分类法,这些聚类被分为3种癌症相关成纤维细胞(CAF)亚型:基质 CAFs(mCAFs)、炎症 CAFs(iCAFs)和血管 CAFs(vCAFs)(图 5f)。与原发肿瘤相比,结前转移灶的 vCAFs 比例相对较高(图 5g),这意味着 vCAFs 在乳腺癌转移中发挥着重要作用。
虽然没有观察到原发肿瘤和结节前转移灶之间巨噬细胞、内皮细胞和 B 细胞比例的明显差异(图 1d),但对这些细胞类型进行亚聚类分析揭示了其亚型的异质性(图 5g)。发现了六种巨噬细胞亚型,结前转移瘤中富含 FOLR2+ 巨噬细胞,而原发性肿瘤中富含 SPP1+ 巨噬细胞。内皮细胞包括四种亚型,其中最主要的亚型是静脉内皮细胞,在结前转移瘤中增加。B 细胞中发现了三种主要亚型,与原发肿瘤相比,记忆 B 细胞和浆细胞的结前转移瘤中有所下降。
8. vCAF 通过结前转移灶中的 CXCL9+ 巨噬细胞促进毛细血管形成
为了解读 TME 中细胞成分之间的串扰,使用原发肿瘤和结前转移灶中的潜在受体-配体对分别构建了细胞相互作用网络。结前转移瘤中不同细胞成分之间的串扰远低于原发肿瘤,尤其是成纤维细胞和内皮细胞之间的串扰,无论其亚型如何,在原发性肿瘤中都是主要的,而在结前转移瘤中则明显减少(图 6a、b)。此外,与原发性肿瘤相比,结前转移瘤中免疫细胞与基质细胞之间的串扰也有所减少。
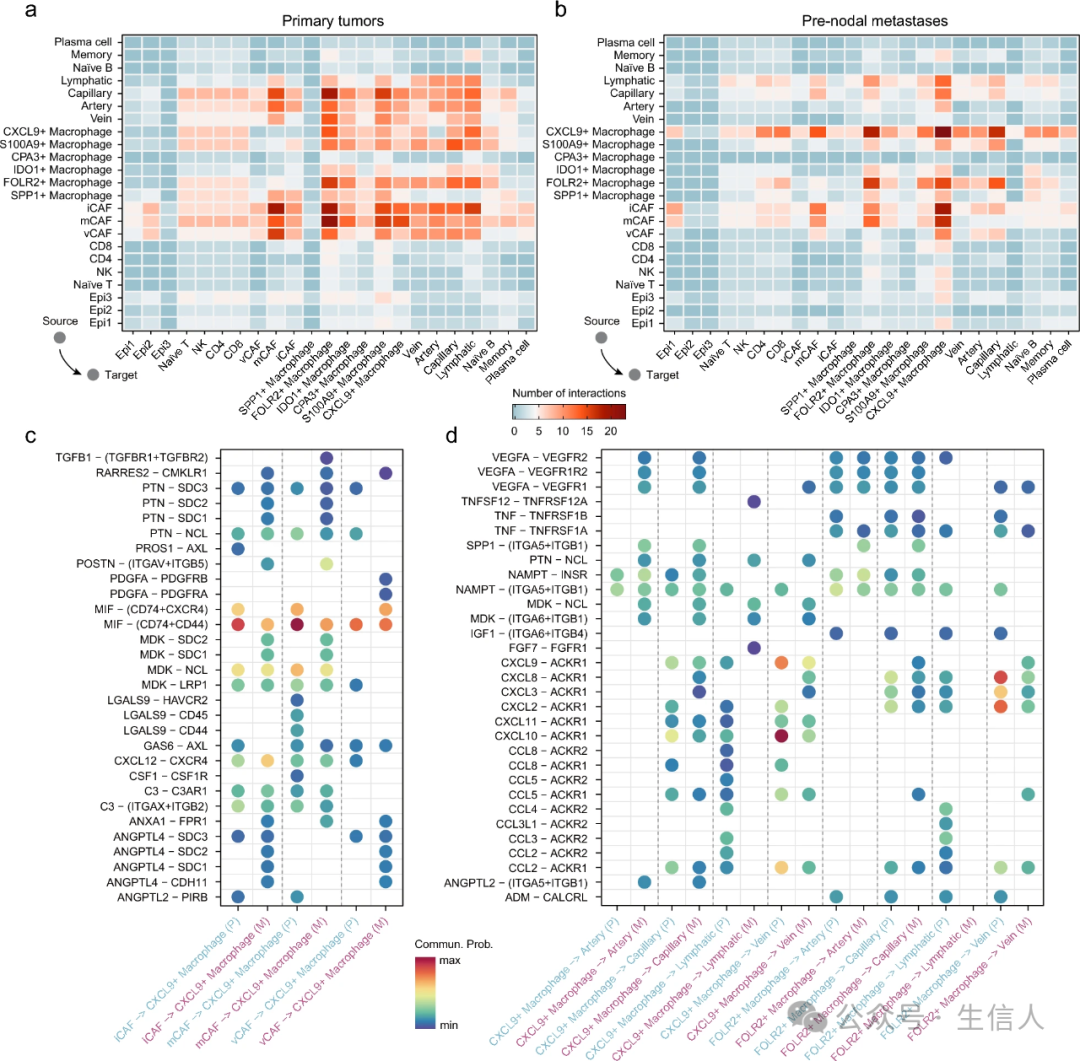 图 6 乳腺癌微环境中的细胞相互作用
图 6 乳腺癌微环境中的细胞相互作用 尽管结前转移瘤中的整体串联减少了,但发现 CXCL9+ 巨噬细胞与成纤维细胞和内皮细胞的相互作用增加了。与原发性肿瘤相比,结前转移瘤中的 CXCL9+ 巨噬细胞更受成纤维细胞的调控,无论其属于哪种亚型(图 6c)。结前转移瘤的CXCL9+巨噬细胞通过 PTN-SDC1、MDK-SDC1 和 ANXA1-FPR1 等多种受体-配体对 iCAFs 和 mCAFs 进行调控,通过PDGFA-PDGFRB和PDGFA-PDGFRA与vCAFs表现出特异性相互作用。并通过多种受体-配体进一步调控内皮细胞,尤其是毛细血管内皮细胞(图 6d)。
9. 转移性上皮细胞亚型与不利的临床特征有关
在 TCGA 数据集中,高富集分数组与较差总生存期(OS)显著相关(图 7a)。在三个独立的乳腺癌数据集中,Kaplan-Meier 生存曲线也显示高分组的 OS 较差(图 7b-d)。在乳腺癌的高频突变基因中,观察到在 TCGA 和 METABRIC 数据集中,高分组的 TP53 突变频率明显更高(图 7e、f),而高分组的 CDH1 突变频率明显低于低分组。在 METABRIC 数据集的临床信息中,高分组也表现出了不利的临床特征,包括 PR 阴性的频率明显更高,组织学分级更高(图 7g)。
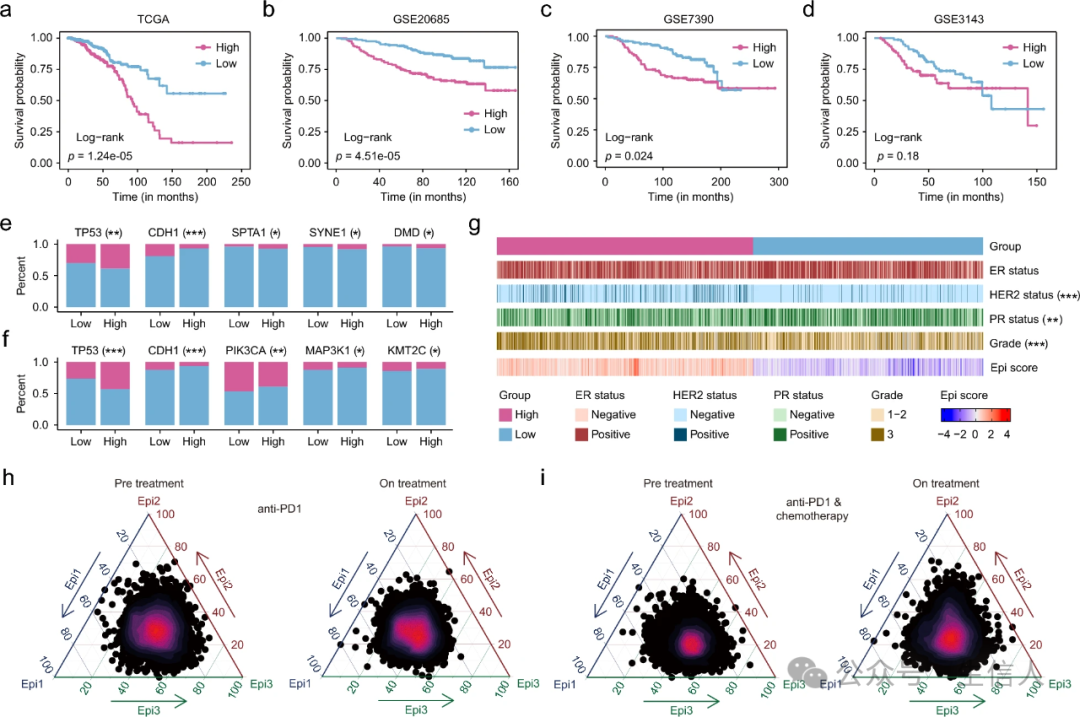 图 7 转移性上皮细胞亚型的临床意义
图 7 转移性上皮细胞亚型的临床意义 10. Epi3亚型对抗-PD1免疫疗法有反应
对于只接受抗-PD1 治疗的患者,发现 Epi2 亚型的 Epi 评分最低,而 Epi1 和 Epi3 亚型的 Epi 评分相对较高(图 7h)。Epi1 和 Epi2 亚型几乎不受免疫治疗的影响,而 Epi3 亚型的 Epi 评分在免疫治疗期间有所下降。在接受新辅助化疗和抗-PD1 治疗的患者中, Epi2 亚型的 Epi 评分最低,而 Epi3 亚型的 Epi 评分有所下降(图 7i)。
三、总结
研究整合了公开的scRNA-seq数据来描述乳腺癌转移的细胞景观,全面描述了转移性上皮细胞亚型以及原始肿瘤和淋巴结前转移之间的TME重塑。分析结果表明,转移性上皮细胞亚型表现出多种转移途径,特别关注Epi 1和Epi 3亚型。总而言之,对乳腺癌转移的全面研究强调了癌细胞和TME可能存在的异质性和可塑性,为乳腺癌转移的潜在机制提供了新的见解。
研究使用多个公开数据库中的scRNA-seq数据,增加了样本量,提高了研究结果的可信度。研究多角度、多变量分析,深入剖析了乳腺癌结前转移中瘤内异质性和 TME 的重塑,增加了文章的深度与广度。文章对于研究肿瘤转移相关课题的小伙伴十分有帮助哦,值得认真学习、分析。
参考文献
Liu, K., Han, H., Xiong, K. et al. Single-cell landscape of intratumoral heterogeneity and tumor microenvironment remolding in pre-nodal metastases of breast cancer. J Transl Med
链接:http://www.lewenyixue.com/2024/09/29/%E9%94%81%E5%AE%9A%E4%BA%8C%E5%8C%BA%EF%BC%8C%E5%85%AC%E5%BC%80%E6%95%B0%E6%8D%AE%E5%BA%93%E7%BA%AF%E7%94%9F%E4%BF%A1%E8%81%9A%E7%84%A6%E8%82%BF%E7%98%A4%E8%BD%AC%E7%A7%BB%E5%89%8D/






赶快来坐沙发