2024 WCLC | POLESTAR研究:不可切除EGFR突变NSCLC在cCRT后的维持治疗
在近期召开的2024年WCLC上,研究者报告了Ⅲ期POLESTAR研究的中期分析,评估了在不可切除EGFR突变NSCLC患者中,Aumolertinib在cCRT后作为维持治疗的中期分析的疗效和安全性。
对于经过同步放化疗(cCRT)后疾病未进展的非小细胞肺癌(NSCLC)患者,使用Durvalumab进行巩固治疗已被确立为标准治疗(SoC)。但对于携带EGFR突变(EGFRm)的NSCLC患者,巩固性免疫治疗的具体益处尚不明确。Aumolertinib,作为第三代EGFR酪氨酸激酶抑制剂(TKI),已在一线和二线治疗EGFRm NSCLC中显示出明确的疗效,并已在中国获得监管批准。
2024年世界肺癌大会(WCLC)于美国当地时间9月7日~10日在圣地亚哥举行,山东第一医科大学附属肿瘤医院孟祥姣教授团队报告了题为“Aumolertinib after Chemoradiotherapy in Unresectable Stage Ⅲ Non-Small-Cell Lung Cancer with EGFR Mutation: Interim Analysis of the Phase Ⅲ POLESTAR Study”的 POLESTAR研究(摘要号:PL04.13)的主要研究结果,评估了在不可切除EGFR突变NSCLC患者中,Aumolertinib在cCRT后作为维持治疗的中期分析的疗效和安全性结果。
POLESTAR研究是一项双盲、安慰剂对照的Ⅲ期临床试验,共纳入了147名患者,以2:1的比例随机分配至Aumolertinib组(94名)和安慰剂组(53名)。Aumolertinib的剂量为每日一次110mg口服,直至疾病进展。研究的主要终点为由盲法独立中心审查(BICR)评估无进展生存期(PFS)。次要终点包括总生存期(OS)、其他疗效终点和安全性。
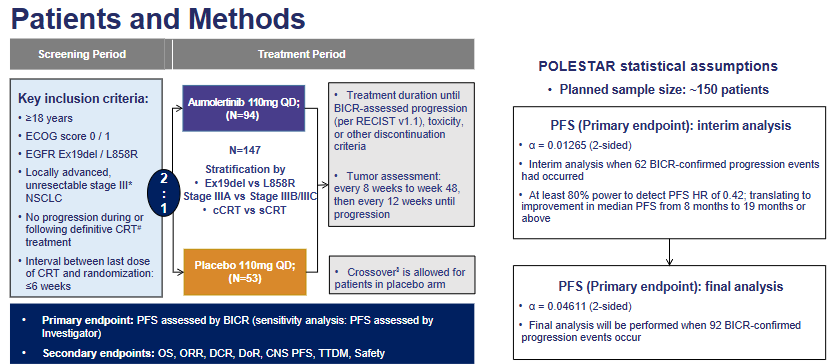
图1 研究设计
01▼研究结果
Aumolertinib组与安慰剂组的基线特征平衡,包括性别、EGFR突变类型、ECOG表现状态和疾病分期,女性占比分别为54%和62%,Ex19del突变占比分别为41%和44%,ECOG表现状态0占比均为20%,ⅢA期占比分别为24%和22%。截至2024年2月5日,中位随访时间分别为16.36个月(Aumolertinib组)和13.93个月(安慰剂组)。
研究结果显示,Aumolertinib组的PFS显著优于安慰剂组(HR=0.20, 95% CI:0.11~0.35; P<0.0001),中位PFS分别为30.4个月(95% CI:17.2~NA)和3.8个月(95% CI:3.7~5.6)。研究者评估的PFS结果与BICR评估一致。
在所有亚组中,PFS的获益均一致。两组的中位OS均未达到。
安全性分析中,Aumolertinib组的3级以上不良事件(AE)发生率与安慰剂组相似,两组中3级及以上TRAEs在的报告率均低于2%;导致治疗中断的TRAEs在Aumolertinib组和安慰剂组中的报告率分别为2.1%和1.9%;未发现新的安全信号。
最常见的≥3级治疗相关不良事件(TRAE)为血肌酸磷酸激酶增加,Aumolertinib组为6.4%,安慰剂组为0%。
放射性肺炎在Aumolertinib组和安慰剂组中的报告率分别为45%和30%,均为3级以下。
02▼总结讨论
POLESTAR研究的中期结果中,Aumolertinib作为cCRT后的维持治疗,显著提高了Ⅲ期不可切除EGFR突变NSCLC患者的PFS,且未发现新的安全事件。Aumolertinib组的中位PFS为30.4个月,而安慰剂组为3.8个月,Aumolertinib的PFS益处在所有预定义的亚组中均一致。在放化疗后,Aumolertinib的整体安全性良好,耐受性佳,且未发现新的安全信号。这些发现为Aumolertinib作为CRT后不可切除Ⅲ期EGFR突变NSCLC患者新的治疗选择提供了重要参考,有望改善患者的预后。随着研究的继续进行和最终分析的完成,我们期待Aumolertinib能够成为这一患者群体的标准治疗选择之一。
链接:http://www.lewenyixue.com/2024/09/29/%E2%80%8B2024%20WCLC%20%7C%20POLESTA/