【DCR专区 | 住院医师角】直肠癌术中放疗的使用
DCR中文版编者按
直肠癌的术中放疗缺乏一级证据支持,但在部分中心有选择性开展。鉴于所涉及的复杂盆腔情况和潜在术后并发症风险,临床研究和多学科评估是这项治疗的前提。
翻译: 唐彬 湘潭市中心医院,张昭 天津市人民医院
审校: 鲜振宇 中山大学附属第六医院
病例摘要
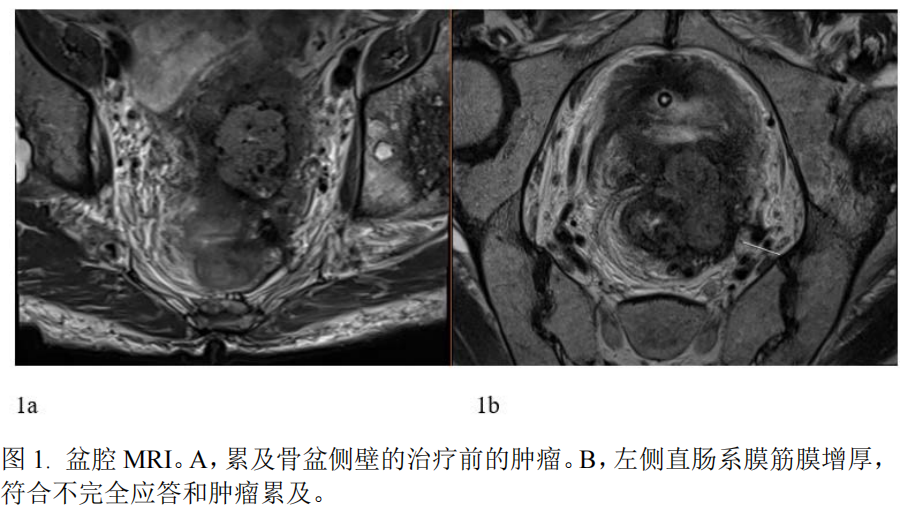
一位65岁的男性因为腹痛症状就诊,影像学检查显示大肠梗阻,进一步检查显示局部进展期的上段直肠癌。他接受了袢式结肠造口术以及FOLFOX方案放化疗的全程新辅助治疗(total neoadjuvant therapy,TNT)。新辅助治疗完成时,患者肿瘤从T4bN2M0降期为T4bN0M0(图1,治疗前和治疗后MRI)。治疗后影像检查显示对治疗反应不完全,并考虑左侧盆壁受累。经过多学科讨论,考虑到可能出现阳性切缘,计划继续进行手术并对盆壁行术中放疗(intra-operative radiation therapy,IORT)。患者接受了机器人全盆腔脏器切除、回肠代膀胱,以及左侧盆壁术中放疗。最终病理显示分期为T4bN0,切缘阴性。患者术后病程复杂,出现肠梗阻、假性动脉瘤,术后1周出现需行弹簧圈栓塞治疗的左髂内动脉活动性出血,并出现需行CT引导下引流的盆腔脓肿。术后2个月患者最终康复并出院,被转至长期急性照护机构。
-
术中放疗(IORT)的作用是什么?
-
IORT是如何实施的?
-
IORT涉及哪些并发症?
每年有超过40000名患者被诊断为直肠癌 1 。尽管采取了早期检测和筛查措施,但这些患者中仍有5%为局部晚期且不可切除 2 。与病情偏早期的患者相比,局部晚期直肠癌患者在接受传统的放化疗治疗时,复发率更高,生存率也更差 3 。其传统治疗有新辅助放疗,包括长程放化疗(long course chemoradiotherapy,LCCRT)和短程放疗(short course radiotherapy,SCRT)。近年来,作为全程新辅助治疗(TNT)方法的一部分,全身系统化疗也常用于新辅助治疗,以促使局部晚期直肠癌降期并提高其可切除性。LCCRT总放射剂量为45-50 Gy,每次1.8-2 Gy,同时进行5-氟尿嘧啶为基础的化疗。SCRT每天给予5 Gy的放疗,持续5天,不同步化疗。对比这两种类型治疗,随机对照试验没有发现局部复发率或总生存率的差异,但发现SCRT的毒性较小,而LCCRT的降期作用更明显 4,5 。这些疗法的放射剂量受到限制,主要是因为高剂量下的毒性以及对周围结构的潜在损伤。在这些剂量下,R1切除术(显微镜下阳性切缘)和R2切除术(肉眼阳性切缘)的复发率分别高达70%和86% 6 。据报道,R1切除和R2切除的五年生存率分别为47%和23%。对于复发性直肠癌,R0切除术后5年生存率为43%,R1切除术后为14%,R2切除术后为4% 7 。IORT的基本原理是,对于可能无法达到R0切除的患者,可直接向瘤床输出一定剂量的辐射。由于可保护周围器官,它允许一次输送更高剂量的辐射(10-20Gy)。IORT适用的常见区域包括骨盆侧壁、骶前间隙和盆底。
直肠癌的表现因人而异,有些患者可能没有症状,其他可能表现为疲劳、梗阻、肠功能改变或直肠出血。直肠癌初始分期所需资料包括病史和体格检查、CEA、胸腹盆CT扫描,盆腔MRI用于评估淋巴结情况和肠壁受侵程度,结肠镜检查用于活检和评估有无多原发病变。
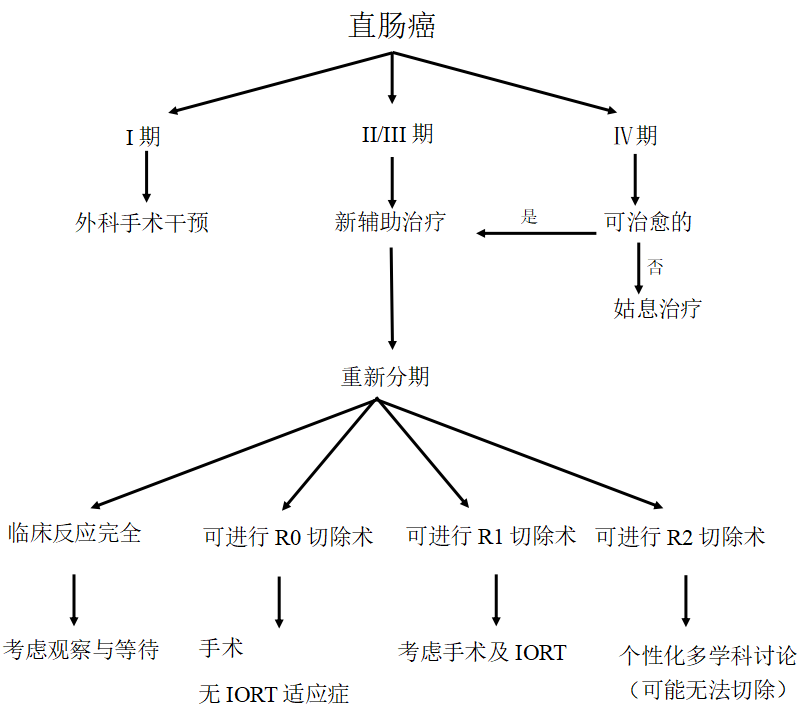
一旦确诊为直肠癌且已全面完成分期工作,患者应根据既定的治疗推荐、多学科治疗团队的讨论,及适当的个体化调整后接受治疗。对于T4期疾病患者及在适当的新辅助治疗完成后仍有可能切缘阳性的情况下,在多学科讨论后应考虑使用术中放疗(IORT)。
IORT类型
目前已知三种类型的IORT:术中电子束放疗(intraoperative electron beam radiation therapy,IOERT),术中高剂量近距离放疗(high-dose-rate intraoperative brachytherapy,HDR-IORT)和术中低千伏放射治疗(low kilovoltage intraoperative radiation,kV-IORT)。IOERT具有更短的治疗及设置时间以及更深的组织穿透力。HDR-IORT配置更灵活的施源器,可以更好地适应弯曲狭窄的盆腔,并能提供更集中的剂量,但治疗时间要长得多。kV-IORT则具备固定的施源器和较长的治疗时间,虽穿透深度有限,但防护要求更低。一项比较研究显示,HDR-IORT患者的局部复发无瘤生存率优于IOERT患者,但总生存率没有差异 8 。总的来说,使用哪种类型的放疗取决于具体的某个机构以及他们拥有的设施和设备。
IORT的效用
患者选择对于确定哪些患者将受益于IORT至关重要。法国的一项随机对照试验未能证明IORT对所有II/III期疾病患者均可获益 9 。因新辅助治疗和R0全直肠系膜切除术(TME)后的局部复发率非常低,故IORT可能带来的任何预期益处都非常小 9 。对于原发性直肠癌R1切除术,IORT已被证明可以减少局部晚期直肠癌患者的局部复发,多项研究报告显示R1切除术后5年局部控制率为80%~92%,5年生存率为49%~75% 6,8 。对于R1局部复发性直肠癌,IORT的局部控制率为30%~60%,5年生存率为20%~30% 6 。与原发性直肠癌相比,R0切除术后复发更常使用IORT,局部控制率为60%~80%,5年生存率为40%~50% 6 。无论是原发性直肠癌还是复发性直肠癌,手术可能导致R2切缘(肉眼残留病灶)的患者不太可能从IORT中获益;因此,沿骶神经根、坐骨切迹、输尿管或髂血管的侵犯,应谨慎而有计划地实施IORT 10 。还可以考虑对低转移性疾病且将进行以治愈为目的的转移切除术患者施行IORT。一项2021年对IORT的系统回顾总结了迄今为止的文献,发现IORT有利于改善局部控制,但未显示对总体生存有任何益处 11 。值得注意的是,报告这些复发益处的数据来自老年患者队列的观察性研究,是在TNT普及程度较低且没有任何随机对照试验显示出益处的情况下进行的。
IORT技术
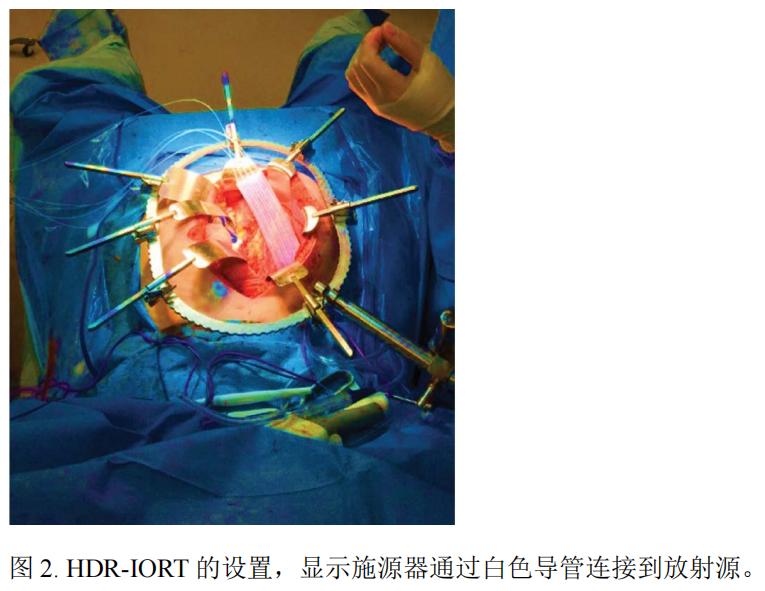
IORT是包括外科医生和放射肿瘤科医生在内的多学科手术。首先,进行原发性肿瘤的手术切除。根据适当的肿瘤学原则进行直肠切除术,包括肠系膜血管高位结扎、全肠系膜切除(TME)和必要时整块切除其他受累器官。手术方式可以根据外科医生的偏好和判断采用任一技术(开放式、腹腔镜、机器人辅助)。然后评估肿瘤床,特别是术前影像确定的受威胁切缘区域。如果有肉眼可见的残留,不应进行IORT。冷冻切片可能有助于确定切除的充分性。最终决定进行IORT是外科医生和放射肿瘤科医生共同决定的。如果计划进行肠吻合,应该在吻合之前进行IORT。一旦决定进行IORT,就需要开腹以放置器械臂。然后根据手术野和潜在的受威胁的切缘区域确定辐射靶点。一旦选择了靶点,应游离并移走正常的未受累组织。对于无法游离的结构,尝试用铅包裹的湿纱布或网膜瓣屏蔽。根据靶点大小,选择施源器,并且与放射肿瘤科医生和放疗技师确定剂量。图2是HDR-IORT设置的示例。然后输送剂量,IOERT需要几分钟,而HDR-IORT需要30~40分钟。放射结束后移除施源器。如果正在进行肠吻合,则完成吻合并关闭腹部。
IORT并发症
IORT的并发症发生率不定,范围在5%~60%之间 6 。最常见的并发症是伤口并发症,包括伤口裂开和皮肤感染,据报道其范围高达40% 12 。其他常见并发症包括盆腔脓肿、肠梗阻、周围神经病变、肠瘘、泌尿系统并发症、术后出血和吻合口漏 6,9,11 。值得注意的是,这些并发症中的一些可能与局部晚期疾病的手术方式及性质、肿瘤与骨盆神经血管结构的接近程度、复发性疾病患者再次手术时的纤维化/瘢痕形成以及手术范围(可能包括多脏器切除)有关。
在回顾性研究、前瞻性队列研究和病例系列研究中,已发现 IORT在治疗局部晚期原发性和复发性直肠癌时在局部控制方面的益处,但在TNT尚未普及的时期,没有任何随机对照试验发现IORT的益处。IORT联合直肠切除术也有多种并发症。IORT的理想适应证是只能进行R1切除,且相比减少复发可能带来的益处,患者需要能够忍受高风险的并发症。是否进行IORT应由多学科团队根据患者具体情况 作出 决定。
滑动阅读参考文献
祝贺Nimer和Ali两位医生出色地概述了术中放疗(IORT)在局部晚期原发性或复发性直肠癌(locally advanced rectal cancer, LARRC)中作为手术治疗辅助手段的应用。自20世纪60年代以来,许多医疗学术中心已经对IORT在该类患者中的应用进行了研究。尽管这些机构已发表了一些报告,但IORT在LARRC手术治疗中的地位从未被确定。长程放化疗的广泛引入,以及现在的全程新辅助治疗,使选择标准更加复杂。
我使用IORT的目的是减少盆腔复发,因为几乎所有外照射放疗的随机试验都未能证明其能改善生存率。现有证据表明,IORT可能对R1切除的患者有益,但不能补偿手术失败。我们不该忽视如下事实,即R0切除术是肿瘤局部控制和无病生存的最重要预测指标。因此,应该用术前盆腔MRI来制定LARRC的定制化“超TME手术”(多脏器切除)计划。在泌尿外科、血管外科、骨盆骨科和神经外科同事的支持下,超TME手术最大限度地提高了R0切除的机会。出于此原因,我只主张在尽管已计划行超TME手术,术前MRI仍预测切缘受累的情况下使用IORT。此外,当患者由于担心相关并发症而拒绝超TME手术,或术前规范评估认为不适合进行根治性手术,我有时会考虑IORT。
IORT缺乏一级证据支持,在我自己的实践中有由机构审查委员会(Institutional Review Board,IRB)批准的一项研究提供依据。需要与拟进行IORT治疗的患者进行深入的咨询沟通。他们必须理解IORT治疗的目的是减少局部复发,而且支持证据仍然有限。患者还必须了解,即使成功实施R0切除后也可进行IORT治疗,但可能没有明显的肿瘤学获益,也伴随有风险。我自己的经验显示,所述的长期风险被夸大了,而治疗耐受性很好。
术前几天需要与放射肿瘤学专家紧密协作,仔细检查放疗方案。由于即使是大中心也很少使用IORT设备,因此在术前几天必须由放疗技师对IORT系统进行测试。在进行IORT时,需要考虑危险切缘位置和IORT系统的限制。如果经会阴途径是手术计划的一部分,那么这可能是放置IORT设备以抵达危险切缘的最实用部位。此外,设备的尺寸、形状和刚度均应纳入考虑。如果在开腹手术中进行IORT,可利用自固定式撑开器使腹腔器官远离放疗目标区域。在微创手术中,左侧抬高的大角度Trendelenburg体位可达到同样效果,但可能需要进行末端回肠/盲肠游离松解。在再次手术中,我会进行双侧输尿管松解并用血管吊带牵引输尿管,使其远离放疗区域。我不会担忧髂内系统暴露于IORT,除非患者既往有盆腔手术史、严重盆腔脓肿、外照射放疗史的三联征,因为这会极大地增高假性动脉瘤的风险。正确放置IORT设备后,我会用5 cm×5 cm的小纱布紧密填充盆腔,以减小对膀胱、前列腺/阴道和尿道的非靶区效应。护士在放置纱布时必须进行清点,以便后来确认它们已全部取出。在IORT结束时,放疗技师必须确认IORT剂量已经给足,因为许多IORT系统并不进行实时监测。
总之,IORT已经广泛应用于LARRC的治疗几十年了,但还需要进一步的研究,尤其是考虑到全程新辅助治疗的出现。尽管如此,鉴于LARRC不全切除率在6%~8%之间,而在超低位直肠癌中高达25%,IORT作为一种降低不完全切除率的手段在学术上仍然很有吸引力。随机对照试验可能难以实施,但应建立具有严格纳入标准的多国/多中心前瞻性队列研究,进一步为IORT未来的发展提供证据基础。
学习目标:
1. Know the indications for intra-operative radiation therapy (IORT) use in the management of locally advanced rectal cancer
2. Understand the differences between IORT modalities
3. Know the complications associated with IORT use
课后习题:
1. A 62 year-old female patient presents to clinic with a recently diagnosed locally-advanced mid-rectal adenocarcinoma. She has completed total neoadjuvant therapy with long course chemoradiotherapy and consolidation FOLFOX. Office exam reveals a persistent palpable tumor and endoscopy confirms an incomplete response. MR staging shows a T4bN0M0 tumor with posterior extension through the mesoractal fascia, abutting the sacrum. What is the next best step in treatment?
a. Low anterior resection without IORT
b. Low anterior resection with assessment of tumor bed to determine IORT use
c. Low anterior resection with empiric IORT
d. Abort operation if low anterior resection with RO resection cannot be performed
2. After resection of a locally advanced rectal cancer following an incomplete response to total neoadjuvant therapy (TNT), abnormal tissue is noted along the right pelvic sidewall that cannot be resected. Frozen biopsies are sent to pathology. The next best step in management is?
a. Complete operation without further treatment regardless of frozen biopsy
b. If biopsy is negative for adenocarcinoma, complete operation without IORT
c. If biopsy is positive for adenocarcinoma, complete operation without IORT
d. Perform IORT regardless of biopsy results
3. After multi-disciplinary review, a patient is deemed a candidate for proctectomy with possible IORT for the management of locally advanced rectal cancer. The threatened margin is the anterolateral distal pelvic sidewall. After confirmation of no gross residual disease, what modality of IORT would be best for treatment of this patients disease?
a. No IORT should be used
b. Electron Beam Radiation
c. Brachytherapy
d. Low Kilovoltage radiation
4. On rounds, you notice new, frank blood in a pelvic drain of a patient who is POD #5 following a low anterior resection and perting loop ileostomy for management of a locally advanced rectal adenocarcinoma after an incomplete response to TNT. IORT was used along the right pelvic sidewall due to concern of a close margin. CT imaging reveals active extravasation from the right internal iliac artery. Which of the following factors increased the patient’s risk for this complication?
a. IORT
b. Previous pelvic radiation
c. Tumor involvement of the right pelvic side wall
d. All of the above
5. You are evaluating a patient for a low anterior resection with possible IORT for management of a locally advanced rectal adenocarcinoma after TNT with a threatened circumferential margin along the sacrum. Utilizing IORT would allow the patient to:
a. Receive high dose radiation directly to the tumor bed
b. Receive low dose radiation directly to the tumor bed
c. Undergo adjuvant external beam radiation
d. Decrease risk of complication from oncologic resection alone
答案: BCCDA
链接:http://www.lewenyixue.com/2024/09/11/%E3%80%90DCR%E4%B8%93%E5%8C%BA%20%7C%20%E4%BD%8F%E9%99%A2%E5%8C%BB%E5%B8%88%E8%A7%92%E3%80%91%E7%9B%B4%E8%82%A0%E7%99%8C%E6%9C%AF%E4%B8%AD/









赶快来坐沙发