【CACA周刊】75期 基因驱动灭肿瘤——灭蚊实践的启示
本期看点
序言
夏日炎炎,夜晚的宁静常常被嗡嗡的蚊子打破,它们不仅骚扰着我们的睡眠,更是疾病传播的媒介。面对这令人头疼的蚊子,佛罗里达州政府批准了牛津昆虫技术公司将基因改造的埃及伊蚊放生野外,让自然蚊子种群自我消亡,为我们展示了一场生物科技的精彩演出。
第一代转基因伊蚊基因组中添加了一个复合转座子,在没有四环素的环境下会导致蚊子死亡。在实验室中给蚊子饲喂四环素可以获得大量的携带该转座子的蚊子,再通过技术手段去除雌蚊并把雄蚊释放到野外与野生雌蚊交配。
由于雄蚊不叮咬人畜,与野生雌蚊交配后的后代由于缺少四环素而死亡,这就达到了初步消灭蚊子的目标。
第二代转基因伊蚊做了一个重要改进,新的转座子表达的蛋白只能杀死雌蚊,可以保留后代中的雄蚊,这可以在较长时间上实现长期控制蚊子种群数量的目的。在雄蚊后代中,携带致命基因的雄蚊按照指数减少,因此只需要每年释放一定数目的转基因雄蚊就可以稳定控制蚊子种群密度。
在这场与自然界的较量中,我们也不禁思考:能否将这种创新的基因技术应用于更复杂的生命挑战——癌症治疗之中?
7月4日, Nature Biotechnology 刊登了一篇研究文章 [9] ,利用一种类似的策略来主动对抗肿瘤的耐药性。
对于许多癌症来说,耐药性的进化是治愈肿瘤的最大挑战之一。单细胞异质性的研究表明,在基线时肿瘤中经常存在小的耐药亚克隆,这些亚克隆将在肿瘤主要克隆被药物抑制时转化成为主要克隆。在靶向治疗的情况下,患者就应该选择下一代抑制剂以对抗肿瘤耐药。
然而,新一代疗法通常只能提供暂时的响应,继发性耐药将再次出现。在常见的EGFR突变NSCLC中,厄洛替尼一线治疗往往会出现T790M耐药,换用奥希替尼治疗后再次耐药往往会因为C797S再次耐药。
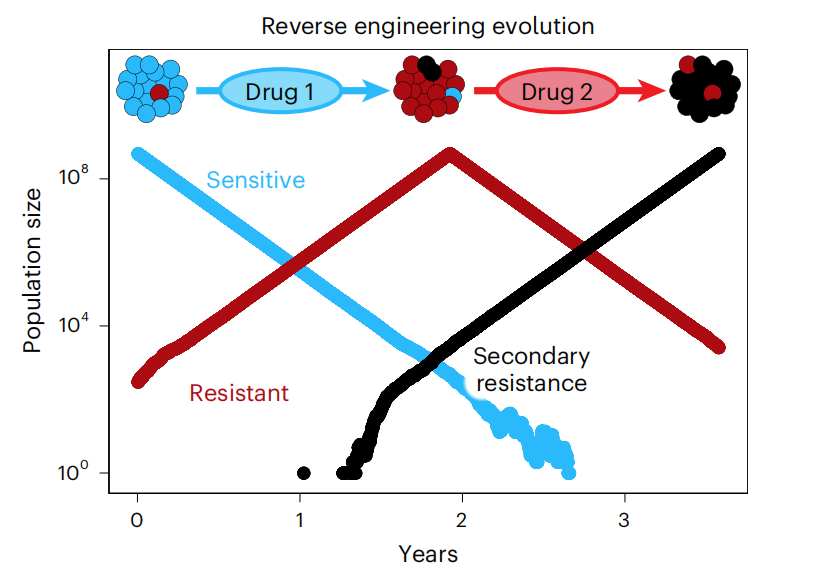
在药物研发领域,巨大的资源被投入到下一代药物的开发中,以为患者提供新一线治疗选择。但药企的研发速度显然追不上肿瘤进化的速度,患者最终会面临无药可用的局面。
目前经验来看战胜耐药性进化的唯一途径是在治疗之初采用联合疗法,将具有不同耐药机制的药物联合使用,将交叉耐药的风险降到最低。这与抗生素的治疗方案是很类似的,一开始就“赶尽杀绝”好过后期“应接不暇”。
然而,肿瘤联合疗法的实现比抗生素困难得多,理想的联合疗法应该具有完全不同的耐药机制和不重叠的剂量限制性毒性,但是目前来看肿瘤的发生和发展相当依赖生长受体信号通路,其他可选的正交靶点甚少,为联合疗法带来了相当大的阻碍。
本研究中,研究者结合CRISPR技术、前药激活技术和达尔文适合度理念,向肿瘤细胞内传递一个由两个“基因开关”组成的单一载体。开关1是适合度优势(fitness advantage),可以为工程细胞提供瞬时靶向治疗抗性,以促进工程细胞在肿瘤中建立优势地位。开关2是适合度代价(fitness cost),搭载有效载荷基因,激活后可通过细胞毒性和旁观者效应杀死工程细胞和周围的肿瘤细胞。
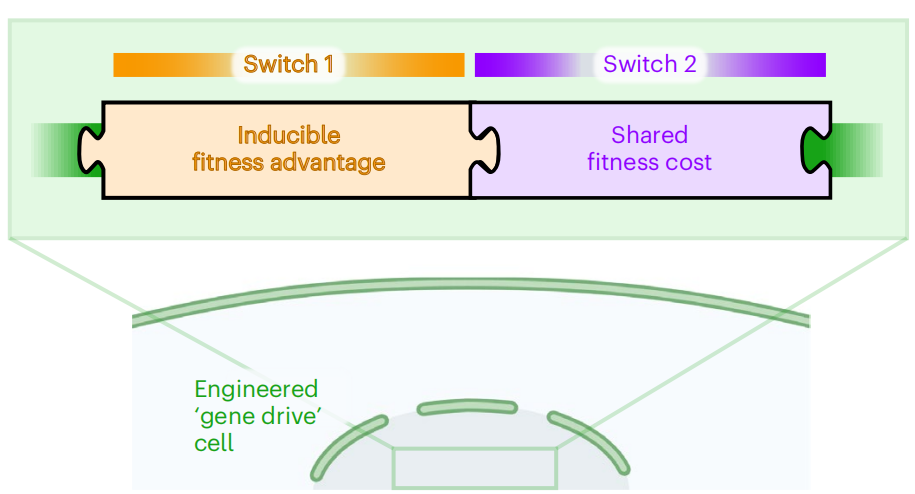
整个系统像一场特工潜伏的暗中较量,由于工程细胞具有开关1,在靶向治疗中会获取生长优势和少数耐药亚克隆一起增殖并成为优势克隆亚群。当开关2被激活时,肿瘤中大量的工程细胞会“自爆”,并通过旁观者效应有效杀伤耐药肿瘤细胞。当真正的“攻势”开始时,肿瘤内到处都是接受了工程改造的“好同志”,形成一股强大的合力一举摧毁肿瘤。
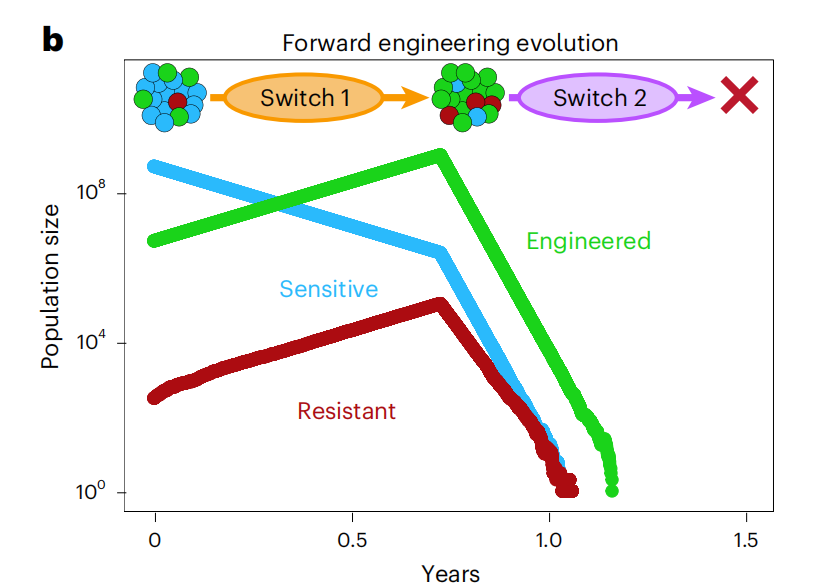
从基因改造的蚊子到选择性基因驱动抗肿瘤,达尔文的进化生物学始终是朴实无华但有效的真理。通过可控的工程细胞去侵占耐药亚克隆的资源、增加生存压力是一个相当大胆且创新的策略。正如“用魔法打败魔法”,有的时候奇招反而可以出其不意。
医术观澜
……
1-
7月12日, Nature Communications :东南大学物理学院郝琪教授开发一种等离子体三聚体用于捕捉表面增强拉曼光谱,可用于肺腺癌检测 [1]。
表面增强拉曼散射(SERS)利用等离子体纳米材料在材料周围产生局部强电磁场以放大附近分子的拉曼散射,实现低至单分子水平的高灵敏度分子检测。然而,这些局部强电磁场区域进展材料表面积的1%不到,并且是高度异质的,这限制了SERS的实际灵敏度。
为克服这一限制,研究者利用Au@Al2O3-Au-Au@Al2O3三聚体构成一对二聚体颗粒和介于两者之间的陷阱颗粒,用于选择性地诱导目标分子进入局部强电磁场所在的陷阱,从而能够通过快速映射对样品进行拉曼分析。
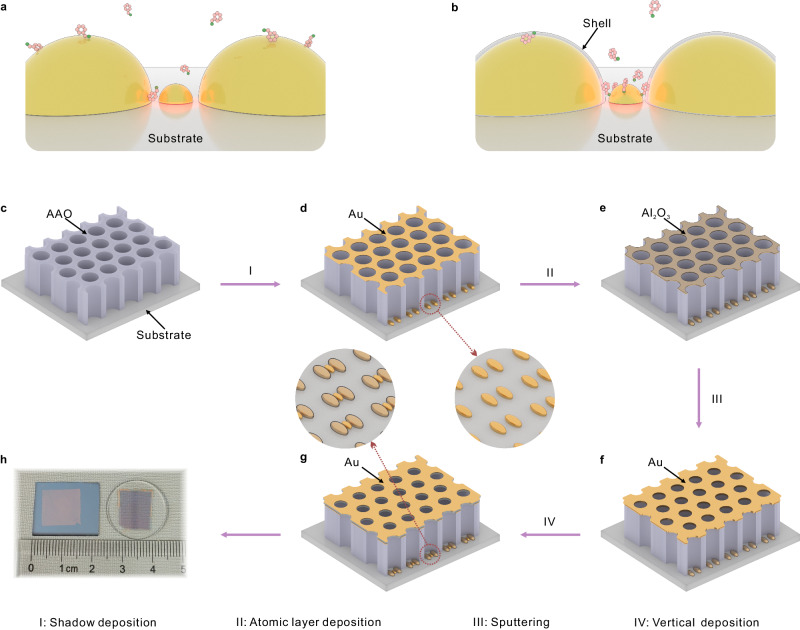
肺肿瘤一般分为腺癌、鳞状癌和其他次要亚型,研究者通过外科手术从患者身上获得了10个新鲜样本(6例腺癌、3例鳞癌、1例良性)用于SERS测试,每个样本收集1600个拉曼光谱。其中,腺癌的信号强度远高于鳞癌的信号强度。
进一步分析表明,SERS在区分不同肺癌亚型方面很敏感,未发现证据表明SERS结果与原始肿瘤大小或淋巴结之间存在相关性。对于鳞癌,SERS诊断适用于所有从ⅠA到ⅡB期的患者。
该研究为提高SERS灵敏度提供了一种稳健的方法,未来需要更大的数据集进行进一步研究以完善初步观察结果。
药事纵横
……
1-
7月2日, Nature Medicine :中国医学科学院肿瘤医院李印教授揭示卡瑞利珠单抗联合化疗治疗可切除晚期食管癌新方案 [2]。
ESCORT-NEO/NCCES01研究是一项全国多中心、随机、三臂、开放标签的Ⅲ期试验,旨在评估在可切除局部晚期食管鳞状细胞癌(LA-ESCC)患者中使用新辅助化疗联合卡瑞利珠单抗的疗效和安全性,探索适合中国LA-ESCC患者的标准治疗方案。
391例LA-ESCC入组患者(T1b-3N1-3M0或T3N0M0)按临床分期(Ⅰ期、Ⅱ期、Ⅲ期、ⅣA期)分层,1:1:1随机分组,在手术切除前接受两周期治疗,A组:卡瑞利珠单抗+白蛋白紫杉醇+顺铂(Cam+nab-TP组;n=132);B组:卡瑞利珠单抗+紫杉醇+顺铂(Cam+TP组;n=130);C组:紫杉醇+顺铂(TP组;n=129),此外Cam+nab-TP组和Cam+TP组还在术后接受了卡瑞利珠单抗辅助治疗。研究以pCR和EFS为主要终点。
结果显示Cam+nab-TP组和Cam+TP组均达到了主要终点pCR:Cam+nab-TP组 vs Cam+TP组为28.0% vs 4.7%(差异23.5%;95% CI:15.1~32.0; P<0.0001);Cam+TP组 vs Cam+TP组为15.4% vs 4.7%(差异10.9%;95% CI:3.7~18.1; P=0.0034)。EFS数据尚未成熟。
安全性方面,Cam+nab-TP组、Cam+TP组和TP组的3级或以上治疗TRAEs分别为34.1%、29.2%和28.8%;术后并发症发生率分别为34.2%、38.8%和32.0%。新辅助化疗联合卡瑞利珠单抗安全性可控,未增加手术并发症。
2-
6月28日, Cancer Communications :中国医学科学院肿瘤医院徐兵河院士团队发布乳腺癌HER2-ADC新药Ⅰ期研究结果 [3]。
维迪西妥单抗(DV)是一种创新的ADC药物,为探究其在HER2过表达和HER2低表达晚期乳腺癌(ABC)患者中的安全性和疗效,研究人员设计了一项多中心、单臂、开放标签的Ⅰa/Ⅰb期临床试验。
Ⅰa期剂量递增研究(C001 CANCER)旨在确定HER2过表达ABC患者对DV的MTD、安全性和PK。24位入组患者每两周接受一次DV治疗(剂量范围0.5~2.5 mg/kg),直至出现不可接受的毒性或疾病进展。Ib期剂量范围和扩展研究(C003 CANCER)纳入了两个队列:HER2过表达的46例ABC患者接受1.5~2.5 mg/kg Q2W的DV治疗,并确定推荐的RP2D;HER2低表达的66例ABC患者接受2.0 mg/kg Q2W的治疗,以探索DV在HER2低表达ABC中的疗效和安全性。
结果显示,C001 CANCER和C003 CANCER在接受DV 2.0 mg/kg Q2W治疗时,ORR分别为42.9%(9/21;95% CI:21.8%~66.0%)和33.3%(22/66;95% CI:22.2%~46.0%),PFS分别为5.7个月(95% CI:5.3~8.4个月)和5.1个月(95% CI:4.1~6.6个月),表现出良好的疗效。
常见(≥5%)的3级或以上TEAEs包括中性粒细胞减少(17.6%)、γ-谷氨酰转肽酶升高(13.2%)、乏力(11.0%)、白细胞减少(9.6%)、外周神经疾病如感觉减退(5.9%)、神经毒性(0.7%)和疼痛(5.9%)。
3-
6月28日, Signal Transduction and Targeted Therapy :北京大学肿瘤医院鲁智豪教授评估了阿法替尼在EGFR过表达的转移性食管鳞癌患者中的疗效和安全性 [4] 。
50%~70%的ESCC患者中观察到EGFR过表达,且与肿瘤侵袭和生存率低相关。既往关于抗EGFR疗法的研究,包括西妥昔单抗、帕尼单抗和吉非替尼,对OS的益处有限,可能部分归因于缺乏患者选择策略。
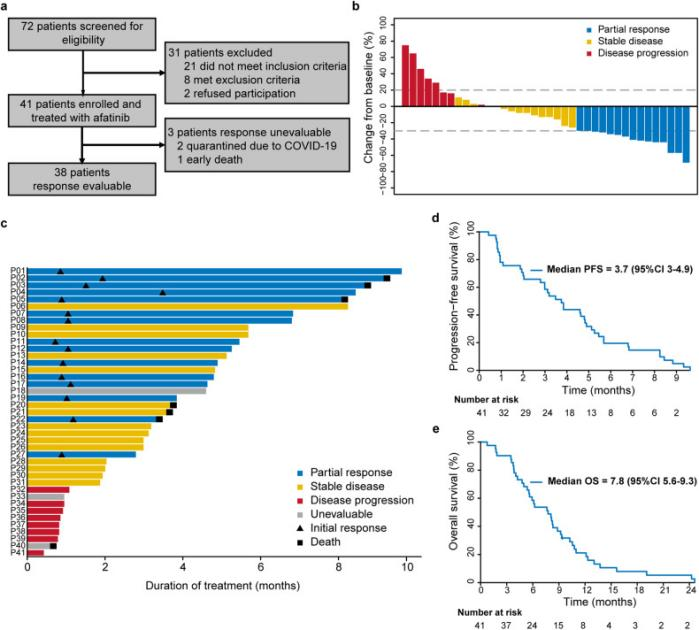
该研究纳入41名符合条件的EGFR过表达ESCC患者接受阿法替尼治疗。38例可评估患者中,ORR为39%(95% CI:24~57),其中15例PR、15例SD。DCR为79%(95% CI:63~90)。在15例客观反应的患者中,肿瘤中位反应时间为4.6周(范围3.1~15.1),中位持续缓解时间为4.7个月(95% CI:3.9~7.4)。mPFS为3.7个月(95% CI:3~4.9),mOS为7.8个月(95% CI:5.6~9.3)。
所有受试者都出现至少一种TRAE,最常见的是腹泻(24例[59%])、皮疹或痤疮(24例[59%])、口腔炎(11例[27%])或ALT/AST升高(8例[20%])。11名受试者(27%)发生3至4级TRAE,未报告与治疗相关的死亡。两种(5%)间质性肺病与阿法替尼有关(2级和1级)。9名(22%)受试者的剂量减少至30 mg/d,最常见的是口腔炎(3例[7%])和腹泻(3例[7%])。3例患者因间质性肺病(2级)、口腔炎(3级)或血小板减少症(4级)而停用阿法替尼。
医谷回声
……
1-
6月1日, JAMA :调整粪便免疫化学测试阳性阈值以提高结直肠癌测试敏感性 [5] 。
粪便免疫化学测试(FIT)是全球应用最广泛的CRC筛查测试手段之一。但其在检测早期CRC及其前体方面敏感性有限。mt-sRNA测试虽然在检测CRC方面敏感性更高,但同时也会降低特异性。因此,该研究尝试通过调整FIT的阳性阈值,在不降低特异性的情况下,达到与mt-sRNA测试相似的敏感性。
BLITZ研究是一项大规模前瞻性研究,研究人员在2008~2020期间招募了10061名参与者提供粪便样本,并尝试将FIT的阳性阈值从17 μg血红蛋白每克粪便降低到8.8 μg/g,以实现与mt-sRNA测试相同的阳性率(17%)。结果显示调整后的FIT在检测结直肠癌的敏感性(94.9%)和特异性(86.9%)上与mt-sRNA测试相当。
未来研究人员将在提高检测微小病变能力,降低假阳性和假阴性结果等方向持续探索,进一步提高CRC筛查测试性能。
高峰科讯
……
1-
7月3日, Signal Transduction and Targeted Therapy :南京医科大学张业伟教授发现Sema3C重塑基质微环境以促进HCC进展 [6]。
超过90%的HCC在纤维化或肝硬化的情况下发展,由于癌症相关成纤维细胞(CAF)和癌症干细胞(CSC)之间错综复杂的相互作用,HCC的肿瘤微环境(TME)与众不同,它们共同调节HCC的进展。
研究者发现,Sema3C在纤维化肝脏、HCC组织、HCC患者外周血以及索拉非尼耐药组织和细胞中的显著上调,其过表达与HCC干性特性的获得相关。NRP1和ITGB1是Sema3C的关键功能受体,激活下游AKT/Gli1/c-Myc信号通路以增强HCC的自我更新和肿瘤起始。此外,HCC细胞来源的Sema3C促进体内细胞外基质(ECM)收缩和胶原沉积,同时还促进肝星状细胞(HSC)的增殖和活化。
从机制上讲,Sema3C与HSC中的NRP1和ITGB1相互作用,激活下游NF-kB信号传导,从而刺激IL-6的释放并上调HMGCR表达,从而增强HSC中的胆固醇合成。此外,CAF分泌的TGF-β1激活AP1信号转导以增强HCC细胞中Sema3C的表达,从而建立加速HCC进展的正反馈回路。
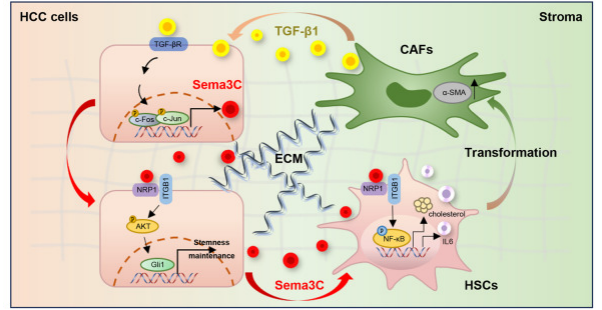
Sema3C可作为HCC的生物标志物,阻断Sema3C可以有效抑制HCC发展并解除索拉非尼耐药。
2-
6月21日, Science :发现乳腺癌软脑膜转移治疗新靶点 [7]。
乳腺癌细胞入侵软脑膜会导致极差的治疗结局,但目前乳腺癌细胞在软脑膜内转移和增殖的分子机制尚不清晰,严重限制了有效治疗方法的开发。
研究人员通过结合活体和离体三维共聚焦显微镜、显微计算机断层扫描和组织学分析对骨转移和软脑膜转移的乳腺癌小鼠模型进行分析,最终发现乳腺癌细胞可通过表达神经引导整合素α6与血管基底膜层粘连蛋白结合,绕过血脑屏障,通过腔内导静脉迁移从骨髓转移到软脑膜。
到达软脑膜中的乳腺癌细胞会继续刺激巨噬细胞分泌胶质细胞源性神经营养因子(GDNF),帮助转移瘤在营养匮乏的软脑膜中生存下来,表达GDNF受体神经细胞黏附分子(NCAM)的乳腺癌细胞可以转导抗凋亡信号,提高其在软脑膜的存活率。此外,鞘内GDNF阻断、巨噬细胞特异性GDNF消除或在乳腺癌细胞中敲除NCAM均可抑制软脑膜内乳腺癌细胞的生长。
未来可将整合素α6和GDNF信号轴作为治疗靶点,持续开发针对乳腺癌软脑膜转移的新疗法。
3-
6月25日, Nature Communications :中国科学院上海药物研究所郑明月教授开发整合化学诱导转录谱的深度表征学习模型 [8]。
使用人工智能探索药物表型可突破缺乏明确药物靶点的限制,获得不同药物作用下的全基因谱表达情况,提供细胞和机体状态的全面信息。深度学习模型能够利用公开数据预测新型化合物的基因转录谱,但直接拟合基因表达值的监督学习模型难以从混杂因素和表达谱的固有噪声中区分真实的扰动信号,限制了试验的探索深度。
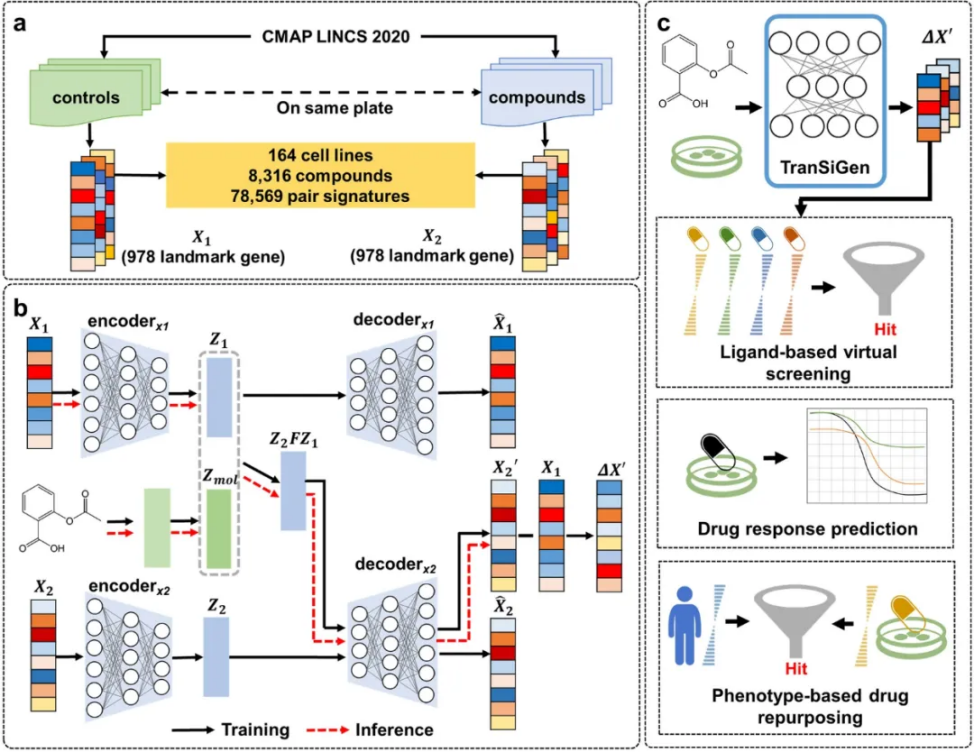
因此,该研究使用一种采用自我监督表示学习的深度生成模型TranSiGen,同时学习无干扰的基础分布、化学诱导的干扰分布以及它们之间的映射关系,有效地减轻了数据中的噪声,并揭示了潜在的干扰信号。
TranSiGen能够分析基底细胞基因表达和分子结构,以高精度重建化学诱导的转录谱。通过捕获细胞和化合物信息,TranSiGen衍生的表征结果在基于配体的虚拟筛选、药物反应预测和基于表型的药物再利用等各种任务中均可发挥作用。在筛选抗胰腺癌化合物的应用中,体外验证的效果和高命中率证实TranSiGen具备识别有效化合物的能力,将TranSiGen整合到基于表型的药物发现过程中能够显著提高效率,降低成本。
刊后语
大风泱泱,大潮滂滂;大道如砥,医者无疆。
积跬步以至千里,每一期周刊都是恶性肿瘤学科发展的剪影;积小流以成江海,一年周刊浓缩肿瘤领域各科前沿进展的精华!关注CACA周刊,带你领略恶性肿瘤学科发展的四季花开。
CACA周刊,我们下周不见不散!
编辑 | 李瑞源 YANG
排版 | 晓晓
审核 | 李瑞源
链接:http://www.lewenyixue.com/2024/09/11/%E3%80%90CACA%E5%91%A8%E5%88%8A%E3%80%9175%E6%9C%9F%20%E5%9F%BA%E5%9B%A0%E9%A9%B1%E5%8A%A8%E7%81%AD%E8%82%BF%E7%98%A4%E2%80%94/







赶快来坐沙发